吉非替尼联合调强放疗治疗老年中晚期非小细胞肺癌效果及对血清miR-224、miR-195 表达作用
刘新菊 贺春语 刘冬梅 邱荣良
肺癌属世界范围内最常见恶性肿瘤之一,在我国城市人口恶性肿瘤死因中肺癌位居第一,而老年群体受自身生理机能衰退等诸多因素影响,成为肺癌高发人群[1-2]。非小细胞肺癌(Non-small cell lung cancer,NSCLC)约占全部肺癌的80%以上,且其发病隐匿性强,约75%的患者发现时已进展至中晚期[3]。目前调强放射治疗是临床治疗中晚期NSCLC 的主要手段,其优势是能在照射野内按临床要求调整剂量,显著提升肿瘤局部控制率,减少对周围正常组织的损伤,但受个体对放射敏感性的差异影响,仍有部分患者即使经全疗程,全量调强放射治疗后仍未达预期效果[4]。吉非替尼是最先应用于临床的一种表皮生长因子受体酪氨酸激酶抑制剂(EGFR-TKI),能选择性结合表皮生长因子受体,抑制肿瘤细胞的生长,抑制其血管升成,发挥抗肿瘤效果,有研究表明,其在NSCLC 治疗中具有良好成本-经济学效益[5]。目前吉非替尼联合调强放疗治疗NSCLC 效果如何,尚缺乏数据支持,miR-224、miR-195 等微小核糖核酸在NSCLC 增殖、凋亡、侵袭等多种生物学过程中发挥关键性作用,有研究提示miR 及其相关基因与NSCLC 患者放疗敏感性的相关性[6]。本研究探究吉非替尼联合调强放疗对老年中晚期NSCLC 的效果及对血清miR-224、miR-195 表达作用,报告如下。
1 资料与方法
1.1 一般资料
选取了河南省肿瘤医院(郑州大学附属肿瘤医院)在2018 年2 月至2020 年2 月期间收治的老年中晚期NSCLC 患者92 例随机分为研究组和对照组,每组各n=46 进行研究。纳入标准:①符合NSCLC 诊断标准[7];②年龄≥60 岁;③预计生存期>6个月;④原发性NSCLC 患者、家属知情研究,签署同意书。排除标准:①伴随有其他重大或恶性疾病的患者;②经治疗后复发的患者;③对本研究药物禁忌的患者;④不耐受放化疗的患者。研究组与对照组患者的基础资料均衡可比,差异无统计学意义(P>0.05),见表1。本研究经医院伦理委员会审核通过。
表1 两组一般资料上比较[(),n(%)]Table 1 Comparison of general data between the two groups[(),n(%)]

表1 两组一般资料上比较[(),n(%)]Table 1 Comparison of general data between the two groups[(),n(%)]
1.2 方法
1.2.1 研究组予以吉非替尼(海南齐鲁制药有限公司,国药准字H20163465)联合调强放疗
调强放疗:①靶区勾画:早期患者均经支气管镜及胸部强化CT 等方面的检查得到病灶位置等概况了解。患者行仰卧位,采用CT 模拟机,实施强化层厚为5 mm 的扫描定位,从全颈开始,再胸部和上腹部,同时将定位的图像传送至Pinnacle 治疗的计划系统中去,再通过三维重建技术来确定病灶的中心位置。与支气管镜等检查结合在CT图像上精准的勾画计划的靶体积(PGTV,PTV),临床靶体积(CTV)、心脏,双肺,脊髓,肿瘤及转移淋巴体积(GTV)及食管等周围危及器官(OAR)。其中肿瘤靶区(GTV):为强化CT 显示的肿瘤灶和肺门,纵隔及锁骨上转移淋巴结;临床靶区(CTV)为GTV 考虑亚临床病灶后生成,最终考虑呼吸运动幅度后,外放摆位误差后为计划靶区(PGTV,PTV)。②放射计划:采用了Pinnacle 治疗计划系统设计的逆向调强放疗方案,自动生成子野数目等,其中处方剂量为PGTV 60 Gy(2 Gy/次),PTV 51 Gy(1.7 Gy/次),1 次/日,5 次/周。口服吉非替尼250 mg/次,1 次/天,连用28 天为1 个周期,连续2 个周期观察效果。
1.2.2 对照组行调强放射
方案同1.2.1。
1.3 观察指标
1.3.1 比较两组疗效。
判断标准[8]:按实体瘤疗效评价为依据划分为完全缓解(complete response,CR)、部分缓解(partial remission,PR)、稳定(stable disease,SD)及进展(progressive disease,PD),疾病控制率(Disease Control Rate,DCR)=(CR+PR+SD)/总例数×100%;客观缓解率(objective response rate,ORR)=(CR+PR)/总例数×100%。
1.3.2 比较两组治疗前后血清肿瘤标志物指标
[细胞角质蛋白19 片段抗原21-1(CYFRA21-1)、鳞状细胞癌抗原(SCC)、癌胚抗原(CEA)]水平。检测方法:取患者在晨空腹时的肘静脉血2 mL 并离心取其上层血清,使上海信然实业有限公司生产的酶联免疫试剂盒检测CYFRA21-1、SCC、CEA 水平。
1.3.3 比较两组治疗前后免疫功能指标
(CD3+、CD4+、CD8+及CD4+/CD8+)。检测方法:抗凝管取患者晨空腹的肘静脉血2 mL,采用贝克曼库尔特流式细胞仪(CytoFLEX 型)检测CD3+、CD4+及CD8+水平,且CD4+/CD8+值进行计算。
1.3.4 检测血清miR-224、miR-195 水平
检测方法:分别于治疗前及完成2 个周期治疗后,晨空腹抗凝管取肘静脉血2 mL,以实时荧光定量PCR 技术测miR-224、miR-195 水平,所用试剂、试剂盒由上海科华生物工程股份有限公司提供。
1.3.5 比较两组不良反应情况
统计研究组与对照组白细胞减少、血小板减少、放射性肺炎、恶心呕吐、皮疹、腹泻不良反应发生率。
1.3.6 随访
3 年记录研究组与对照组生存率。
1.4 统计学方法
本研究采用SPSS 22.0 统计学软件分析数据。计数资料用n(%)表示,行χ2检验。计量资料用()表示,两组间比较行t检验。当P<0.05 为差异有统计学意义。
2 结果
2.1 两组疗效比较
研究组治疗后DCR 较对照组高,差异有统计学意义(P<0.05),研究组与对照组ORR 相比,差异无统计学意义(P>0.05)。见表2。
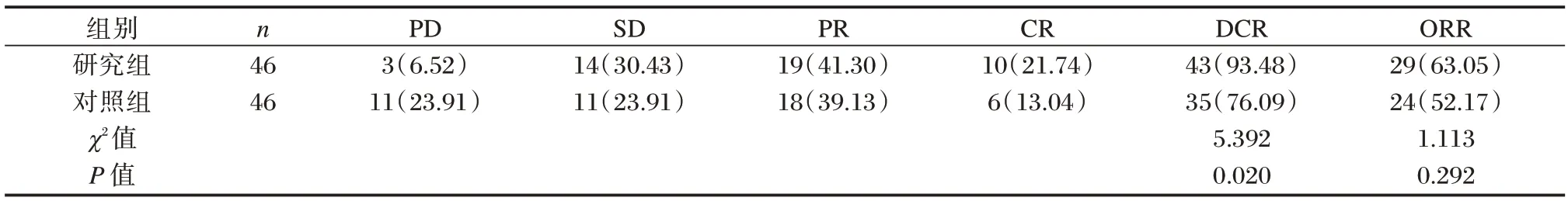
表2 研究组与对照组疗效比较[n(%)]Table 2 Comparison of efficacy between the study group and the control group[n(%)]
2.2 两组血清肿瘤标志物指标比较
研究组与对照组治疗前血清CYFRA21-1、SCC、CEA 水平相比,差异无统计学意义(P>0.05);研究组与对照组治疗后血清CYFRA21-1、SCC、CEA 水平较治疗前降低,且研究组低于对照组,差异有统计学意义(P<0.05)。见表3。
表3 两组血清肿瘤标志物指标比较(,ng/mL)Table 3 Comparison of serum tumor markers between the two groups(,ng/mL)
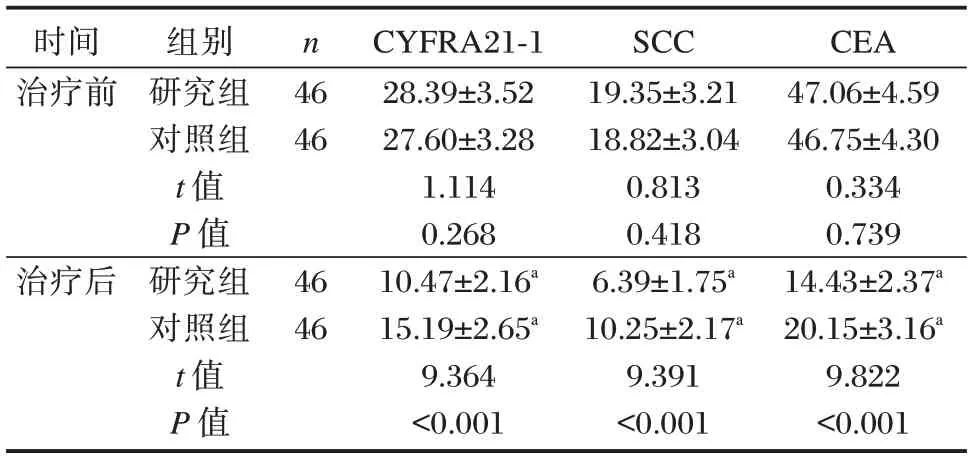
表3 两组血清肿瘤标志物指标比较(,ng/mL)Table 3 Comparison of serum tumor markers between the two groups(,ng/mL)
注:与本组治疗前相比,aP<0.05。
2.3 两组免疫功能指标比较
研究组与对照组治疗前血清CD3+、CD4+、CD8+、CD4+/CD8+水平相比,无统计学差异(P>0.05);研究组治疗后血清CD3+、CD4+、CD4+/CD8+水平较治疗前提高,且高于对照组,差异有统计学意义(P<0.05),研究组与对照组治疗后CD8+水平组间上比较及与本组治疗前上相比较,差异均无统计学意义(P>0.05)。见表4。
表4 研究组与对照组免疫功能指标比较()Table 4 Comparison of immune function indexes between the study group and the control group()
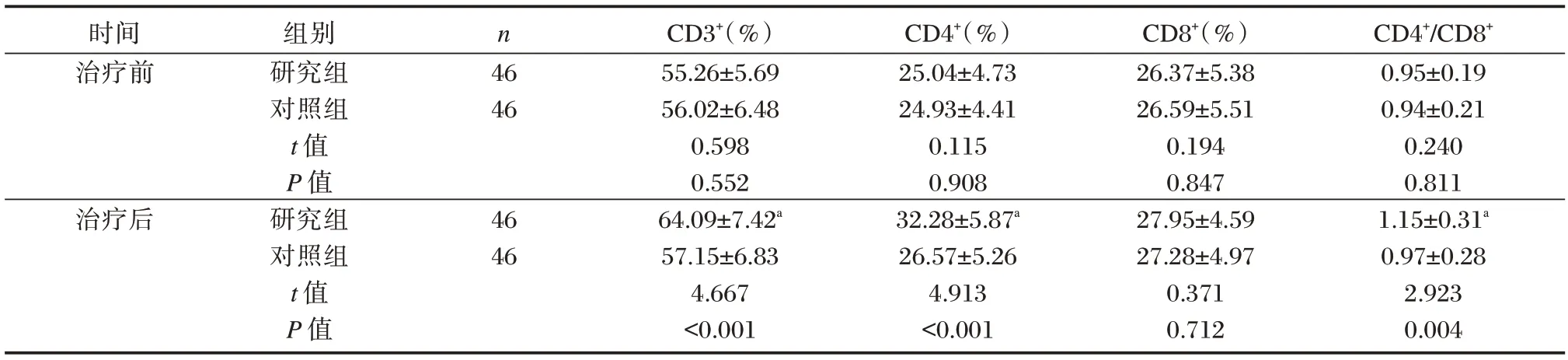
表4 研究组与对照组免疫功能指标比较()Table 4 Comparison of immune function indexes between the study group and the control group()
注:与本组治疗前相比,aP<0.05。
2.4 研究组与对照组血清miR-224、miR-195 水平比较
研究组与对照组治疗前血清miR-224、miR-195水平相比,无统计学差异(P>0.05);研究组与对照组治疗后血清miR-224 水平较治疗前降低,且研究组低于对照组,差异有统计学意义(P<0.05),miR-195水平较治疗前提高,且研究组高于对照组,差异有统计学意义(P<0.05)。见表5。
表5 研究组与对照组血清miR-224、miR-195 水平比较()Table 5 Comparison of serum miR-224 and miR-195 levels between the study group and the control group()

表5 研究组与对照组血清miR-224、miR-195 水平比较()Table 5 Comparison of serum miR-224 and miR-195 levels between the study group and the control group()
2.5 研究组与对照组不良反应比较
治疗期间,研究组与对照组不良反应发生率相比,无差异统计学意义(P>0.05)。见表6。
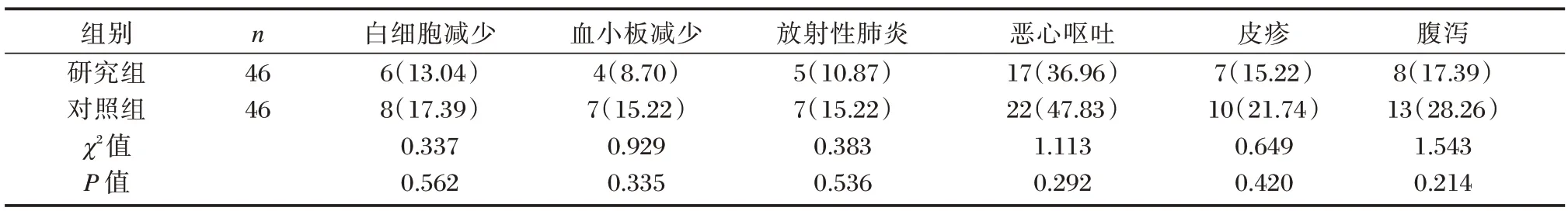
表6 研究组与对照组不良反应比较[n(%)]Table 6 Comparison of adverse reactions between the study group and the control group[n(%)]
2.6 两组生存率比较
经3 年随访,共有3 例病例脱落,研究组脱落1例,对照组脱落2 例。经检验显示,研究组与对照组治疗后1 年生存率相比,差异无统计学意义(P>0.05);研究组治疗后2 年、3 年生存率高于对照组,差异有统计学意义(P<0.05)。见表7。
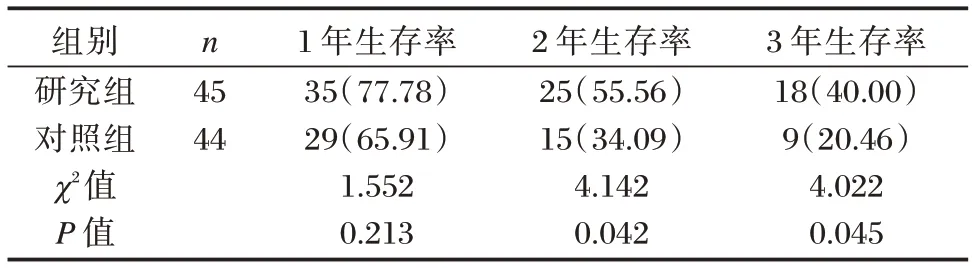
表7 研究组与对照组生存率上比较[n(%)]Table 7 Comparison of survival rate between study group and control group[n(%)]
3 讨论
NSCLC 是一种发病率、病死率均较高的恶性肿瘤疾病。尽管近年来伴随肿瘤学的进展,放疗技术,化疗方案的不断改善及靶向和免疫治疗的进步不断提升,但中晚期NSCLC 患者长期生存率仍未得到显著提高,因此,临床迫切需要探寻新的治疗方案。
调强放疗技术借助共面、非共面多野或多弧照射可确保高剂量能有效分布于三维方向、肿瘤靶区,继而在确保肿瘤靶区受高剂量照射的同时可保护附近正常器官组织。有研究显示,在放疗中同步应用吉非替尼在提升肿瘤局部控制率及转移率方面效果良好,具有协同作用[9]。本研究结果提示此治疗方案效果显著,能延长患者生存期,安全性高。
CYFRA21-1、SCC、CEA 是临床常用肿瘤病情评估工具,在NSCLC 患者中随恶性细胞持续增殖可释放CYFRA21-1、SCC、CEA 入血,病情越重其外周血中水平越高[10]。本研究结果说明二者联合可通过不同途径强化抗肿瘤效果,加快恶性细胞凋亡,恶性细胞持续增殖得到抑制,减少了CYFRA21-1、SCC、CEA 释放入血[11]。
T 淋巴细胞亚群是机体重要免疫系统组成部分,在NSCLC 进展中会对机体免疫系统产生抑制效应,表现外周血CD3+、CD4+降低[12]。本研究结果表明了吉非替尼联合调强放疗能显著改善老年中晚期NSCLC 患者免疫功能。吉非替尼作为一种靶向治疗药物,一方面不会对机体正常生理功能造成损害,另一方面也可通过激活下游靶分子以增强机体免疫功能,与调强放疗联合治疗NSCLC 具有协同作用,可在调强放疗消除NSCLC对机体免疫功能抑制效应的同时,进一步提高外周血CD3+、CD4+水平[13]。
相关研究发现,microRNA 在肿瘤发生、发展及转移过程中发挥重要作用,且在肿瘤患者外周血中可检测到microRNA 异常表达[14-15]。本研究发现,治疗前老年中晚期NSCLC 患者外周血miR-224 升高,miR-195 降低情况,与上述报道microRNA 异常表达一致。本研究结果说明吉非替尼联合调强放疗可调节miR-224、miR-195 表达,可能是与此方案能提高NSCLC 细胞杀伤作用,有效降低,甚至消除肿瘤负荷有关,但具体机制尚未明确,需后期基础研究进一步证实。
总之,吉非替尼联合调强放疗治疗老年中晚期NSCLC 可通过改善免疫功能,调节miR-224、miR-195 表达,提高治疗效果,降低血清肿瘤标志物水平,延长患者生存期,且不增加不良反应发生率,值得应用。本研究不足之处在于病例数量较少,追踪时长较短,后期会持续跟进研究,扩大样本量,并且增加阶段性数据监测及分析,并增加对吉非替尼与micro RNA 的相关性研究。

