滩羊肉成熟过程中糖酵解与保水性之间的关系
王金霞,刘吉娟,罗瑞明,李 荣,陈雪妍,张 倩,胡丽筠
(宁夏大学食品科学与工程学院,宁夏 银川 750000)
滩羊是广泛分布于宁夏、甘肃、陕西等地的区域性优质品种家畜,其肉质细嫩、无膻味、营养丰富、脂肪分布均匀,备受消费者喜爱,具有重要的经济及食用价值。目前,关于滩羊肉的研究主要集中于通过宰前控制对滩羊肉品质形成进行影响[1-2]以及通过控制宰后因素对滩羊肉品质进行影响。
当外力作用于肉制品肌肉时,仍可以保持水分和补充水分的能力称为肉的保水性[3]。目前,关于宰后肉品保水性影响的研究主要集中于:AMP依赖的蛋白激酶(adenosine 5′-monophosphate (AMP)-activated protein kinase,AMPK)活性变化影响糖酵解相关酶活性,从而影响肉品的保水性;不同的贮藏、解冻方式造成肌原纤维解离,从而影响肉品的保水性;宰后胴体关键结构骨架蛋白质的氧化、变性、降解引起肌纤维结构发生断裂、损伤、肌原纤维小片化等,进而导致肉的保水性下降。朱立贤等[4]研究了宰后牛背最长肌AMPK活性、保水性和糖酵解经不同的温度处理后的变化情况,结果发现AMPK通过调控丙酮酸激酶活性调节糖酵解的速率,导致贮藏损失发生改变,最终影响肉品的持水力。李天翔等[5]研究了4 种解冻方式下鲣鱼鱼肉蛋白质和组胺的含量变化,结果表明冷藏库解冻较好地保持了肌原纤维蛋白的结构和功能特性,肉品保水性较好。以上研究结果表明,动物屠宰后肌肉所发生的生化变化对保水性具有重要影响。
滩羊屠宰后机体内氧气供应中断,组织主要依靠糖酵解途径维持机体的正常生命活动,当糖酵解相关酶失活或肌糖原耗尽时,糖酵解进程则会受到阻碍,从而无法正常进行。因此,糖酵解对肉品质变化有重要影响。本实验以滩羊背最长肌为研究对象,通过测定其在4 ℃成熟8 d过程中糖酵解的变化对保水性的影响,并对其进行相关性分析,以期阐明滩羊肉成熟过程中糖酵解程度与保水性的关系,为后续揭示糖酵解调控保水性的机制奠定基础,并为冷却滩羊肉贮藏期间肉品质量控制技术研发提供一定的理论参考。
1 材料与方法
1.1 材料与试剂
所用滩羊背最长肌取自宁夏盐池县大夏牧场食品有限公司,选取胴体质量相近的6 月龄公滩羊9 只,宰前遵循动物管理规定,屠宰后立即用灭菌刀取下右侧背最长肌,剔除可见脂肪与结缔组织后,置于聚乙稀薄膜内,用锡纸包装后置于带有编号的保鲜袋中,贮存在4 ℃条件下,在成熟0、1、2、3、4、8 d时分别检测相应指标。
磷酸氢二钠、氯化镁、乙二胺四乙酸、氯化钾(均为分析纯)国药集团化学试剂有限公司;磷酸盐缓冲液(phosphate buffered saline,PBS)(0.01 mol/L,pH 7.4)北京索莱宝科技有限公司;钙蛋白酶-1、ATP、葡萄糖、糖原、乳酸、乳酸脱氢酶、丙酮酸激酶酶联免疫吸附测定试验(enzyme-linked immunosorbent assay,ELISA)试剂盒 上海优选生物科技有限公司。
1.2 仪器与设备
SJ-3F便携式pH计 上海德图仪器国际贸易有限公司;TG16W型离心机 湖南湘仪实验室仪器开发有限公司;DZKW-C型电子恒温水浴锅 沧州新三思试验仪器有限公司;352型酶标仪 芬兰Labsystems Multiskan MS公司;NM120低场脉冲核磁共振分析仪苏州(上海)纽迈电子科技有限公司。
1.3 方法
1.3.1 样品采集
采集0、1、2、3、4、8 d的样品各200 g,用于测定pH值、滴水损失率及贮藏损失率;采集不同成熟期间的样品各20 g,迅速置于液氮中放置2 h后转移至-80 ℃冰箱中保存,用于其他指标测定。
1.3.2 pH值测定
剔除样品可见脂肪与结缔组织,使用便携式pH计测定成熟期间肌肉pH值。
1.3.3 保水性指标测定
1.3.3.1 滴水损失率
参照左惠心[6]的方法并略作修改。将约50 g的样品准确称质量,记为m1,用绳子悬挂在密闭自封袋中,确保样品与自封袋不接触,置于4 ℃冰箱中,待成熟0、1、2、3、4、8 d后取出,用滤纸擦干表面水分后称质量,记为m2。滴水损失率按式(1)计算:
1.3.3.2 贮藏损失率
参照Cardoso等[7]的方法并略作修改。将约50 g的样品准确称质量,记为m3,装入自封袋中密闭,置于4 ℃的冰箱中贮藏,待成熟0、1、2、3、4、8 d后取出,用滤纸擦干表面水分后称质量,记为m4。贮藏损失率按式(2)计算:
1.3.3.3 离心损失率
参考Zhang等[8]的方法并稍作修改。将成熟0、1、2、3、4、8 d样品分别切成4 cm×1 cm×0.5 cm的长条形,准确称质量,记为m5,置于10 mL离心管中于4 ℃、4 000×g离心15 min,将离心管中的样品倒出并用滤纸擦干表面水分,称质量并记为m6。离心损失率按式(3)计算:
1.3.3.4 水分分布测定
参考孙文彬等[9]的方法并略作修改。设置仪器温度为32 ℃,预热30 min后使用。测定前使用标样的自由感应衰减(free induction decay,FID)进行校准,FID的参数为SF=18、TW=1 000、NS=1、SW=100、DRG1=2、RFD=0.05、TD=1 024、RG1=20。将样品沿肌纤维方向切割成1 cm×1 cm×2 cm的肉条,称质量后放入核磁共振测定专用试管底部进行测定,样品测定所用CPMG的参数为SF=18、SW=200、TW=3 000、TE=0.251、NECH=5 000、NS=8、P2=33、DRG1=3、RFD=0.2、RG1=20。
1.3.4 钙蛋白酶-1活性测定
取适量肌肉于预冷后的PBS(0.01 mol/L、pH 7.4)中清洗去除血液,称取1 g样品剪碎后,加入10 倍体积PBS(0.01 mol/L、pH 7.4),置于匀浆器中,在0 ℃、65 Hz条件下匀浆60 s。将所得液体5 000×g离心10 min,取其上清液进行检测。钙蛋白酶-1活性测定按照钙蛋白酶-1 ELISA检测试剂盒的要求进行,使用酶标仪于450 nm波长处测定吸光度。
1.3.5 肌原纤维小片化指数(myofibril fragmentation index,MFI)测定
参考Ilian等[10]的方法并略作修改。取称取0.5 g样品,加入10 倍体积的缓冲液(0.02 mol/L磷酸氢二钠、0.001 mol/L氯化镁、乙二胺四乙酸0.001 mol/L、0.1 mol/L氯化钾,pH 7.1),在0 ℃、65 Hz条件下匀浆30 s,4 ℃、3 000×g离心15 min,倒掉上清液,取沉淀重复上述操作1 次。向最终沉淀中加入5 mL上述缓冲液重悬3 min,悬浊液用200 目尼龙筛网过滤,得到肌原纤维蛋白溶液。用BCA法在540 nm波长处测定肌原纤维蛋白吸光度,将得到的数值乘以200即为MFI。
1.3.6 糖酵解指标测定
样品处理同1.3.4节,实验操作按照ATP、葡萄糖、糖原、乳酸、乳酸脱氢酶、丙酮酸激酶ELISA检测试剂盒的要求进行,使用酶标仪于450 nm波长处测定吸光度。
1.4 数据处理与分析
2 结果与分析
2.1 宰后滩羊成熟期间pH值变化
糖酵解可以产生丙酮酸和ATP,ATP发生水解生成H+,随着糖酵解的进行H+大量堆积,导致肌肉pH值下降,因此,宰后肌肉的糖酵解水平可以决定肉的pH值。由图1可知,宰后0~4 d pH值显著降低(P<0.05),并在4 d时降至最低(5.63),4 d后pH值显著升高(P<0.05),并于8 d时升高至5.75。Tao Yingmei[11]及姬琛[12]等的研究表明,宰后成熟期间滩羊pH值变化范围为5.4~6.3,本实验研究结果符合这一规律。宰后成熟期间,肌肉pH值的变化显著影响机体内代谢酶的活性,对于肉品的色泽、保水性、嫩度和风味前体物质等具有重要影响[13]。宰后成熟早期,AMPK活性的升高导致糖酵解相关酶活性发生改变,促进了糖酵解代谢进程,而机体产生的乳酸无法通过三羧酸循环系统排出体外,只能堆积在肌肉组织中,所以导致肌肉pH值的下降[14]。宰后成熟后期,机体进行一系列分解代谢,逐渐消耗了堆积在肌肉组织中的酸性物质,因此肌肉pH值开始上升[15]。
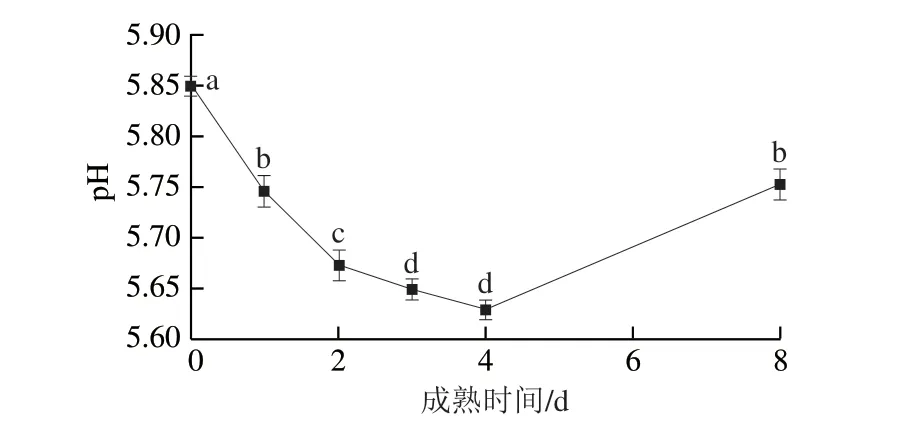
图1 宰后滩羊成熟期间pH值的变化Fig.1 Changes in pH of Tan sheep meat during postmortem aging
刘秋凤等[16]的研究表明,pH值的下降一方面影响肌原纤维蛋白降解酶活性,另一方面还影响蛋白质与水分的结合度,当pH值达到蛋白质的等电点时,蛋白质发生变性,肌纤维空间结构逐渐减小,导致不易流动水转化为自由水并流失,引起滩羊肉保水性下降;当pH值偏离蛋白质等电点时,造成肌动球蛋白解离,肌原纤维空间结构逐渐扩大,细胞外的水分重新渗入,引起滩羊肉保水性上升[17]。因此,宰后成熟过程中肌肉pH值通过改变蛋白质等电点引起肌原纤维空间结构发生变化,进而对保水性产生重要的影响。
2.2 宰后滩羊成熟期间保水性指标变化
由图2可知,随成熟时间的延长,滩羊背最长肌的滴水损失率、贮藏损失率及离心损失率均呈先增大后减小的趋势(P<0.05),并在4 d时达到最大值,分别为7.42%、5.14%与5.24%。左惠心[6]以牦牛背最长肌为研究对象,探究了成熟过程中的高保水性组和低保水性组滴水损失情况,结果发现高、低保水性组滴水损失均呈先上升后下降的趋势。牛克兰[18]以牦牛背最长肌为研究对象,探究了冷鲜牦牛肉贮藏损失情况,结果表明宰后成熟期间贮藏损失呈先增大后减小趋势。马旭华[19]以秦川牛背最长肌为研究对象,探究了成熟期间离心损失的变化规律,结果发现随着成熟时间的延长离心损失率呈先增大后减小的趋势。本研究结果与以上研究结果相符。
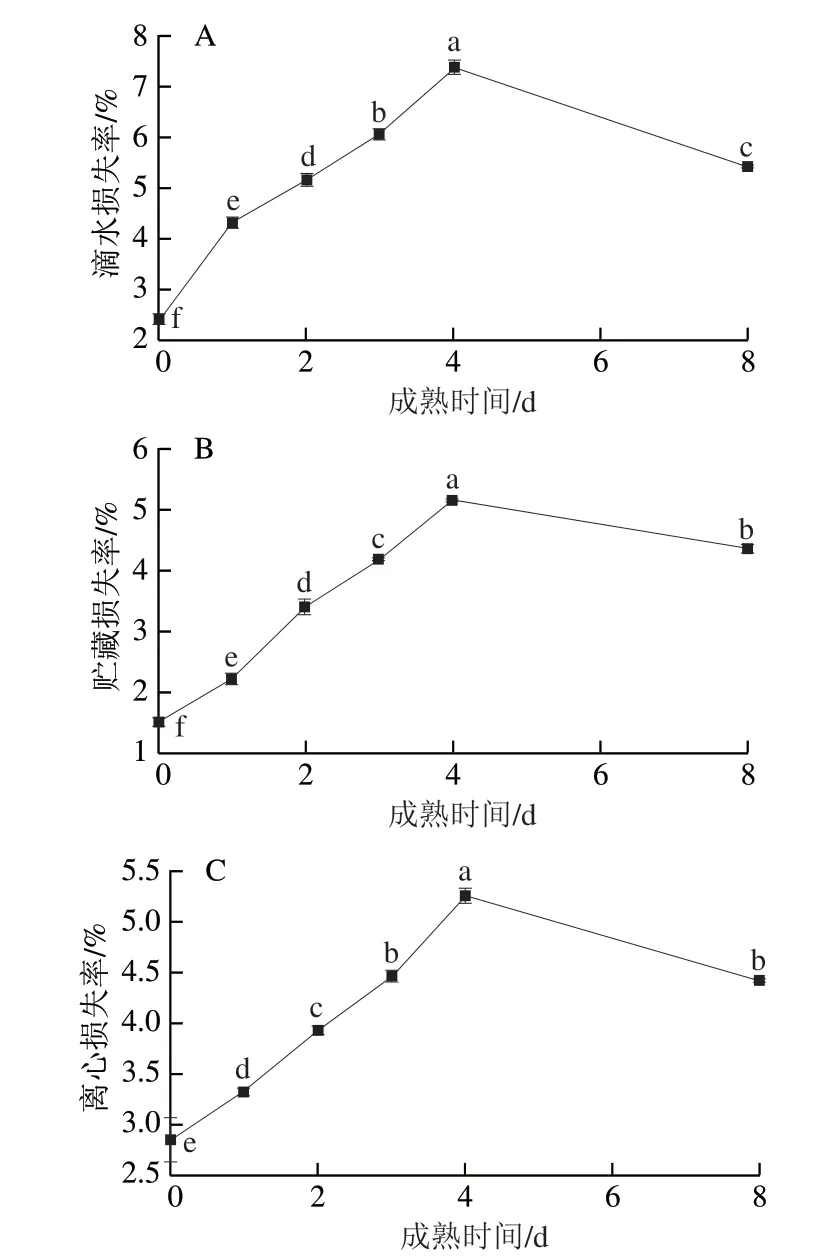
图2 宰后滩羊成熟期间保水性指标的变化Fig.2 Changes in water retention indexes of Tan sheep meat during postmortem aging
滴水损失、贮藏损失与离心损失越高,肉的保水性越差。肌肉中的水分主要有3 种存在形式,即自由水、结合水、不易流动水。宰后成熟初期,钙蛋白酶的水解作用导致肌肉组织结构的完整性遭到破坏[20],存在于细胞间隙的自由水在重力作用下流失。随成熟时间的延长,pH值的下降、肌原纤维蛋白的解离以及肌细胞的收缩,导致肌原纤维与肌原纤维之间、肌原纤维和肌膜之间形成滴水通道,引起不易流动水向自由水转换,并在重力作用下造成滴水、贮藏及离心损失的升高,最终导致宰后成熟期间滩羊肉保水性变差[12]。宰后成熟后期肌肉解僵成熟,大多数自由水和不易流动水均已损失,pH值偏离蛋白质的等电点,导致蛋白质对水的吸附能力增强,引起细胞外的水分重新渗入组织内,滴水损失贮藏损失和离心损失逐渐减少。
2.3 宰后滩羊成熟期间水分分布的变化
宰后滩羊肉成熟过程中的横向弛豫时间分布如图3所示,不同成熟时间滩羊肉的横向弛豫时间T2图谱中均出现3 个特征峰,在0.1~10 ms(T21)范围内出现第1个峰,在10~100 ms(T22)范围内出现最大峰,在100~1 000 ms(T23)出现第3个峰,此峰的弛豫时间最长。各峰所占的峰面积、峰比例均不同,其中T22占据的峰面积最大、峰比例最高,可以反映出滩羊肉中存在不同状态的水,且水分大多以不易流动水的形式存在。

图3 宰后滩羊成熟期间横向弛豫时间分布图Fig.3 T2 distribution of Tan sheep meat during postmortem aging
宰后滩羊肉成熟过程中弛豫时间T2的变化如图4所示,随成熟时间延长,横向弛豫时间T21总体无明显变化,这可能是因为结合水紧密地附着在蛋白质等大分子的极性基团上,并不随成熟过程流失[21]。T22总体呈显著下降趋势(P<0.05),这可能是因为随成熟时间延长,肌纤维的结构被破坏,肌肉不断收缩产生压力,在压力的作用下,肌肉中自由度较高的不易流动水逐渐流失,而自由度较低的不易流动水仍被束缚在肌原纤维中[22]。T23总体呈显著下降趋势(P<0.05),这是由于自由水在成熟期间最先流失。

图4 宰后滩羊成熟期间横向弛豫时间T2的变化Fig.4 Changes in transverse relaxation time T2 of Tan sheep meat during postmortem aging
2.4 宰后滩羊成熟期间钙蛋白酶-1活性的变化
由图5可知,滩羊在宰后成熟过程中,钙蛋白酶-1活性呈现持续下降趋势(P<0.05),这与杜曼婷等[23]的研究结果一致。滩羊宰后钙蛋白酶-1活性随成熟时间延长而下降,说明钙蛋白酶-1的活性结构在成熟过程中逐渐丧失。这可能是因为宰后成熟过程中,机体内主要进行糖酵解反应,pH值的快速下降导致钙蛋白酶-1自溶后激活其活性,催化肌原纤维蛋白降解[24]。钙蛋白酶-1为水解肌原纤维的蛋白质,大量研究表明钙蛋白酶-1参与肌原纤维装配过程。Huff-Lonergan等[25]研究发现,钙蛋白酶系统会引起肌纤维蛋白不断降解,造成肌原纤维小片化,导致细胞纤维之间形成滴水损失通道,引起大部分不易流动水转换为自由水,在重力作用下不断流失,最终对滩羊肉的保水性造成影响。
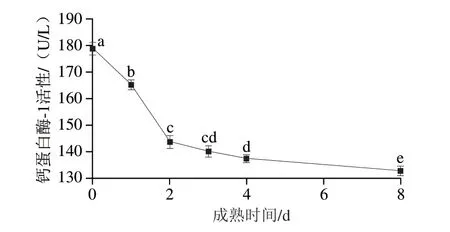
图5 宰后滩羊成熟期间钙蛋白酶-1活性的变化Fig.5 Changes in calpain-1 activity of Tan sheep meat during postmortem aging
2.5 宰后滩羊成熟期间MFI的变化
由图6可知,MFI在宰后0~4 d内迅速从111.93上升至165.93(P<0.05),但宰后4~8 d滩羊的MFI随成熟时间的延长并未发生显著性变化(P>0.05)。这可能是因为宰后成熟初期钙蛋白酶-1的水解作用导致肌肉组织Z线结构崩塌、肌钙蛋白T消失、肌动蛋白和结蛋白降解,进而造成肌原纤维小片化[26],成熟后期由于钙蛋白酶活性持续下降、不断降解,肌肉组织结构不再发生改变,因此MFI并未发生显著变化。Delgado[27]和Veiseth[28]等的研究结果均表明羊肉的MFI上升主要发生在宰后初期,之后的上升速率和幅度并不明显,这与本实验研究结果相似。滩羊超过90%的MFI增加量发生在宰后成熟的4 d内,即0~4 d内滩羊肌纤维蛋白降解程度较高,肌纤维结构遭到严重破坏,导致细胞纤维之间形成滴水损失通道,引起大部分不易流动水转换为自由水,在重力作用下不断流失,最终对滩羊肉的保水性造成影响。
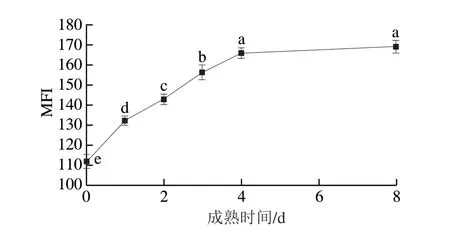
图6 宰后滩羊成熟期间MFI的变化Fig.6 Changes in MFI of Tan sheep meat during postmortem aging
2.6 宰后滩羊成熟期间糖酵解指标变化
糖酵解是宰后肌肉细胞能量的主要来源。由图7A可知,宰后0~8 d滩羊背最长肌中ATP含量显著下降(P<0.05)。这可能是因为滩羊宰后成熟期间为保证细胞各项生命活动正常进行,ATP被快速消耗,虽然ATP和ADP时刻不停地发生相互转化,但这仅能缓解短期内的能量缺乏[29],糖酵解可以产生丙酮酸和ATP,但ATP发生水解可以生成H+,糖酵解的不断进行会导致H+大量堆积,最终导致肌肉pH值下降[30]。因此,ATP水平在宰后成熟期间呈持续降低趋势。如图7B所示,随着成熟时间的延长糖原含量呈持续下降趋势(P<0.05),这是因为滩羊宰后机体内氧气供应中断,主要依靠糖酵解途径分解糖原提供机体所需能量,本实验研究结果与田甲春等[31]的研究结果一致。如图7C所示,宰后0~4 d葡萄糖含量显著升高(P<0.05),并在4 d时达到最高(209.19 pg/mL),肌肉组织在宰后初期通过糖酵解将糖原转化为葡萄糖以维持能量供应。宰后4~8 d葡萄糖含量显著下降(P<0.05),这是因为机体宰后受缺氧、缺血的刺激,加快了糖酵解进程,导致糖原含量不足,为维持组织内能量供应,进一步消耗了组织中有限的能源物质葡萄糖。本实验中滩羊背最长肌葡萄糖含量变化规律与Bai Yuqiang等[32]的研究结果一致。如图7D、E所示,宰后成熟期间,乳酸含量呈先上升后下降的趋势(P<0.05),3 d时乳酸浓度达到最大,为11.89 μmol/mL;丙酮酸激酶活性呈显著下降的趋势(P<0.05),在8 d时降至最低,为0 d时的58%,这与高永芳等[33]的研究结果相似。丙酮酸可以在乳酸脱氢酶的催化下进一步生成乳酸,最终造成乳酸的积累,成熟后期,糖酵解速率由于能源物质供应不足而逐渐减缓,导致乳酸含量开始不断下降[34]。如图7F所示,宰成熟期间乳酸脱氢酶活性呈先上升后下降的趋势(P<0.05),这可能是因为宰后初期AMPK活性的升高,提高了糖酵解过程中乳酸脱氢酶的活性,成熟后期pH值的下降则抑制了乳酸脱氢酶的活性,这与李泽[35]的研究结果一致。乳酸生成的过程可将还原型辅酶I(nicotinamide adenine dinucleotide,NADH)再生为NAD+,NAD+可进一步被还原为NADH。该过程是糖酵解过程中唯一的氧化反应,而糖酵解的维持需要糖原和NAD+的再生[36]。因此,糖原含量、乳酸含量可以反映宰后肌肉糖酵解的程度,影响肉质性状。
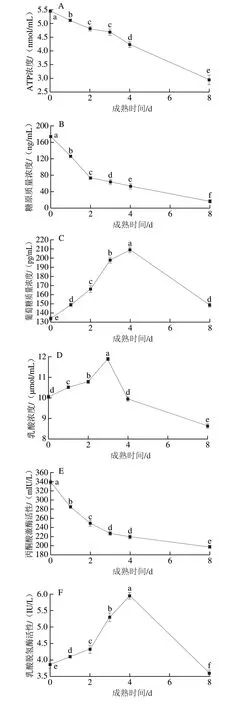
图7 宰后滩羊成熟期间糖酵解指标的变化Fig.7 Changes in glycolytic indexes of Tan sheep meat during postmortem aging
2.7 宰后滩羊成熟期间糖酵解程度与保水性的相关性分析
通过Pearson法算出糖酵解与保水性的相关性系数,如图8所示,pH值与滴水损失呈极显著负相关(P<0.01),与贮藏损失、离心损失呈显著负相关(P<0.05),而与T22、T23均呈显著正相关(P<0.05);AT P 含量与滴水损失、离心损失呈显著负相关(P<0.05),与贮藏损失呈极显著负相关(P<0.01),与T21、T22、T23均呈显著正相关(P<0.05,P<0.01);糖原与滴水损失呈显著负相关(P<0.05),与贮藏损失、离心损失呈极显著负相关(P<0.01),与T21、T22、T23均呈显著正相关(P<0.05,P<0.01);乳酸含量与滴水损失呈高度显著正相关(P<0.001),与贮藏损失、离心损失呈极显著正相关(P<0.01),而与T21、T22、T23均无相关性;T23与滴水损失、贮藏损失和离心损失均呈显著负相关(P<0.05)。
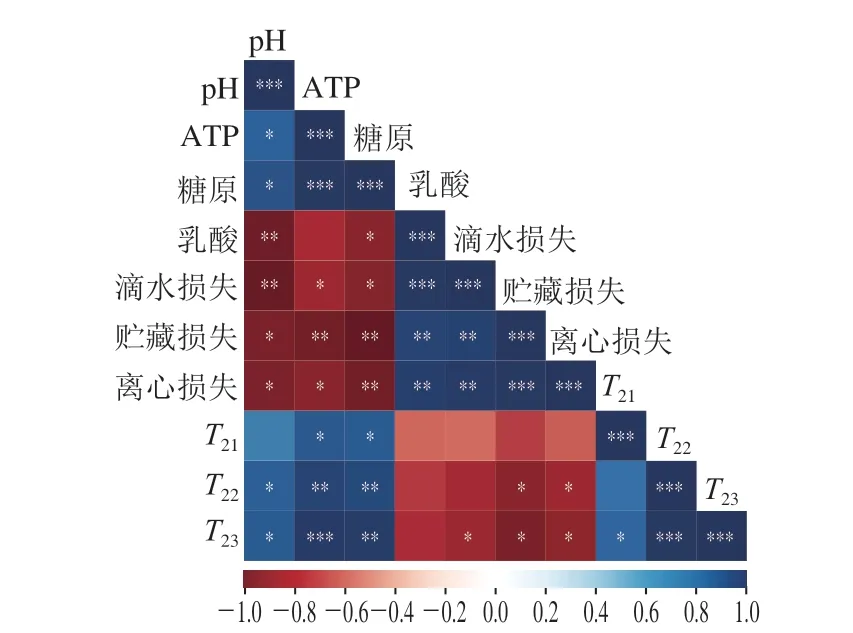
图8 宰后滩羊成熟期间糖酵解程度与保水性的相关性Fig.8 Correlation between glycolysis and water-holding capacity of Tan sheep meat during postmortem aging
相关性分析结果表明,滩羊肉宰后成熟过程中ATP含量的迅速降低可能加快了糖酵解进程,从而促进了糖原的消耗,引起乳酸的蓄积并降低肌肉pH值,导致蛋白质对水的吸附能力降低,同时,肌肉pH值的降低使钙蛋白酶-1活力持续下降,促使肌原纤维不断收缩,使不易流动水向自由水转化,导致肌肉中的水分在重力作用下不断流失,引起滩羊肉滴水损失率、贮藏损失率与离心损失率升高。综上所述,滩羊宰后糖酵解可能通过影响结构蛋白对水分吸附、酶的活性及水分状态的转化从而影响保水性。
3 结论
滩羊肉4 ℃成熟过程中,其背最长肌的滴水损失、贮藏损失呈先增大后减小的趋势;ATP、糖原含量持续下降;葡萄糖、乳酸含量呈上升后下降趋势;乳酸脱氢酶活性呈先增大后减小的趋势;丙酮酸激酶活性呈持续下降趋势。滩羊肉宰后糖酵解过程迅速被激活,为保证细胞各项生命活动正常进行,能量物质被快速消耗,引起糖酵解过程中的相关酶活性及代谢物含量发生改变,从而导致H+的不断蓄积,使得肌肉pH值发生改变,一方面,肌肉pH值的降低使钙蛋白酶-1活力持续下降,使得细胞纤维之间形成滴水损失通道,肌肉中的水分在重力作用下通过滴水损失通道不断流失,引起滩羊肉滴水损失率、贮藏损失率与离心损失率发生改变。另一方面肌肉pH值的变化使得蛋白质对水的吸附能力不断发生改变,最终影响宰后滩羊肉的保水性。

