秦川牛宰后成熟期间BSG对MAPK信号通路及细胞凋亡的影响
苏晓凤,李亚蕾,罗瑞明
(宁夏大学食品科学与工程学院,宁夏 银川 750021)
动物刚被屠宰放血后,线粒体仍有一定活性,但随着氧和营养物质供应的终止,细胞内氧化和抗氧化平衡体系被打破,活性氧大量累积,必然造成肌细胞的损伤、凋亡[1]。基础免疫球蛋白(basigin,BSG)是一种线粒体损伤蛋白,属于免疫球蛋白超家族,参与许多生理过程。研究表明,BSG可以通过激活细胞浆内丝裂原活化蛋白激酶(mitogen activated protein kinase,MAPK)通路增强激活基质金属蛋白酶(matrix metalloproteinase,MMP)的表达[2]。在细胞膜上,BSG是促进细胞单羧酸转运蛋白表达的协同分子。而单羧酸转运蛋白负责将胞内糖酵解过程生成的乳酸快速转运到胞外,从而保持糖酵解的持续进行以及维持胞内环境的稳定。由于单羧酸转运蛋白的表达增加,细胞外的微环境中乳酸含量明显增高,进而刺激了透明质酸的合成。而透明质酸的增加也会激活MAPK信号通路和PI-3K/AKT信号通路等,进而在缺血缺氧状态及治疗肿瘤疾病中充分发挥作用[3]。
BSG蛋白通过几种不同的信号通路发挥作用,这些信号通路往往具有细胞特异性,其中包括MAPK信号转导通路,RAF蛋白、RAS蛋白、ERK蛋白都是该通路中的关键因子。Boulos等[4]研究发现,BSG通过MAPK途径发挥作用,激活细胞外信号调节激酶ERK1/2信号。BSG激活了子宫成纤维细胞中的ERK1/2信号通路,致使MMPs的相对表达量增加;使用siRNA敲除BSG表达可显著降低ERK信号传导[5]。衣霉素作为N-乙酰葡萄糖胺转移酶抑制剂,可通过作用于BSG的N端结构使蛋白质去糖基化。通过抑制细胞内蛋白质的折叠使其生物学活性降低,从而诱导细胞凋亡。
尽管BSG基因在一些实体肿瘤中调控细胞生长和凋亡的作用已受到人们关注,但其在宰后贮藏过程肌细胞凋亡中的作用鲜见研究。因此本研究以秦川牛背上的最长肌为研究对象,采用4D-非标记定量(4D-label free quantification,4D-LFQ)组学方法分析在4 ℃条件下不同贮藏期秦川牛肉蛋白质水平的变化,结合京都基因与基因组百科全书(Kyoto Encyclopedia of Genes and Genomes,KEGG)富集分析明确BSG所参与的通路,另外通过BSG抑制剂衣霉素作用于秦川牛背最长肌,评估衣霉素对MAPK信号通路及细胞凋亡的影响。
1 材料与方法
1.1 材料与试剂
选用发育良好、体态健康的24 月龄秦川公牛。对样品采集所用到的刀具、镊子以及其他工具进行高压灭菌。按照商业化屠宰法对秦川黄牛进行宰杀,取其背最长肌,将每头牛的背最长肌平均分成3 份,总共9 个肉样,每个肉样切分成约120 g。将其用聚乙烯膜密封,并在4 ℃条件下冷藏不同时间。
BCA蛋白浓度测定试剂盒、考马斯亮蓝R-250、衣霉素 上海碧云天生物技术有限公司;ARAF兔克隆抗体北京索莱宝科技有限公司;ERK1兔克隆抗体、KRAS+HRAS+NRAS兔克隆抗体、MEK1/2兔隆抗体、GAPDH鼠克隆抗体、生物素化山羊抗兔免疫球蛋白G(H+L)美国Abclonal公司。
1.2 仪器与设备
-80 ℃冰箱、MK3型酶标仪 美国Thermo Fisher Scientific公司;MiniVac Alpha冷冻离心机 美国Scan Speed公司;高速冷冻研磨仪 武汉赛维尔生物科技有限公司;5200型化学发光凝胶成像仪 上海天能科技有限公司。
1.3 方法
1.3.1 样品制备
将样品分成空白组和衣霉素组。对衣霉素组注射浓度为20 μmol/L的衣霉素溶液,同时对空白组注射等剂量的生理盐水。用铝箔包裹后放入4 ℃条件下的冰箱中冷藏。贮藏0、2、4、6、8 d后,将空白组和衣霉素组的样品取出置于液氮2 h,取出将其放入-80 ℃冰箱中进行保存,作为测定MAPK通路关键蛋白质含量与细胞凋亡率的样品。
1.3.2 4D-LFQ蛋白质组学技术检测蛋白质含量
参照张杏亚等[6]的方法提取蛋白质、筛选空白组0、4、8 d的BSG并测定其相对表达量。参照罗辉等[7]的方法进行数据库搜索、生物信息学分析、筛选差异蛋白质。并利用DAVID 6.8数据库(https://david.ncifcrf.gov/)对BSG及相关差异蛋白作KEGG分析。
1.3.3 Western Blotting法检测MAPK通路关键蛋白质的含量
1.3.3.1 总蛋白提取
取出制备好的组织样品放入2 mL研磨管中,向每管中倒入匀浆液(样品与裂解液质量比1∶10)和3 mm钢珠,于高速冷冻研磨仪内匀浆,其中温度设置为-20 ℃,时间设置为60 s,重复研磨4 次,使组织碾碎。将研磨好的样品取出来,4 ℃的冰箱里裂解30 min,在12 000 r/min条件下离心10 min,离心结束后将上清液倒出,移到新的离心管内,贮存于-20 ℃。
1.3.3.2 样品测定
使用BCA蛋白定量试剂盒测定所提取的牛背最长肌总蛋白浓度。取出2 μL待测蛋白样品,添加裂解液至16 μL,取2 μL稀释后的蛋白溶液于孔中,并补充裂解液至20 μL,再加入200 μL BCA工作液混合,在37 ℃放置30 min,以0号孔为对照,测定样品在562 nm波长处的OD值;绘制标准曲线,将OD值代入标准曲线方程得到样品的蛋白质质量(μg),并计算蛋白质量浓度。
各样品组取50 μL,以体积比4∶1添加5×Loading buffer,于热循环仪中95 ℃、15 min混匀,-80 ℃保存。待积层胶凝固后,用清水洗净待测样品组的积层胶,进行电泳。上样量30 μL(5 μg/μL),电压调至100 V,电泳约0.5 h,待指示条带接触到分离胶界面后,再将电压调至180 V,继续电泳,约90 min后,待指示条带到达胶的底部,电泳结束。在100 V、200 mA条件下电泳,转膜1~2 h。将PVDF膜取出,置于孵育盒内,在室温条件下振荡封闭2 h。去除封闭液,用含吐温-20的Tris缓冲液(Tris buffered saline with Tween-20,TBST)略微清洗,将其擦干并剪切出所需的PVDF薄膜。
加入相应的一抗于密封盒内,于4 ℃进行一夜的孵育培养;用TBST将PVDF膜洗涤5 min,共洗涤3 次。加入相应的二抗,置于摇床在室温下培育2~3 h。将PVDF膜用TBST清洗3 次,每次10 min左右。
将PVDF膜平铺在曝光板上,滴加显影液,反应1 min,在化学发光凝胶成像仪下进行显影,并依据信号的强弱,对曝光程度以及曝光时间进行调整。采用天能GIS机箱控制软件V2.0对条带进行曝光扫描,分别测定牛背最长肌ARAF、ERK1、KRAS+HRAS+NRAS、MEK1/2蛋白质的相对表达量。
1.3.4 秦川牛肉贮藏过程中caspase-3活力的测定
取200 mg的冷冻肉样,在冷冻条件下,加入0.5 mL 100 mol/L Hepes(质量分数0.1% NP-40、质量分数10%蔗糖、10 mol/L mDTT,pH 7.5)裂解液破碎匀浆,在-20 ℃条件下反复冻融3 次,再18 000×g离心30 min,取其上清液,在4 ℃条件下保存备用。反应液则由20 μL裂解物的上清液、0.2 mL反应缓冲液(质量分数10%蔗糖、质量分数0.1% CHAPS、100 mmol/L Hepes,pH 7.5)以及5 μL重建的荧光底物组成。caspase-3作用的底物为Ac-DEVD-AMC。将反应溶液放入酶标仪96 孔板中,37 ℃孵育1 h,激发波长为360 nm,发射波长为460 nm,测其荧光强度。酶活性以1 min时1 mg肉样品的相对荧光强度表示。
1.4 数据处理
运用SPSS 28统计软件,通过ANOVA单因素方差分析法、Duncan多重比较对所得数据进行统计处理,明确数据之间的差异显著性(P<0.05)。并采用Origin 2021软件对所得数据作图。结果以表示。
2 结果与分析
2.1 蛋白质组学分析
2.1.1 BSG的筛选及表达量的变化
利用4D-LFQ组学方法对宰后牛肉蛋白质组的表达变化进行了研究和分析,并利用MaxQuant软件对获得的蛋白质进行质谱检索,共得1 149 个蛋白质,从中筛选出BSG,其表达变化见表1。BSG表达量呈现先升后降的趋势。在0~4 d,BSG表达量呈显著上升趋势(P<0.05)。宰后0 d的BSG表达量为0.824,宰后4 d的BSG表达量为1.146。此时,随着成熟时间的延长,牛肌细胞的线粒体损伤水平也逐渐提升,肉嫩度得到改善。宰后8 d的BSG表达量为0.971,与第4天相比,BSG表达量降低;此时随着肉质的进一步成熟,牛的肌细胞线粒体损伤水平也降低,使得嫩度下降。结果表明,BSG作为一种线粒体损伤蛋白,其表达量与细胞损伤程度成正比,对肌肉结构蛋白降解程度起到正向调控作用。
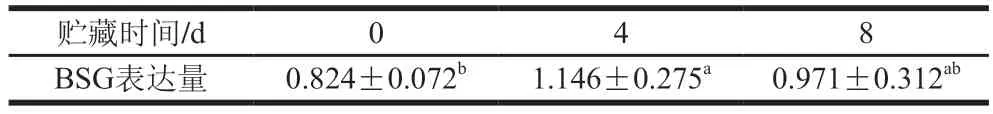
表1 秦川牛宰后贮藏期间BSG表达量的变化Table 1 Change in BSG concentration of Qinchuan cattle muscle during storage
2.1.2 差异蛋白质的筛选
设置差异倍数为1.2且P<0.05,共筛选鉴定出120 个差异丰富的蛋白质。其中4 d与0 d鉴定出38 个差异表达蛋白,8 d与0 d鉴定出73 个差异表达蛋白,8 d与4 d鉴定出42 个差异表达蛋白质。通过UniProt软件对所筛差异蛋白进行检索,利用功能特性筛出与BSG相关的差异蛋白,将此类蛋白质与BSG表达量作相关性分析,结果如表2所示。这些蛋白质与BSG的表达均显著相关。
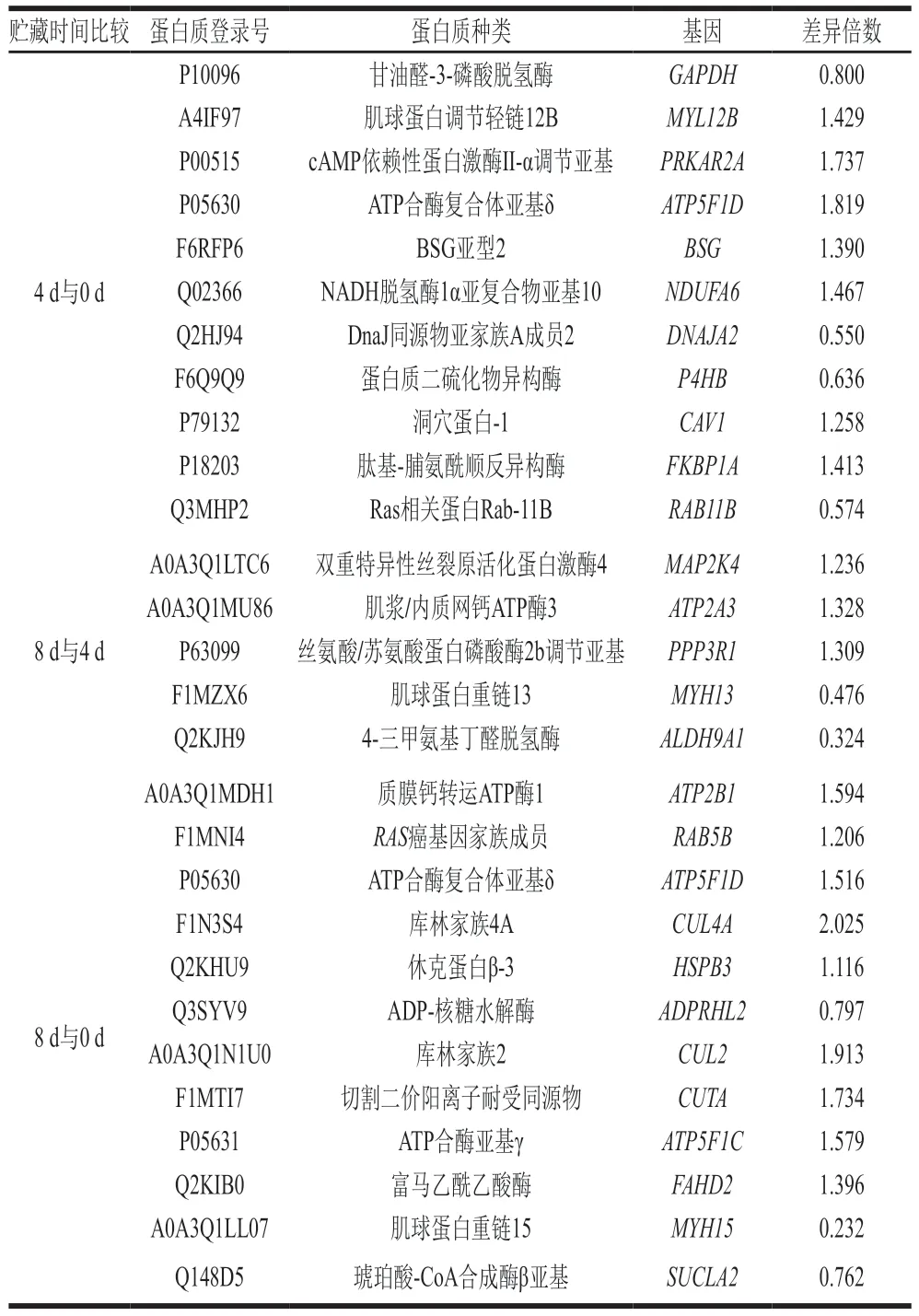
表2 秦川牛背最长肌贮藏0、4、8 d与BSG相关差异蛋白对比Table 2 Comparison of BSG-related differentially expressed proteins in longissimus dorsi muscle of Qinchuan cattle stored for 0,4,and 8 days
2.1.3 KEGG分析
对BSG及其差异蛋白质进行KEGG分析,结果如表3所示。显著注释于氧化磷酸化通路、钙信号通路、MAPK信号通路。其中,在呼吸链电子传递复合物产生质子梯度的情况下线粒体ATP合酶复合体亚基δ(ATP5F1D)使ADP生成ATP。NADH脱氢酶1α亚复合物亚基6(NDUFA6)是线粒体膜呼吸链NADH脱氢酶复合物I的辅助亚基,一般不参加催化作用,复合物I在将电子从NADH转移到呼吸链过程中起一定效果。ATP5F1A、ATP5F1B则位于线粒体内膜上,是氧化磷酸化结构蛋白的核心[8]。NDUFA6主要是参与线粒体呼吸链复合体I的组装和氧化还原过程。肌浆/内质网钙ATP酶3(ATP2A3)是一种镁依赖性酶,催化ATP的水解与钙的转运。线粒体内膜的氧化磷酸化是ATP的主要来源[9]。以上结果表明,BSG参与了秦川牛肉宰后贮藏期间能量物质代谢与线粒体损伤,并对MAPK信号通路调节起到重要作用[10]。

表3 与BSG表达相关差异蛋白KEGG富集分析Table 3 KEGG enrichment analysis of differentially expressed proteins related to BSG expression
2.2 秦川牛背最长肌MAPK通路关键蛋白质表达情况
2.2.1 秦川牛背最长肌ARAF蛋白表达情况
采用蛋白质免疫印迹检测法比较秦川牛宰后贮藏过程中空白组和衣霉素组ARAF蛋白的表达水平,结果见图1。随贮藏时间的延长,空白组与衣霉素组的ARAF蛋白相对表达量总体呈现先上升后下降的趋势。在贮藏0~4 d时,空白组与衣霉素组的ARAF蛋白表达水平显著升高。在第4天时,两组肉样的ARAF的蛋白表达量达到最高。在贮藏4~8 d时,空白组与衣霉素组的ARAF表达水平呈逐渐下降趋势。另外,在贮藏第0、2、4、6、8天时,衣霉素组的ARAF蛋白相对量均明显降低(P<0.05)。说明在用衣霉素抑制BSG后,ARAF蛋白表达明显减少。

图1 秦川牛背最长肌ARAF蛋白表达情况Fig.1 Expression of ARAF protein in longissimus dorsi of Qinchuan cattle
2.2.2 秦川牛背最长肌ERK1蛋白表达情况
如图2所示,在贮藏期0~4 d时,空白组与衣霉素组ERK1蛋白的表达水平显著升高。而在贮藏期4~8 d,空白组ERK1蛋白的相对表达量呈先下降后升高的趋势,在第8天,ERK1蛋白的相对表达量达到最大值。宰后秦川牛肉在贮藏第0、2、4、6、8天时,衣霉素组ERK1的表达水平相较于空白组均明显下降。说明在使用衣霉素抑制BSG后,ERK1蛋白表达明显减少[11]。

图2 秦川牛背最长肌ERK1蛋白表达情况Fig.2 ERK1 protein expression in longissimus dorsi of Qinchuan cattle
2.2.3 秦川牛背最长肌KRAS+HRAS+NRAS蛋白表达情况
RAS是一种GTP结合蛋白,具有激活MAPK信号通路的作用[12]。其主要包括KRAS、HRAS及NRAS 3 种亚型。如图3所示,随着贮藏时间的延长,空白组与衣霉素组的KRAS+HRAS+NRAS蛋白的相对表达量呈先上升后下降的变化趋势。在0~4 d时,空白组与衣霉素组的KRAS+HRAS+NRAS蛋白质的表达量明显升高。在第4天时,两组的蛋白水平达到最高。在贮藏期4~8 d时,空白组与衣霉素组的蛋白表达水平呈逐渐下降趋势。另外,在贮藏期间衣霉素组的KRAS+HRAS+NRAS相对表达量相较于空白组均明显下降。说明在使用衣霉素抑制BSG后,KRAS+HRAS+NRAS蛋白表达明显减少。

图3 秦川牛背最长肌KRAS+HRAS+NRAS蛋白表达情况Fig.3 Expression of KRAS+HRAS+NRAS proteins in longissimus dorsi of Qinchuan cattle
2.3 秦川牛肉贮藏过程中caspase-3活力的变化情况
细胞凋亡是一种通过激活依赖能量的细胞内死亡程序而导致多基因协调控制细胞自发、有序的死亡方式[13]。细胞一般在缺氧缺血状态时会诱发其凋亡,这与畜禽屠宰后肌细胞所处状态类似[14]。caspase-3蛋白的表达水平和细胞凋亡水平密切相关,其在细胞凋亡过程中起着关键作用[15-18]。凋亡因子Cyt-c的释放最终影响caspase-3的活性,激活线粒体凋亡级联反应[19-20]。如图4所示,随着贮藏时间的延长,空白组与衣霉素组的caspase-3活力均呈先上升后下降的趋势。衣霉素组的caspase-3活力相较于空白组均明显上升,表明在使用衣霉素抑制BSG后,caspase-3活力明显增加。由此说明通过沉默BSG基因的表达后,细胞的凋亡率显著增高。Intasai等[21]通过封闭单核细胞系U937的BSG蛋白质表达后,细胞凋亡增加,说明BSG参与部分细胞凋亡路径的调节,其凋亡机制与激活caspase相关,与本实验所得结果一致。
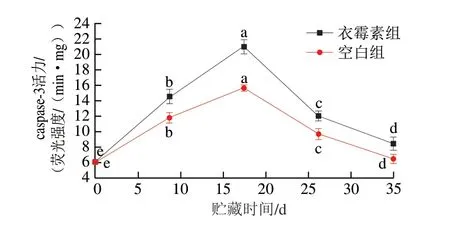
图4 秦川牛宰后caspase-3活力变化Fig.4 Change of caspase-3 activity in Qinchuan cattle muscle after slaughter
3 讨论
BSG是一种高度糖基化的跨膜蛋白,BSG通过MAPK途径发挥作用,可以激活细胞外信号调节激酶ERK1/2信号。衣霉素则可通过作用于蛋白质的N端结构使蛋白质去糖基化。通过抑制细胞内蛋白质的折叠使其生物学活性受到抑制,从而诱导细胞发生凋亡[22-23]。动物宰后肌细胞所处的缺氧缺血环境、肌肉pH值的变化、肌细胞内外空间的变化都表明宰后肌细胞发生凋亡过程的理论可能性,也有相关研究表明宰后肌细胞的凋亡现象确实存在[24-25]。动物死后肉的嫩化是一个涉及多种蛋白水解酶的复杂生物化学过程,凋亡引起的细胞死亡是此过程的一种新机制。细胞凋亡是肌细胞损伤机制中的关键环节,它可以通过激活信号通路启动细胞内死亡蛋白系统,从而导致细胞发生程序化死亡[26]。MAPK家族是一类重要的细胞内信息传递系统,当细胞处于损伤状态时,p38 MAPK应急信号途径被快速启动,进而激活c-Jun氨基未端激酶信号通路,调控ERK信号通路水平,从而介导细胞凋亡等一系列的生理过程[27]。在细胞损伤中ERK也起着较为重要的作用。
在衣霉素组中,ARAF、ERK1、KRAS+HRAS+NRAS的相对表达量均显著下调,这与于甜乐[28]的研究结果一致,由此表明,这3 种蛋白质相对水平的下降,阻碍了MAPK家族信号通路系统的激活,使信息传递到细胞核内的过程受阻,多种转录因子不表达或表达较少,最终导致细胞凋亡。本实验结果证实,在宰后肌细胞损伤过程中,BSG通过失活MAPK信号通路引发未折叠蛋白反应,从而致使细胞凋亡。在抑制BSG的表达后,相比于空白组,衣霉素组的caspase-3的相对表达量明显上升,证明细胞凋亡是细胞损伤的重要环节。Baba等[29]发现BSG诱导的细胞凋亡与糖酵解代谢的不协调有关,Kuang Yehong等[30]发现抑制耐药性肿瘤细胞的BSG表达可以引起肿瘤细胞的凋亡,这与X连锁凋亡抑制蛋白密切相关。BSG抑制剂通过失活MAPK信号通路使BSG蛋白下调,从而阻断肌细胞的能量来源,诱导肌细胞凋亡。因此,BSG可能通过阻止肌细胞的能量供应诱导活性氧生成,使线粒体外膜受损,导致Cyt-C释放,从而启动caspase家族信号通路,最终导致细胞凋亡。
4 结论
利用4D-LFQ组学技术发现宰后随贮藏时间的延长,秦川牛肉中BSG含量先上升后下降,BSG及其差异蛋白质显著注释于氧化磷酸化通路、钙信号通路、MAPK信号通路,说明BSG通过MAPK途径发挥作用。通过向秦川牛肉的背最长肌中注射BSG抑制剂的方法,有效干扰了BSG蛋白质的表达。另外采用蛋白质免疫印迹法测定秦川牛肉在贮藏过程中MAPK通路相关蛋白质ARAF、ERK1以及KRAS+HRAS+NRAS的表达水平,发现衣霉素组的MAPK通路关键蛋白质的相对表达量均显著下调,说明BSG抑制剂使MAPK信号通路失活。这为研究BSG对MAPK信号通路影响奠定了良好的基础。另外,在抑制BSG表达后,相比于空白组,衣霉素组的caspase-3的活力明显上升,说明细胞凋亡是细胞损伤的重要环节,BSG参与宰后肌细胞凋亡路径的调节,其凋亡机制与激活caspase相关。衣霉素通过作用于BSG的N端结构使蛋白质发生去糖基化作用。通过细胞内蛋白质的未折叠反应使其生物活性受到抑制,从而诱导细胞发生凋亡。即BSG可能通过阻断肌细胞的能量来源,诱导活性氧生成,使得线粒体外膜受损,导致Cyt-C释放,从而激活caspase家族级联反应,最终促进细胞凋亡。

