共包埋姜黄素和还原型谷胱甘肽的纳米脂质体的制备、修饰与表征
于少轩,逄格雨,张子豪,李世阳,徐 硕,肖海芳,朱兰兰,宋元达
(山东理工大学农业工程与食品科学学院,山东 淄博 255000)
脂质体是由磷脂(磷脂酰胆碱、二棕榈酰磷脂酰胆碱、二硬脂酰磷脂酰胆碱等)及其他组分如胆固醇和亲水性聚合物共轭脂质形成的双层封闭球形囊泡[1]。随着技术的不断发展,脂质体的制备工艺不断完善,被广泛研究和应用[2-3]。亲脂性差异很大的药物可以同时封装在脂质体中,根据药物的溶解性,既可以封装在磷脂双分子层中,也可以截留在水中,还可以封装在双层界面处[1,4]。近年来,两种或多种药物的联合使用因具有减少每种药物的个体摄入量和提高其协同效应的优点,引起人们的广泛关注[5-6]。研究表明,当两种药物被同一个载体递送到细胞或动物体内时,可以通过逐步暴露和吸收,提高其稳定性、生物利用率和治疗效果[7-8]。例如,Zhang Chuanmin等[7]制备用于联合递送生存素siRNA和紫杉醇的阳离子脂质体,并通过其在肺癌中的协同作用,降低紫杉醇的剂量,增强抗肿瘤疗效。Zhang Lu等[8]设计并合成一种具有顺序释放特性的纳米脂质体(nanoliposomes,LIP),可同时递送地塞米松和多烯紫杉醇,以调节肿瘤基质,并协同杀死肿瘤细胞;因为地塞米松与胆固醇结构相似,可能与胆固醇一样被包裹在磷脂层中,而多烯紫杉醇由于其较强的疏水性被包裹在两层磷脂层之间。
姜黄素(curcumin,CUR)被认为是姜黄制剂中最活跃的成分,具有抗氧化、抗肿瘤、降血脂和预防老年痴呆等多种生理功能,还可作为天然着色剂、防腐剂等用于食品加工[9]。还原型谷胱甘肽(glutathione,GSH)是由半胱氨酸、甘氨酸和谷氨酸组成的三肽,其分子结构中含有γ-谷氨酰基和—SH两种活性基团,在生物体内广泛存在且具有多种重要的生理功能,如抗氧化、解毒、消除疲劳、延缓衰老、预防糖尿病和癌症以及参与体内三羧酸循环和糖代谢等[10-11]。卢均坤等[12]发现CUR和GSH联合使用对阿霉素所致大鼠急性心肌损伤具有保护作用,能够抑制心肌细胞变性及线粒体损伤。虽然CUR和GSH都具有优异的生物活性,在膳食补充中具有重要作用,但它们稳定性差,易受温度、氧气、光照、金属离子、pH值等环境因素的影响,同时代谢速度快、生物利用率低,而且CUR的水溶性很差[13]。因此,CUR和GSH在食品、保健品和药品中的应用受到很大限制。通过合理的递送载体设计,将CUR和GSH同时包埋到一种纳米颗粒中,并实现足够的装载能力,可能是同时提高二者稳定性和协同作用的可行思路。然而,脂质体作为载体材料存在包埋率较低、稳定性差、颗粒易融合或絮凝、药物易泄漏等问题,通过与其他化合物结合可以提高脂质体的包埋率和稳定性[14-15]。最近,本团队通过静电层层自组装技术在包埋GSH的脂质体表面依次修饰壳聚糖(chitosan,CH)和海藻酸钠(sodium alginate,AL),制备出双层多糖修饰的LIP[11,16];与未修饰的脂质体相比,CH单层修饰和AL-CH双层修饰都可以明显增加GSH的包埋率,增强脂质体的热稳定性,减缓其在模拟肠消化液中的崩解,起到缓释GSH的作用。
本研究制备同时包埋CUR和GSH的纳米脂质体(curcumin-glutathione nanoliposomes,CGLIP),将CH和AL逐层结合到LIP表面得到多糖修饰的CGLIP(ALCH-CGLIP),并通过各种光谱学手段和电子显微镜对LIP的包埋率、缓释作用、粒径、表面电位、微观形貌、化学组成、热稳定性等进行表征,考察LIP作为CUR和GSH协同传递载体的潜力,以期为同时添加CUR和GSH或其他生物活性物质的新型功能食品或药品开发提供一定的理论参考和技术支撑。
1 材料与方法
1.1 材料与试剂
大豆卵磷脂、谷胱甘肽 上海麦克林生化科技股份有限公司;胆固醇(分析纯)北京索莱宝科技有限公司;吐温-80、壳聚糖、胆盐(分析纯)、海藻酸钠 国药集团化学试剂有限公司;CUR标准品(纯度>98%)上海阿拉丁生化科技股份有限公司;其他试剂均为分析纯。
1.2 仪器与设备
RE-52AA旋转蒸发仪 上海亚荣生化仪器厂;L530型水平离心机 湖南湘仪实验室仪器开发有限公司;Centrifuge 5810R型高速离心机 德国Eppendorf公司;RG-18型磁力搅拌器 河南金博仪器制造有限公司;KYC-100B恒温培养摇床 上海新苗医疗器械制造有限公司;UV-2600型紫外-可见分光光度计、IRAffinity-1S型傅里叶变换红外光谱(Fourier transform infrared spectroscopy,FTIR)仪 日本岛津公司;FreeZone®6 L冷冻干燥机 美国Labconco公司;JY99-IIDN超声波细胞破碎仪 宁波新芝生物科技股份有限公司;Zetasizer Nano ZS90纳米粒度分析仪 英国马尔文帕纳科公司;H-9500透射电子显微镜 日本日立公司;DSC-Q2000型差示扫描量热仪 美国TA仪器公司。
1.3 方法
1.3.1 不同LIP的制备
参考前期工作并适当修改后,通过薄膜水合法结合超声技术制备不同负载的LIP[16-17]。准确称取250 mg大豆卵磷脂和25 mg胆固醇于烧杯中,加入25 mL无水乙醇,40 ℃搅拌直至完全溶解。制备包埋CUR的LIP时,称取4 mg CUR加入上述混合溶液中,在40 ℃、避光条件下继续搅拌,直到CUR全部溶解。将混合溶液全部转移至圆底烧瓶,用10 mL乙醇分次洗涤烧杯,将洗液倒入圆底烧瓶中,在40 ℃、-0.1 MPa条件下旋蒸。待乙醇完全除去,烧瓶内壁形成均匀的薄膜,加入20 mL磷酸盐缓冲溶液(phosphate buffered saline,PBS)(0.05 mol/L、pH 6)或者含有4 mg/mL GSH的PBS,在40 ℃、常压条件下旋转水合30 min,使烧杯内壁的薄膜洗脱。将烧瓶中的洗脱液转移至50 mL离心管中,并在冰浴中通过超声波细胞破碎仪超声10 min(250 W,工作3 s、间隔3 s)。将经超声处理的溶液在4 ℃静置2 h,然后以4 ℃、3 000 r/min离心10 min,上清液即为制得的LIP。分别制备空LIP(BLIP)、单包埋CUR的LIP(CLIP)、单包埋GSH的LIP(GLIP)和共包埋CUR和GSH的LIP(CGLIP),并将所有LIP样品在4 ℃、避光条件下保存备用。
1.3.2 LIP的多糖修饰
对BLIP、CLIP、GLIP和CGLIP 4 种LIP分别进行CH修饰和CH-AL修饰。脂质体的CH修饰:称取100 mg CH,加入100 mL质量分数为1%的冰醋酸溶液,搅拌至完全溶解后,用1 mol/L的氢氧化钠溶液将CH溶液的pH值调至5.5,用0.45 μm水相过滤器过滤。分别取20 mL BLIP、CLIP、GLIP和CGLIP样品溶液,在100 r/min的搅拌条件下将样品溶液按体积比1∶1逐滴滴加到CH溶液中,静置1 h,得到CH修饰的脂质体,分别记为CHBLIP、CH-CLIP、CH-GLIP和CH-CGLIP。脂质体的CH-AL修饰:称取100 mg AL,加入100 mL蒸馏水,搅拌至完全溶解后,用5 mol/L的盐酸溶液将AL溶液的pH值调至5.5,用0.45 μm水相过滤器过滤。分别取20 mL CHBLIP、CH-CLIP、CH-GLIP和CH-CGLIP溶液,在100 r/min的搅拌条件下按体积比1∶1逐滴滴加到AL溶液中,静置1 h,得到CH-AL修饰的脂质体,分别记为AL-CHBLIP、AL-CH-CLIP、AL-CH-GLIP和AL-CH-CGLIP。将修饰后的LIP也置于4 ℃、避光条件下保存备用。
1.3.3 测定CUR和GSH的包埋率
1.3.3.1 绘制CUR和GSH标准曲线
以无水乙醇为溶剂,制备不同质量浓度的(1.25、2.5、5、10、20 μg/mL)CUR溶液,各取200 μL于96 孔板中测吸光度,并绘制CUR的标准曲线[16]。另外,根据GSH检测试剂盒的方法绘制GSH的标准曲线。CUR和GSH的标准曲线方程分别为Y=0.064 237 5+0.005 127X(R2=0.999)和Y=0.096 41+0.001 85X(R2=0.999)。
1.3.3.2 测定CUR和GSH的包埋率
萃取步骤:收集制备LIP时在离心过程中产生的沉淀(1.3.1节),加水分散并定容为10 mL,取1 mL沉淀溶液加等体积氯仿,剧烈振荡混合2 min后,将溶液静置分层,分别收集上层水溶液(可能含有GSH)和下层氯仿溶液(可能含有CUR)。重复上述萃取步骤,直到氯仿溶液无色为止。将每次萃取的下层氯仿溶液合并,用氮吹仪将氯仿吹干,加入200 μL无水乙醇将离心管壁上的残留物质充分溶解。
用酶标仪在424 nm波长处测定溶液的吸光度[18]。同时,合并每次萃取的上层溶液,取200 μL合并溶液,加入到96 孔板中,根据GSH检测试剂盒说明书测定。根据标准曲线方程计算沉淀中残留CUR和GSH的质量。
取100 μL待测脂质体,加400 μL PBS稀释后,转移到Millipore超滤管(截留分子质量为100 kDa)中,4 ℃、5 000 r/min离心10 min。向过滤器中加入500 μL PBS,将浓缩的样品重新分散后再次离心10 min。经过分离和洗涤后,游离的CUR和GSH在收集管中回收,而包埋CUR和/或GSH的脂质体则被截留在过滤器中。将收集管中的溶液全部取出,用PBS定容至2 mL,加入等体积的氯仿,按照上述萃取步骤将溶液中的CUR萃取出来,使其与GSH分开。使用酶标仪测定CUR和GSH的吸光度,计算溶液中CUR和GSH的质量,最后按照式(1)计算CUR和GSH的包埋率:
式中:mtotal为制备脂质体时加入总CUR或GSH的质量/mg;mfree为计算出沉淀和收集液中游离CUR或GSH的质量/mg。
为了进一步确定脂质体中CUR和/或GSH的含量,过滤器中的脂质体通过反向旋转的方法被重新回收,并通过萃取的方法测定了脂质体包埋CUR和/或GSH的量[19]。具体步骤:在截留管中加入500 μL PBS将浓缩的脂质体重新溶解,然后将倒置的过滤器置于干净的收集管中并以5 000 r/min离心10 min,将收集管中的液体全部取出,用PBS定容至2 mL,加入等体积的氯仿,按照上述萃取法将脂质体中的CUR和GSH分离。测定CUR和GSH的质量,按照式(2)计算CUR和GSH的包埋率:
式中:me为脂质体中CUR或GSH的质量/mg。
1.3.4 测定CUR和GSH的体外释放率
采用透析法对CLIP、AL-CH-CLIP、GLIP、AL-CHGLIP、CGLIP和AL-CH-CGLIP在体外释放CUR或/和GSH的能力进行测定[20]。分别取2 mL不同样品溶液于截留分子质量为3.6 kDa的透析袋中,将透析袋浸没于50 mL含体积分数2%吐温-80的PBS(0.01 mol/L、pH 7.4)后,在37 ℃的恒温摇床(100 r/min)中透析72 h。分别在0、3、6、12、24、48、72 h取5 mL透析液于15 mL离心管中,并向烧杯中补加5 mL新鲜的透析液,即含质量分数2%吐温-80的PBS。在取出的透析液中加入等体积的氯仿,按照1.3.3节中描述的方法分离透析液中的CUR和GSH。测定透析液CUR和GSH的吸光度,计算透析液中二者的质量。根据式(3)计算CUR或/和GSH在不同时间点的体外释放率:
式中:mi为i时间点透析液中累积释放CUR或GSH的质量/mg。
1.3.5 粒径、多分散系数(polymer dispersity index,PDI)和Zeta电位测定
分别取BLIP、CH-BLIP、AL-CH-BLIP、CLIP、CHCLIP、AL-CH-CLIP、GLIP、CH-GLIP、AL-CH-GLIP和CGLIP、CH-CGLIP、AL-CH-CGLIP样品溶液1 mL,加入9 mL超纯水稀释后,测量各个脂质体样品的平均粒径、PDI和Zeta电位。测量时将折射率设置为1.330,吸收率设置为0.001,且每个样品溶液循环测定10 次。
1.3.6 不同LIP的微观形貌表征
采用负染法对CGLIP、CH-CGLIP和AL-CH-CGLIP的形貌进行表征[11]。将铜网格先放置在样品溶液的液滴上4 min,然后用2%的磷钨酸溶液染色4 min,用滤纸除去多余的液体后,在室温下风干。最后,在120 kV电压下用透射电子显微镜(transmission electron microscope,TEM)观察铜网。
1.3.7 FTIR表征
通过压片法对样品进行表征[21]。取CUR标准品、GSH、CH、AL、冻干的CGLIP、冻干的CH-CGLIP和冻干的AL-CHCGLIP样品各2 mg,将样品与适量的溴化钾混合研磨成均匀粉状,然后将粉末压制成透明薄片,在4 000~500 cm-1范围内对样品进行扫描,测定样品的透光率。
1.3.8 热重分析(thermogravimetric analysis,TGA)
分别取10 mg冻干的CGLIP和AL-CH-CGLIP样品进行TGA,比较二者的热稳定性。温度范围为20~800 ℃,升温速率为10 ℃/min,气体环境为氮气。
1.3.9 差示扫描量热(differential scanning calorimeter,DSC)分析
采用DSC仪进一步对CGLIP和AL-CH-CGLIP的热力学性质进行比较[11]。分别称取10 mg冻干的CGLIP样品和AL-CH-CGLIP样品于铝皿中,加盖密封后,铝皿在DSC中以10 ℃/min的速率从20 ℃加热到140 ℃。同时,加热一个密封的空铝皿,作为参比。
1.4 数据处理
2 结果与分析
2.1 9 种LIP样品中CUR和GSH的包埋率
包埋率是评价LIP载药能力的重要指标之一。因为沉淀和收集管滤液均未检测出CUR,而氯仿萃取的脂质体中CUR的量与制备时CUR的添加量基本一致,所以本研究得到的CUR包埋率为100%(图1A)。另外,过滤器倒置后反向旋转测定的结果与该结果一致。同时,与GSH共包埋对CUR的包埋率也没有产生显著影响(图1B),这可能是因为在制备单包埋和共包埋的LIP时所添加的4 mg CUR均被包埋进了脂质体中或嵌入吸附在磷脂双分子层上[22]。与已有文献报道的结果(41%~90%)[23-25]相比,本研究中CUR的包埋率略高,产生差异的原因可能是磷脂的化学组成和结构不同,或是CUR与脂质体主要成分如大豆卵磷脂和胆固醇的质量比不同。经测定,单层CH修饰和双层AL-CH修饰后,脂质体中CUR的包埋率没有显著差异,依然接近100%(图1A、B)。

图1 CUR和GSH在9 种LIP中的包埋率Fig.1 Encapsulation efficiency of CUR and GSH in nine LIPs
与CUR相似,两种方法测定的GSH包埋率也基本一致。然而,与CUR共包埋以及多糖修饰对GSH在脂质体中的包埋率产生了显著影响。由图1C、D可以看出,随着多糖修饰层数的增多,脂质体对GSH的包埋率逐渐增大(P<0.05)。在单包埋GSH的脂质体中,GSH的包埋率先从7.90%(GLIP)增加到16.72%(CH-GLIP),再增加到37.52%(AL-CH-GLIP)。类似地,在CURGSH共包埋的脂质体中,GSH的包埋率先从27.03%(CGLIP)增加到了32.09%(CH-CGLIP),再增加到了41.22%(AL-CH-CGLIP)。脂质体对GSH的包埋率在两种体系中均显著增加的原因可能有两个:一是CH与AL在层层自组装到脂质体表面的过程中将溶液中部分游离的GSH一起包埋进去;二是经多糖修饰后脂质体更加稳定,减少了洗涤纯化过程中GSH的损失[26]。在CUR和GSH共包埋时,未修饰、CH单层修饰和AL-CH双层修饰的脂质体中GSH的包埋率均高于单包埋GSH脂质体,分别为单包埋GSH脂质体的4、2 倍和1.2 倍左右。因此,脂质体同时包埋疏水性CUR和亲水性物质也许可以提高其对亲水性物质的包埋能力,且该现象可以通过CUR对磷脂双分子层结构的影响解释。研究表明,CUR能够以跨双分子层的方向插入脂质双分子层深处,并通过与脂质的磷酸基团形成氢键固定[27],而CUR的插入可以使脂质体的酰基链区域紧致,使脂质体膜的通透性降低,减少GSH在制备、离心、洗涤等过程中泄漏[28]。另外,多糖修饰对GSH包埋率的影响可能远远大于与CUR共包埋对GSH包埋率的影响,所以AL-CH-CGLIP与AL-CH-GLIP对GSH的包埋率相差不大。
2.2 平均粒径、PDI和Zeta电位分析
虽然脂质体具有生物相容性好、能同时包埋疏水性和亲水性物质等优点,但是脂质体的稳定性差,颗粒之间容易黏结,从而产生粒径变大、絮凝、内容物泄漏等问题,而脂质体是否会出现上述问题与其粒径大小、粒径分布及Zeta电位等胶体性质紧密相关[22]。脂质体粒径的大小影响其分散和通透性,当PDI小于0.3时,通常认为体系具有较好的分散性[11]。另外,无论脂质体带正电荷还是负电荷,脂质体带电荷的绝对值越大,其稳定性越强,泄漏率越低[18]。
由图2、3可知,BLIP、CLIP、GLIP和CGLIP的平均粒径分别为(95.02±1.93)、(87.30±0.91)、(117.77±1.00)nm和(132.47±18.14)nm,PDI分别为0.200±0.023、0.146±0.007、0.184±0.008和0.317±0.011,Zeta电位分别为(-22.47±1.96)、(-24.80±0.29)、(-15.67±0.67)mV 和(-14.70±0.46)mV。4 种LIP溶液的PDI均较小(小于0.35),说明它们的粒径大小都比较均匀[22]。与BLIP相比,CLIP的平均粒径减小了7.7 nm,而Zeta电位没有明显变化。CUR分子的高共轭结构使其具有较强亲脂性,在大豆卵磷脂形成双分子层过程中,CUR可能深深插入到双分子层内部,诱导脂质体的酰基链区域更加紧致,而不是吸附在脂质体表面,导致CLIP粒径略微减小而表面电荷没有发生明显变化[28]。相反地,GLIP的平均粒径增加了约13 nm,Zeta电位增加了约7 mV,表明GSH被包埋进脂质体水相空腔,且可能有部分GSH吸附在脂质体表面。GSH溶解于pH 6的PBS中,pH值接近于GSH的等电点(5.93),GSH本身仅带有微弱的负电荷,因此,GSH除了被包埋进脂质体内部的水相空腔,还可能通过氨基与磷酸根之间形成氢键或范德华力等分子间相互作用吸附在脂质体表面,这个推论可以由FTIR分析结果证实。与BLIP相比,CGLIP平均粒径增加了37.45 nm,Zeta电位增加了约8 mV,这可能是因为GSH与CUR共包埋时,更多GSH被包埋进了脂质体内,且也有部分GSH吸附在脂质体表面,与前面包埋率分析的结果一致。类似地,梁晓飞等[29]报道壳聚糖季铵盐乙醇脂质体共载长春新碱和消炎痛后,脂质体的粒径和Zeta电位也略有增加。

图2 12 种LIP的平均粒径及PDIFig.2 Average particle sizes and PDI of 12 LIPs
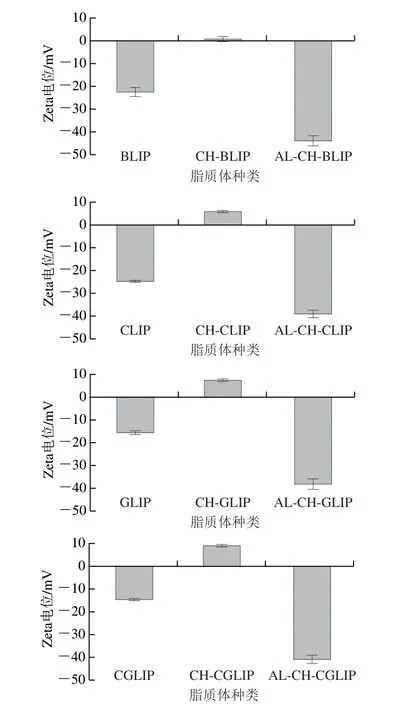
图3 12 种LIP的Zeta电位Fig.3 Zeta potentials of 12 LIPs
经CH单层修饰后,CH-BLIP、CH-CLIP、CH-GLIP和CH-CGLIP的平均粒径分别为(116.37±4.80)、(115.93±1.60)、(123.33±1 8.04)nm 和(151.90±1.80)nm,Zeta电位分别为(0.77±1.08)、(5.98±0.36)、(7.49±0.49)mV和(9.00±0.68)mV;经AL-CH 双层修饰后,AL-CH-BLIP、AL-CH-CLIP、AL-CH-GLIP和AL-CH-CGLIP的平均粒径分别为(133.23±16.26)、(130.50±1.93)、(149.87±12.25)nm和(161.97±5.58)nm,Zeta电位分别为(-43.93±2.08)、(-39.07±1.64)、(-38.23±2.41)mV和(-40.87±1.79)mV。因此,脂质体的Zeta电位经多糖修饰后先由负变为正,再由正变为负,这说明CH和AL通过静电相互作用依次自组装到脂质体的表面。该结果与本课题组之前报道的结果[11,16]一致。另一方面,随着多糖修饰层数的增多,脂质体的粒径逐渐增大(P<0.05),PDI也明显增大,特别是经CH修饰后,脂质体的最大PDI约为0.9,这可能是因为此时脂质体Zeta电位的绝对值最小,导致其稳定性最差,颗粒之间容易发生交联,使得粒径分布不均匀。虽然LIP粒径分布的均匀程度减弱,但该结果再次证明CH和AL修饰到了脂质体表面,而且相比于CH单层修饰的脂质体,AL-CH双层修饰的脂质体具有更强的稳定性。这与朱雨晴等[21]的研究结果相似。
2.3 不同LIP对CUR和/或GSH的体外释放率
如图4所示,所有类型的纳米脂质体都具有缓慢释放CUR或/和GSH的作用。但是经AL-CH双层修饰后,纳米脂质体对CUR和GSH的释放率更小,具有更好的缓释作用。透析72 h后,AL-CH-CLIP和CLIP对CUR的释放率分别为8.4%和14.6%,AL-CH-GLIP和GLIP对GSH的释放率分别为32.7%和51.2%,AL-CH-CGLIP和CGLIP对CUR的释放率分别为9.1%和13.4%,对GSH的释放率分别为30.6%和31.4%。因此,AL-CH双层修饰的纳米脂质体对CUR和GSH的缓释作用优于未经修饰的纳米脂质体。这可能是AL、CH和磷脂膜两两之间具有较强的静电相互作用,增加了脂质体纳米颗粒的胶体稳定性,从而减缓了CUR和GSH的释放速率。这与Yu Shaoxuan[11]和朱雨晴[21]等的研究结果一致。与CUR或GSH单包埋的纳米脂质体相比,当CUR和GSH共包埋时,纳米脂质体对CUR的释放率没有显著影响,但GSH的释放率减小了。这可能是因为CUR的嵌入能够增加磷脂双分子层碳氢链堆积的有序性和刚性,提高纳米脂质体的稳定性。另外,AL-CHGLIP在前6 h对GSH的释放率高于GLIP,AL-CH-CGLIP在前12 h对GSH的释放率高于CGLIP,可能是由多糖复合到脂质体表面的过程中包埋的GSH引起。这部分GSH吸附在脂质体表面,很容易被释放,而包裹在脂质体内部的GSH比较难释放[11]。

图4 6 种纳米脂质体在体外缓慢释放CUR(A、C)和/或GSH(B、D)的能力Fig.4 In vitro sustained release capacity of CUR (A and C) and/or GSH (B and D) loaded in six LIPs
2.4 不同纳米脂质体的微观形貌
如图5A所示,CGLIP是规则的球形颗粒,很好地分散在观察视野中,核为中空、壳为白色明亮的双分子层,粒径在40~100 nm范围内变化[18]。CH-CGLIP也是比较规则的球形颗粒(图5B),粒径分布在75~155 nm范围内。但是CH-CGLIP颗粒之间有比较明显的聚集,这可能与其表面电荷的含量相对较少有关,与前面Zeta电位和PDI测定的结果相印证。而且CH-CGLIP周围有强烈的染色痕迹,这可能是磷钨酸与带正电的CH离子结合引起。磷钨酸是一种阴离子染色剂,可与脂质结构中带正电荷的部分结合[11]。而AL-CH-CGLIP的形状变得不规则(图5C),粒径分布在90~180 nm之间。相对于CGLIP,CH-CGLIP和AL-CH-CGLIP的粒径明显增大,与粒度分析仪的测定结果一致。

图5 CGLIP(A)、CH-CGLIP(B)和AL-CH-CGLIP(C)的TEMFig.5 TEM micrographs of CGLIP (A),CH-CGLIP (B) and AL-CH-CGLIP (C)
2.5 纳米脂质体的组成及其相互作用
磷脂的存在可以通过以下几个官能团特征峰的出现进行表征:位于3 000~2 800 cm-1范围内的由于丙烯链对称和不对称CH2伸缩振动产生的特征峰,位于1 765~1 720 cm-1之间的由于C=O伸缩振动产生的特征峰,位于1 200~1 145 cm-1之间的由于P=O对称振动产生的特征峰,以及位于1 145~970 cm-1范围内由于P—O—C对称振动产生的特征峰[16,25,28]。如图6所示,在CGLIP的光谱中,CH2的对称和不对称伸缩振动特征峰出现在2 926 cm-1和2 855 cm-1处,C=O的伸缩振动特征峰出现在1 741 cm-1处,但是P=O的对称振动特征峰出现在1 245 cm-1处,发生了蓝移,这可能是因为CUR和GSH的存在导致。但CUR的很多特征峰在CGLIP的光谱中没有出现,如酚羟基伸缩振动的特征峰(3 515 cm-1处)、C=C环和C=O振动重叠产生的特征峰(1 508 cm-1处)以及烯醇结构中C—O振动产生的特征峰(1 270 cm-1处)等,而位于1 185、1 119、1 154 cm-1和1 026 cm-1处的特征峰强度也明显减小,表明CUR主要被包埋进脂质体双分子层中,有极少游离的CUR可能吸附在脂质体表面[30]。GSH的很多特征峰(如位于2 522、1 710、1 555、811 cm-1处分别由硫醇基团中S—H伸缩振动、羧基中C=O伸缩振动、仲酰胺基团C—N伸缩振动和C—S伸缩振动产生的吸收峰)在CGLIP的光谱中也没有观察到,但出现了位于3 400到2 700 cm-1处由于O—H和N—H的伸缩振动及其重叠产生的多重吸收峰,强度明显减弱,表明GSH主要被包埋在脂质体内部,部分游离的GSH可能吸附在脂质体表面[31]。对比CH-CGLIP、ALCH-CGLIP和CGLIP的光谱,可以发现大豆卵磷脂的丙烯链对称和不对称CH2伸缩振动产生的特征峰和P=O对称振动产生的特征峰位置基本保持不变,但峰强度明显减小,初步证明CH和AL覆盖在脂质体的表面。另外,在CH-CGLIP的光谱中观察到CH的特征峰酰胺I带(1 656 cm-1处),且该峰的位置发生轻微的偏移[32]。结合前面磷酸基团特征峰的偏移和强度变换,进一步证明CH通过静电相互作用成功修饰在脂质体表面。CH位于1 255 cm-1处代表C—O的特征峰在CH-CGLIP中没有出现,且3 500 cm-1处的特征峰发生了红移,表明CH还可能通过分子间氢键的形成与脂质体的磷脂结合[32]。然而,在AL-CH-CGLIP中,CH的酰胺I带特征峰和AL的羧基特征峰(1 617 cm-1处)都没有出现,表明AL主要通过静电相互作用与CH结合,修饰在纳米脂质体上,与先前报道的结果[16,33]一致。

图6 AL-CH-CGLIP、CH-CGLIP、CGLIP、CUR、GSH、CH和AL的FTIRFig.6 FTIR spectra of CGLIP,CH-CGLIP,AL-CH-CGLIP,CUR,GSH,CH,and AL
2.6 CGLIP和AL-CH-CGLIP的热稳定性
如图7A所示,CGLIP和AL-CH-CGLIP的质量损失大致分为3 个阶段。在20~150 ℃范围内,CGLIP和ALCH-CGLIP的质量损失率分别为4.62%和7.08%。因为在该温度范围内的质量损失主要是由水分蒸发散失引起,所以结果表明AL-CH-CGLIP在加热过程中散失的水分多于CGLIP散失的水分,这可能是因为AL和CH分子结构中存在的—OH、—COOH和—CONH等官能团结合了较多水分[34]。在150~500 ℃范围内,CGLIP和AL-CH-CGLIP在质量损失率分别为56.95%和52.02%,这主要是由纳米脂质体的主要成分卵磷脂、胆固醇、CUR、GSH、CH和AL分解造成,结果表明CGLIP在加热过程中的分解程度略高于AL-CH-CGLIP[35-36]。在温度高于500 ℃时,CGLIP和AL-CH-CGLIP均出现了缓慢的质量损失,这是由样品碳化导致。总体而言,CH-AL修饰的脂质体在加热过程中的质量损失明显低于未修饰的脂质体,表明CH-AL双层修饰可以在一定程度上增加脂质体的热稳定性。
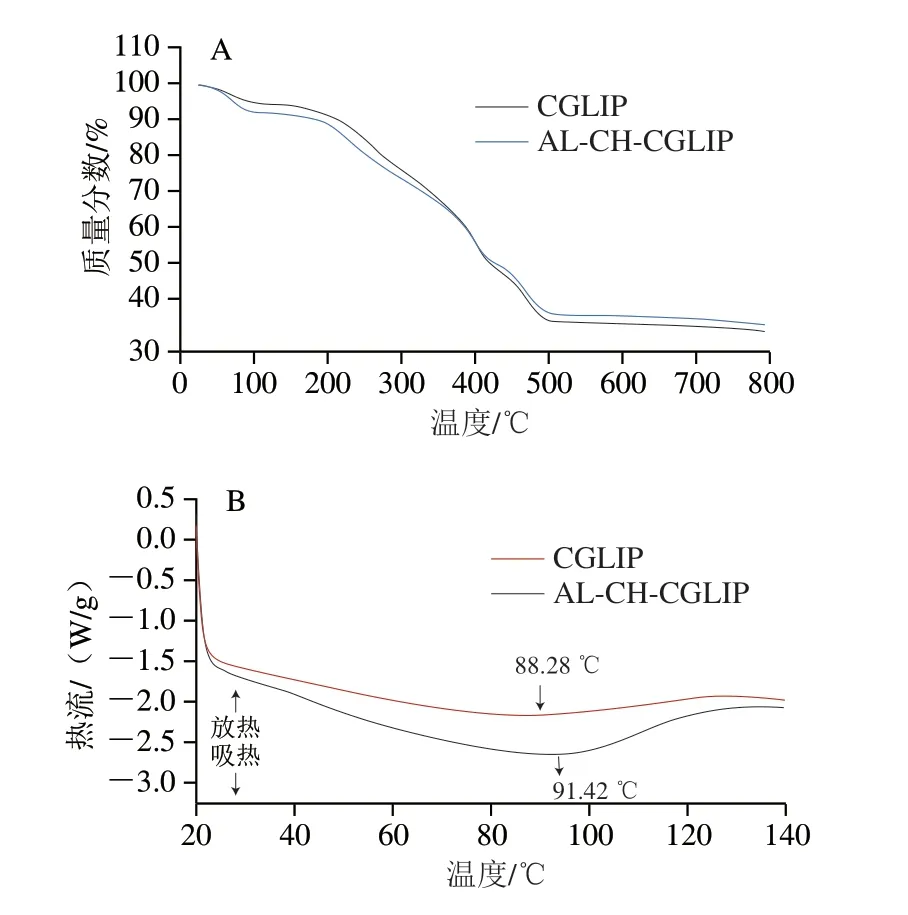
图7 CGLIP和AL-CH-CGLIP的TGA(A)和DSC(B)分析图谱Fig.7 TGA (A) and DSC (B) profiles of CGLIP and AL-CH-LIP
如图7B所示。一般大分子物质的DSC曲线不会出现尖锐的峰,只会出现缓慢而平滑的峰。CGLIP和ALCH-CGLIP的DSC曲线均出现一个宽的吸热峰,峰值分别位于88.42 ℃和91.42 ℃。与之前报道的结果[11,25]相比,CGLIP吸热峰出现的温度稍高于空脂质体和单包埋CUR的脂质体,表明在该条件下CUR和GSH共包埋可能增加了纳米脂质体的热稳定性,这与侯丽芬等[36]研究结果相似。与CGLIP相比,AL-CH-CGLIP的吸热峰向温度升高方向发生了偏移,这表明AL-CH存在于AL-CH-CGLIP的外层,可以增强它们对温度的抵抗力,与TGA的结果一致。另外,Liu Yujia等[25]也发现组装在CUR脂质体表面的CH在高温条件下可以对脂质体起到保护作用,减少CUR泄漏。
3 结论
本研究制备了同时包埋CUR和GSH的纳米脂质体,并通过静电相互作用将CH和AL依次修饰到了纳米脂质体的表面,以增强纳米脂质体的稳定性。结果表明,与GSH共包埋、CH单层修饰或AL-CH双层修饰对CUR的包埋率均没有显著影响;但与CUR共包埋时,GSH的包埋率从7.90%(GLIP)增加到了27.03%(CGLIP),且经多糖修饰后,GSH的包埋率进一步增加到了32.09%(CH-CGLIP)和41.22%(AL-CH-CGLIP)。与BLIP、CLIP和GLIP相比,CGLIP的平均粒径和Zeta电位略有增加;随着多糖修饰层数的增多,脂质体的平均粒径也逐渐增大,但与CH单层修饰的脂质体相比,AL-CH双层修饰的脂质体的Zeta电位绝对值更大,具有更高的分散稳定性。在37 ℃振荡孵育的条件下,CGLIP和AL-CH-LIP对CUR的释放率都明显高于对GSH的释放率,而且ALCH-CGLIP对CUR和GSH的缓释作用都优于CGLIP。另外,AL-CH-CGLIP在加热过程中的变性温度略高于未修饰的脂质体而质量损失率明显低于未修饰的脂质体,表明AL-CH双层修饰可以在一定程度上增加脂质体的热稳定性。本研究阐明了CUR和GSH共包埋以及AL-CH双层修饰对纳米脂质体的包埋率、缓释作用和稳定性的影响,可为同时包埋疏水性和亲水性活性物质的新型功能食品或药品开发提供一定参考价值。

