罗伊氏乳杆菌抑制肠上皮细胞炎症反应和凋亡的作用及机制
陈 鹏,钟瑜娜,于轹文,胡 瑾,谢梅英
(广东生态工程职业学院,广东 广州 510520)
哺乳动物肠炎是由循环系统中的促炎症细胞因子,如肿瘤坏死因子(tumor necrosis factor-α,TNF-α)、干扰素(interferon gamma,IFN-γ)和白细胞介素(interleukin,IL)-8等水平升高,引起机体剧烈的炎症反应,导致腹痛腹泻,甚至可能有血便,引发全身并发症,如皮疹、关节疼痛等,严重影响人类身体健康[1]。肠上皮细胞作为肠道黏膜的重要组成,能够阻断肠道微生物进入人体内,在肠道免疫功能中扮演着重要角色[2]。以肠上皮细胞炎症反应和凋亡为代表的肠上皮细胞损伤被认为是肠炎的初始步骤,与肠炎的发生发展密切相关[3]。Chen Jiali等[4]利用绿原酸抑制断奶猪肠上皮细胞炎症和细胞凋亡,促进肠道发育;Wang Yunxia等[5]利用葡萄籽多酚抑制肠上皮细胞炎症和细胞凋亡,抑制硫酸葡聚糖钠诱导的小鼠结肠炎;因此,阻断肠上皮细胞炎症反应和凋亡可能成为治疗肠炎的有效手段。
罗伊氏乳杆菌是一种天然的益生菌,定殖在许多哺乳动物的胃肠道中,对宿主的健康发挥重要的调节作用[6]。给予乙酸诱导溃疡性大肠炎的大鼠5×107~7×107CFU/g剂量的罗伊氏乳杆菌,可有效阻止溃疡性大肠炎的发展[7],但目前对于罗伊氏乳杆菌阻抑制肠炎发生的机制尚不清晰。
微小核糖核酸(microRNAs,miRNAs)是目前研究最多的一种非编码小RNA,其作用的机制是通过抑制mRNA的翻译或降解mRNA调节基因表达,在个体生长、发育、免疫、代谢等多种生物进程中发挥作用[8],对人类疾病治疗有重要意义。研究表明,miRNA也与肠道微生物群-宿主的相互作用密切相关,如野生型小鼠和无菌小鼠的盲肠黏膜中存在16 种差异表达的miRNAs,这些miRNAs的功能主要与肠屏障和免疫调节有关[9]。因此本实验拟探究罗伊氏乳杆菌是否通过改变宿主miRNAs表达调控肠上皮细胞炎症反应和凋亡及其相关调控机制。
1 材料与方法
1.1 材料与试剂
小鼠肠上皮细胞MODE-K和人肾上皮细胞293T购自ATCC公司;罗伊氏乳杆菌I5007由中国农业大学谯仕彦教授团队从健康猪肠道分离,本研究所使用罗伊氏乳杆菌I5007(简称罗伊氏乳杆菌)为谯仕彦教授团队赠予。程序性细胞死亡因子4(programmed cell death 4,PDCD4)过表达质粒(pcDNA3.1),野生型及突变型PDCD4双荧光素酶pmirGLO质粒,miR-196a mimics、inhibitor及对照均由北京擎科生物科技股份有限公司构建或合成。
脂质体3000、L2630脂多糖(lipopolysaccharide,LPS)美国Sigma公司;胎牛血清、DMEM(Dulbecco’s modified Eagle medium)高糖培养基、RPMI 1640培养基和胰蛋白酶 美国Gibco公司;pmirGLO质粒、双荧光素酶报告基因检测试剂盒 美国Promega公司;IL-1β、IL-6和TNF-α酶联免疫吸附检测(enzyme-linked immunosorbent assay,ELISA)试剂盒 武汉华美生物技术有限公司;PDCD4抗体 美国CST公司;RNA快速提取试剂盒 广州美基生物科技公司;逆转录试剂盒日本TaKaRa公司。
1.2 仪器与设备
CFX96荧光定量聚合酶链式反应(polymerase chain reaction,PCR)仪、12003153凝胶成像系统 美国Bio-Rad公司;NanoDrop One分光光度计、I160细胞培养箱美国Thermo Fisher Scientific公司;DMi8倒置显微镜德国Leica公司。
1.3 方法
1.3.1 细胞培养及处理
首先肠上皮细胞按照3×105个/孔的密度接种于6 孔细胞培养板,细胞贴壁后约30%汇合;待细胞汇合至50%后,转染miR-196a inhibitor、mimics或PDCD4的pcDNA3.1过表达质粒(pcDNA3.1质粒通过自身携带的CMV启动子可在大多数细胞中对质粒中插入基因的过表达),继续培养;待细胞汇合达到90%后,使用108CFU/mL的罗伊氏乳杆菌处理细胞5 h,然后更换含有1 μg/mL LPS的完全培养基继续处理细胞24 h,用于检测细胞炎症反应和凋亡。对照组为在培养基中添加和实验组等体积的磷酸盐缓冲液(phosphate buffered saline,PBS)。
1.3.2 ELISA检测炎症因子水平
按照IL-1β、IL-6和TNF-α ELISA试剂盒操作步骤检测细胞培养基中相关炎症因子水平。
1.3.3 免疫荧光染色
用体积分数为4%的多聚甲醛溶液固定不同处理条件的肠上皮细胞10 min,用PBS浸洗3 遍,5%羊血清封闭1 h,加入Cleaved Caspase-3抗体(稀释比1∶200),4 ℃过夜孵育,用PBS浸洗3 遍,每遍5 min,按1∶1 000的稀释比加入荧光二抗Alexa Fluor 594,室温避光孵育1 h,按1∶2 000加入4′,6-二脒基-2-苯基吲哚(4′,6-diamidino-2-phenylindole,DAPI)细胞核染色剂,室温孵育5 min,PBS浸洗后在荧光显微镜下观察。
1.3.4 实时PCR(real-time PCR)
按照RNA快速提取试剂盒操作说明提取小鼠肠上皮细胞RNA。按照逆转录试剂盒操作说明将组织总RNA逆转录为cDNA,用于后续real-time PCR扩增。取cDNA 0.4 μL加入上下游引物各0.8 μL、SYBR Green Premix 10 μL和双蒸水8 μL组成20 μL反应体系,置于PCR仪中按照设定的反应条件进行扩增,反应条件:94 ℃预变性60 s;94 ℃变性30 s,60 ℃退火30 s,35 个循环;最后72 ℃延伸2 min。采用2-ΔΔCT法分别以U6和GAPDH计算目的基因表达水平。相关基因引物序列见表1。

表1 real-time PCR引物序列Table 1 Primer sequences used in real-time PCR
1.3.5 miRNA筛选及miR-196a靶基因预测
首先通过基因表达综合(Gene Expression Omnibus,GEO)数据库下载LPS诱导肠上皮细胞炎症反应的miRNA测序数据,并通过GOR2R软件进行差异表达miRNAs分析,real-time PCR检测表达变化倍数前10的miRNAs在正常肠上皮细胞、LPS诱导炎症反应的肠上皮细胞、罗伊氏乳杆菌和LPS共处理的肠上皮细胞中水平,筛选正常肠上皮细胞与罗伊氏乳杆菌和LPS共处理的肠上皮细胞中进行验证表达一致,且两组内miRNA表达水平与LPS诱导炎症反应的肠上皮细胞中表达存在差异的miRNAs。然后通过TargetScan数据库分析miR-196a下游靶基因,利用GEO数据库(https://www.ncbi.nlm.nih.gov/geo/)下载LPS处理的小鼠肠上皮细胞转录组测序数据(GSE139903),通过GEO2R软件分析发现:LPS处理后小鼠肠上皮细胞基因表达变化倍数排名前20的基因中,仅PDCD4基因是TargetScan数据库预测的miR-196a下游靶基因,因此选择PDCD4作为miR-196a下游靶基因进行验证,使用RNA Hybird分析miR-196a与PDCD4基因3′非翻译区(3′ untranslated region,3ʹUTR)的结合位点。
1.3.6 双荧光素酶报告基因实验
293T细胞采用含有10%胎牛血清DMEM高糖培养基,置于37 ℃、5% CO2培养箱中培养。取对数生长期293T细胞以20 000 个/孔接种于24 孔板,进行双荧光素酶实验。根据双荧光素酶报告基因质粒的不同进行分组,设置野生型质粒(pmirGLO-PDCD4-WT)、突变型质粒(pmirGLO-PDCD4-Mut)和空质粒(pmirGLO)分别与miRNA阴性对照或miR-196a mimics共同转染;转染48 h后按照双荧光素酶报告基因检测试剂盒操作步骤检测荧光素酶活性。pmirGLO载体包含萤火虫荧光素酶基因和海肾荧光素酶基因,其中海肾荧光素酶基因有独立的启动子和3′UTR,能够稳定表达海肾荧光素酶蛋白,是pmirGLO载体转染效率的内参基因;而萤火虫荧光素酶基因的3′UTR包含多酶切位点,可进行同源重组,将靶基因3′UTR插入萤火虫荧光素酶基因下游后,通过观察miRNA对萤火虫荧光素酶活性的影响,判断miRNA和基因是否存在靶向关系。
1.3.7 Western blotting(WB)
按照蛋白提取试剂盒说明书提取细胞总蛋白,Bradford法进行蛋白定量,12%十二烷基硫酸钠-聚丙烯酰胺凝胶电泳分离,转移至PVDF膜,加入兔抗鼠PDCD4(稀释比1∶1 000)抗体孵育过夜,PBS洗膜后加入过氧化物酶偶联的二抗,37 ℃孵育2 h,PBS清洗后,用化学发光系统检测目的条带,以GAPDH抗体(稀释比1∶1 000)作内参照。
1.4 数据统计与分析
2 结果与分析
2.1 罗伊氏乳杆菌对肠上皮细胞炎症反应和细胞凋亡的影响
ELISA实验结果表明,与对照组相比,LPS处理后肠上皮细胞促炎症因子IL-1β、IL-6和TNF-α分泌显著增加,罗伊氏乳杆菌和LPS共处理后,罗伊氏乳杆菌抑制了肠上皮细胞炎症因子IL-1β、IL-6和TNF-α的分泌(图1A)。免疫荧光染色结果表明,与对照组相比,LPS处理的肠上皮细胞中细胞凋亡相关蛋白Caspase-3表达显著上调,罗伊氏乳杆菌显著抑制LPS引起的肠上皮细胞凋亡相关蛋白Caspase-3表达的上调(图1B、C)。上述结果表明罗伊氏乳杆菌能够阻断肠上皮细胞炎症反应和凋亡。

图1 罗伊氏乳杆菌缓解LPS诱导的肠上皮细胞炎症反应和细胞凋亡Fig.1 Lactobacillus reuteri alleviated LPS-induced inflammation and apoptosis in intestinal cells
2.2 罗伊氏乳杆菌和miR-196a对通过肠上皮细胞炎症反应和凋亡的影响
由图2A可知,与小鼠肠上皮细胞相比,LPS诱导细胞炎症反应后,miR-196a水平降低82.14%(变化程度排名第2);罗伊氏乳杆菌和LPS共处理后,其细胞miR-196a水平较LPS处理细胞中miR-196a水平上调16.5 倍(变化程度排名第1),GEO测序数据和定量分析结果均表明miR-196a在此过程中变化最为显著,miR-196a可能在LPS引起的肠上皮细胞炎症反应、细胞凋亡和罗伊氏乳杆菌缓解LPS毒性过程中均发挥重要调控作用,且miR-196a在肠上皮细胞炎症反应和凋亡中的功能鲜有报道。因此,利用罗伊氏乳杆菌和LPS共同处理抑制肠上皮细胞中miR-196a的表达(图2B),结果表明干扰miR-196a表达后,罗伊氏乳杆菌抑制LPS引起的肠上皮细胞凋亡和炎症反应的作用消失(图2C~E),表明罗伊氏乳杆菌可能通过上调肠上皮细胞中miR-196a的表达,抑制细胞炎症反应和凋亡。


图2 罗伊氏乳杆菌缓解肠上皮细胞损伤依赖miR-196aFig.2 Lactobacillus reuteri alleviated intestinal epithelial cell injury by miR-196a
2.3 miR-196a靶基因的筛选与验证
为进一步解析miR-196a肠上皮细胞炎症反应和凋亡的分子机制,本研究通过TargetScan网站对miR-196a的靶基因进行分析预测,并与LPS诱导肠上皮细胞炎症和凋亡模型的转录组测序数据比对,发现miR-196a与PDCD4可能存在靶向结合(图3A),且PDCD4在LPS诱导炎症反应的肠上皮细胞中表达上调,罗伊氏乳杆菌和LPS共处理抑制LPS引起的PDCD4表达上调(图3B)。使用RNAhybrid 2.2在线网站分析miR-196a与PDCD43′UTR结合自由能情况,结果显示二者的结合自由能较低(图3C),miR-196a与PDCD4可能存在靶向结合。在肠上皮细胞中过表达miR-196a,可减少PDCD4 mRNA和蛋白含量;与之相反,在干扰miR-196a表达的肠上皮细胞中,PDCD4 mRNA和蛋白水平上调(图3D、F)。此外,在293T细胞中开展的双荧光素酶报告基因结果表明,miR-196a显著抑制包涵PDCD4野生型3′UTR的pmirGLO载体荧光素酶活性,但对包涵PDCD4突变型3′UTR的pmirGLO载体荧光素酶活性无影响(图3G)。上述结果表明miR-196a靶向抑制PDCD4表达。
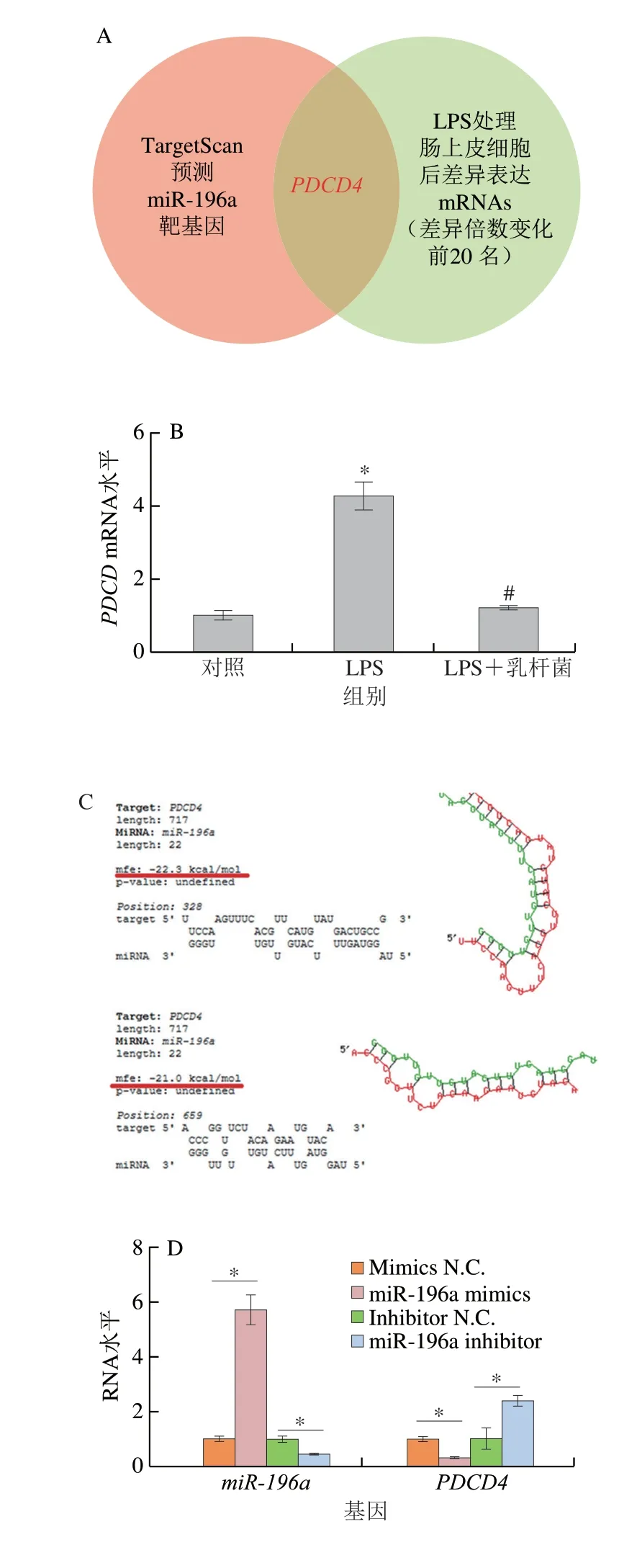
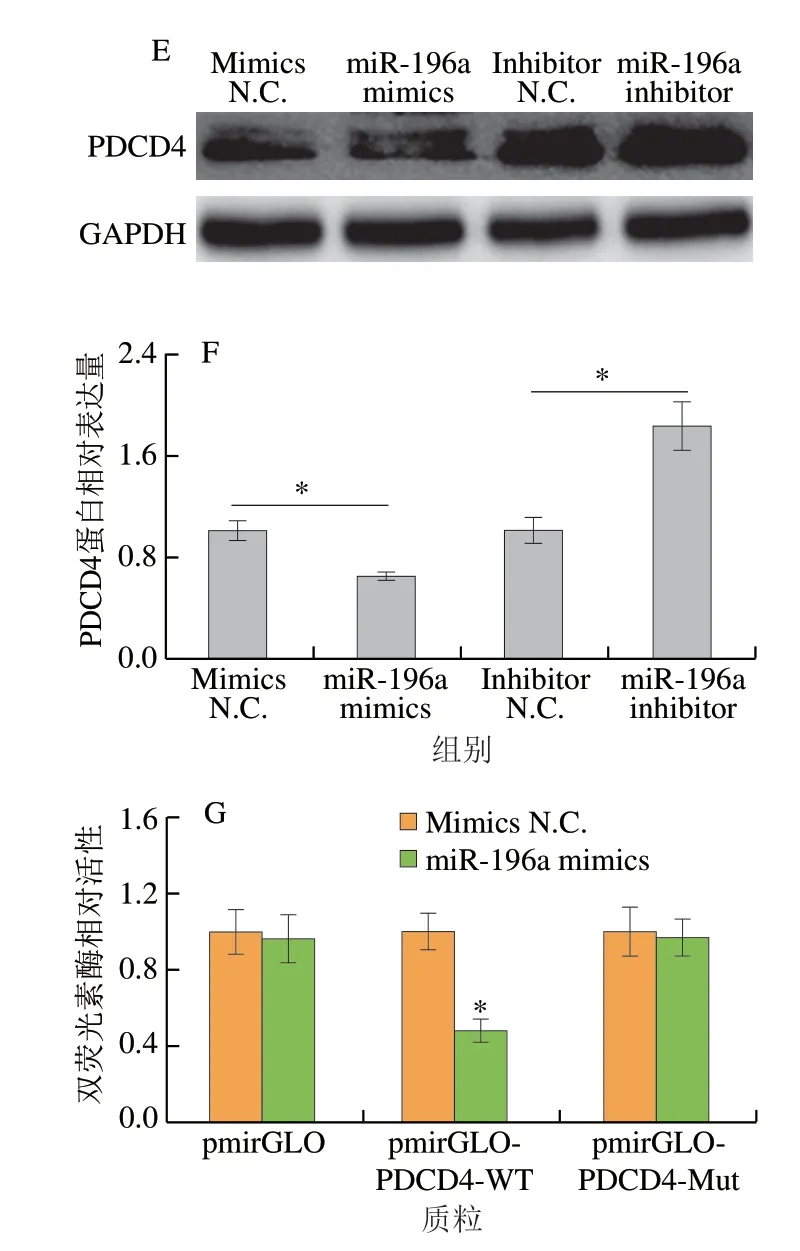
图3 miR-196a靶向抑制PDCD4表达Fig.3 Targeted inhibition of PDCD4 expression by miR-196a
2.4 miR-196a及其靶基因PDCD4对肠上皮细胞炎症反应和凋亡的影响
为验证miR-196a是否通过靶向PDCD4抑制肠上皮细胞炎症反应和凋亡,在过表达miR-196a的肠上皮细胞中观察过表达PDCD4对肠上皮细胞炎症反应和凋亡的影响。ELISA结果表明,与LPS处理组相比,miR-196a过表达显著抑制LPS诱导肠上皮细胞炎症因子分泌;而过表达PDCD4后逆转了miR-196a对肠上皮细胞炎症因子分泌的抑制作用(图4A)。进一步的免疫荧光实验结果表明,与LPS处理组相比,miR-196a过表达后显著抑制肠上皮细胞中细胞凋亡相关蛋白Caspase-3表达,PDCD4的过表达消除miR-196a对Caspase-3表达的抑制作用(图4B、C)。
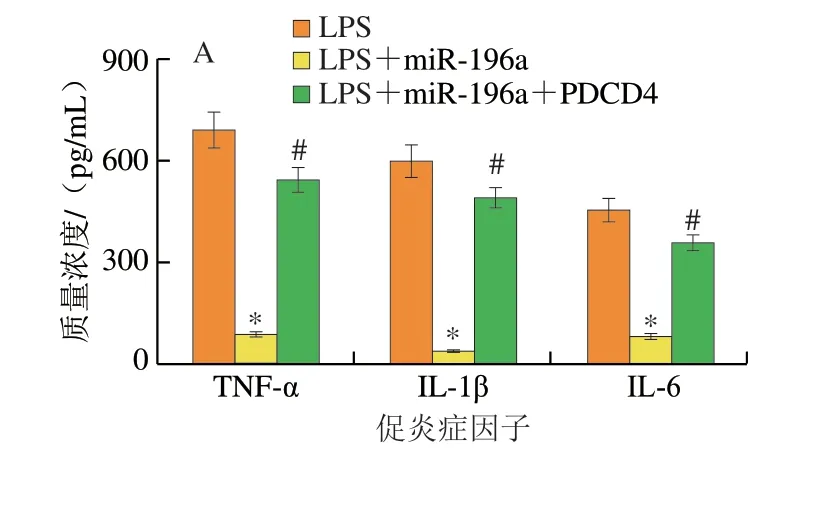
图4 miR-196a通过PDCD4抑制肠上皮细胞炎症反应和细胞凋亡Fig.4 MiR-196a inhibited inflammation and apoptosis in intestinal cells by targeting PDCD4
3 讨论与结论
肠道不仅是人体消化、吸收、营养物质转运的主要器官,也是体内最大的免疫器官和“细菌库”,位于连接机体内外环境的核心位置,对维持人体健康生长具有重要作用[10]。肠道黏膜作为机体免疫的第一道防线,在抵抗天然毒素、肠道共生菌群和入侵的病原体引起的肠道炎症反应中扮演着重要角色[11]。肠炎是一种肠黏膜免疫系统紊乱性疾病[12],由遗传因素、上皮屏障受损、肠道菌群失调等因素相互作用导致[13]。虽然,抗生素等药物治疗可缓解肠炎,但由于抗生素治疗容易导致细菌产生耐药性,所以肠炎极易复发[14-15]。因此,探究肠炎的发生发展机制、开发利用高效无副作用的生物制剂,对于防治肠炎具有紧迫的研究意义。
肠道微生物群被认为是调节宿主健康的关键因素之一[16]。益生菌是一种对宿主健康有益的微生物,它通过调节肠道微生物区系和肠道免疫等方式抑制病原微生物对肠道健康的损害。Kim等[17]研究表明,短乳杆菌KU15152对HT-29细胞有较强的黏附力,其通过调节丝裂原活化蛋白激酶、细胞外信号调节激酶和糖原合酶激酶抑制核因子-κB的活化,从而减轻金黄色葡萄球菌脂磷壁酸诱导的肠道炎症反应。戊糖片球菌ZY-B通过上调紧密连接蛋白的表达改善肠屏障功能障碍,并下调大麻素受体1和大麻素受体2表达,降低小鼠回肠、盲肠和结肠的副溶血性弧菌含量,从而防止结肠萎缩,增强黏膜完整性[18]。此外,副益生菌嗜酸乳杆菌PIN7可通过调节TLR-6介导的免疫反应和肠道菌群组成,改善葡聚糖硫酸钠诱导的小鼠结肠炎[19]。罗伊氏乳杆菌I5007最初从仔猪的结肠中分离出来,能够上调猪小肠上皮细胞紧密连接蛋白和防御肽的表达,进而增强猪肠道免疫功能[20-21]。同时,罗伊氏乳杆菌可以预防和治疗人肠道菌群紊乱引起的肠道不适,具有益生功能,但相关机制未明。本研究发现罗伊氏乳杆菌减轻LPS引起的肠上皮细胞凋亡和炎症反应,可开发为促进肠道健康的生物制剂。
miRNA是一种对哺乳动物细胞内基因转录翻译进行调控的非编码小RNA,尽管不直接编码蛋白质,但却通过对靶基因转录和翻译进行调控间接参与哺乳动物细胞的分化、增殖、转移及凋亡[22]。前期研究发现,miR-196a在骨肉瘤细胞中表达上调,从而抑制骨肉瘤细胞凋亡,促进骨肉瘤细胞的增殖及成瘤能力[23];此外,miR-196a通过抑制RAN结合蛋白10表达改善神经元形态,为亨廷顿舞蹈症患者提供神经保护[24]。本研究发现,LPS诱导肠上皮细胞凋亡和炎症反应过程中miR-196a表达下调,而罗伊氏乳杆菌通过增加细胞miR-196a含量抑制肠上皮细胞凋亡和炎症反应。
PDCD4是Shibahara等[25]在诱导凋亡的鼠细胞中发现的具有MA-3功能域的新基因。PDCD4是进化上高度保守的基因,广泛表达于多种组织和器官,细胞凋亡和炎性疾病的发生密切相关[26]。在心脏缺血再灌注诱导心肌细胞凋亡过程中PDCD4基因表达升高,靶向抑制心肌细胞中PDCD4蛋白的表达,可显著减少心肌细胞凋亡[27];PDCD4蛋白在高浓度葡萄糖诱导凋亡的血管内皮细胞中表达上调,干扰PDCD4基因表达显著抑制血管内皮细胞的凋亡[28]。此外,在肠缺血再灌注过程中,肠上皮细胞的炎症反应和凋亡是由于miR-21表达下调,其靶基因PDCD4表达增加导致[29]。产气荚膜梭菌β2毒素感染肠上皮细胞后通过抑制miR-21上调PDCD4表达,从而诱导细胞凋亡和炎症反应[30];而在结直肠癌细胞中PDCD4基因表达降低,而miR-196a表达增加,miR-196a通过靶向PDCD4抑制结直肠癌细胞凋亡。这些研究表明靶向调控PDCD4表达可影响细胞凋亡[31]。
本实验中罗伊氏乳杆菌通过上调肠上皮细胞miR-196a表达,下调miR-196a靶基因PDCD4表达,抑制LPS引起的肠上皮细胞炎症反应和凋亡。研究结果为开发罗伊氏乳杆菌成为促进肠道健康发育的功能添加剂提供了理论支撑。

