甘油提取结合液相色谱-串联质谱法检测茶叶及副产物中7 类化学成分
管梦迪,郑亚茹,杨柱林,李慧敏,娄华桥,杨玉冰,李佳梅,易伦朝,李斯屿,胡永丹,任达兵
(昆明理工大学食品科学与工程学院,云南 昆明 650500)
茶是中国特色经济农作物之一,是世界上最古老、消费最多的饮料之一。茶叶含有丰富的化学成分,许多研究已经表明这些成分不仅对茶叶的风味具有重要作用,而且具有非常明显的生物活性[1-3]。2022年全国干毛茶总产量为335万 t,茶叶加工过程中,不可避免地会产生副产物。例如,普洱生茶加工中产生的茶渣,据统计每生产1 t成品茶就会产生20~30 kg干茶副产物[4]。
研究表明,茶叶中含有儿茶素、酚酸、黄酮、有机酸、氨基酸、生物碱、核苷酸等丰富的化学成分[5-6]。相比之下,茶叶副产物中这些成分的组成和含量尚不完全清晰。对茶叶及其副产物中多类化学成分进行准确定量分析有助于全面认识茶叶副产物的化学成分组成,为茶叶副产物的综合利用提供数据。目前,常用的定量分析技术有光谱法、色谱法、电化学法、质谱法等[7-9]。上述分析技术中,质谱技术具有很高的灵敏度和准确度,能够同时分析多个化学成分(>100),目前已被广泛应用于茶叶的物质定量分析检测[10]。超高效液相色谱-三重四极杆串联质谱(ultra-high performance liquid chromatography-triple quadrupole tandem mass spectrometry,UPLC-QQQ-MS/MS)技术具有定量准确度高、重复性好、灵敏度高、特异性强、通量高等优点,非常适合于多类成分及低含量成分的准确定量分析[11-13]。Panyatip[14]、Kikkawa[15]、Wang Dan[16]等利用UPLC-QQQ-MS/MS技术分别对茶叶中酚类、儿茶素、氨基酸、生物碱、核苷酸进行了检测。
选择恰当的溶剂进行提取是茶叶化学成分定量分析的必要步骤。目前,研究人员主要使用甲醇、乙醇、乙酸乙酯、氯仿作为提取溶剂[17-20]。然而,茶叶的化学成分存在结构多样、极性差异大和浓度范围广的特点,上述溶剂在同时高效提取多类具有不同性质的成分方面存在不足[21]。甘油具有低毒、难挥发、化学性质稳定的特性,符合理想绿色溶剂的大部分要求,已经在化妆品工业、食品工业中获得广泛应用[22]。甘油属于天然碱性化学物质,具有多羟基结构和较低的介电常数,可以改变水的介电常数,它的水溶液对酚类、鞣质类物质的溶解度较高[23-24]。目前,甘油在提取枸杞[25]、芦笋[26]、籼米叶[27]中的黄酮、酚类物质方面已显现出比甲醇、乙醇更好的性能。因此,甘油有望替代甲醇等传统有机溶剂,实现茶叶中多类化学成分的同时有效提取。
本研究利用甘油结合超声法提取茶叶及其副产物中的化学物质,通过单因素试验确定最佳提取工艺条件,探究甘油对茶叶中多类化合物的提取效率。优化建立色谱-质谱检测方法(如洗脱梯度、流动相组成、色谱柱等),以实现茶叶中酚类、黄酮类、氨基酸、生物碱、儿茶素等多类化学成分的准确定量分析。通过方法学验证考察所建方法的灵敏度和准确度,并将所建方法应用于实际的茶叶及副产物样本,研究茶叶副产物中化学成分的组成和含量,为茶叶副产物的高值化利用提供参考。
1 材料与方法
1.1 材料与试剂
茶叶样品依托当地茶叶生产企业进行加工和收集,包括普洱生茶、黄片和副产物(茶渣)。茶叶样本经干燥后粉碎,过60 目筛,放在密封袋中,保存在-20 ℃冰箱。
甲醇、乙醇、乙二醇、丙醇、1,2-丙二醇、1,3-丙二醇、甘油、1,3-丁二醇、2,3-丁二醇、1,4-丁二醇(均为色谱级),甲酸(质谱级)上海易恩化学技术有限公司;乙腈(质谱级)德国Merck公司;本实验共用到130 个标准品,购买于由西力生物有限公司、北京伊诺凯有限公司、厦门慧嘉生物科技有限公司、成都曼斯特生物科技有限公司和上海西宝生物科技有限公司。
1.2 仪器与设备
LCMS-8040 UPLC-QQQ-MS/MS联用仪 日本岛津实验器材有限公司;KQ800 DE 数控超声机昆山生物科技有限公司;MS105DU电子分析天平瑞士梅特勒-托利多仪器有限公司;TGL-16M高速离心机湘潭湘仪仪器有限公司;倍达浦超滤型超纯水机 南京权坤生物科技有限公司;FSJ-A05B1打粉机 广东小熊电器有限公司;移液枪 美国赛默飞世尔科技公司。
1.3 方法
1.3.1 提取条件的优化
1.3.1.1 样品溶液的制备
称取0.5 g茶粉于10 mL离心管中,加入5 mL 70%甘油溶液,涡旋混匀,超声提取20 min(40 ℃、400 W),提取结束后离心取上清液,用70%乙腈溶液稀释50 倍,每个样品重复3 次。取一定量的稀释液过0.22 μm有机滤膜后用于UPLC-QQQ-MS/MS分析。
1.3.1.2 提取试剂的选择
以甘油、水、甲醇、乙醇、乙二醇、丙醇、1,2-丙二醇、1,3-丙二醇、1,3-丁二醇、2,3-丁二醇和1,4-丁二醇作为提取溶剂。除水外,其余均为70%水溶液,样品制备同1.3.1.1节,对比提取效果,选择一种最佳提取溶剂。
1.3.1.3 单因素试验
分别考察不同提取温度(20、30、40、50、60 ℃)、提取时间(5、10、20、30、40 min)、固液比(1∶10、1∶20、1∶30、1∶40、1∶50(g/mL))、溶剂含水量(30%、50%、70%、90%、100%)对待测物的提取效果,计算待测物提取量,每个样品重复3 次。
1.3.2 UPLC-QQQ-MS/MS方法的建立
1.3.2.1 混标溶液的制备
准确称取标准品各1 mg于2.5 mL小烧杯中,加入适量70%乙腈溶液溶解。将烧杯中的溶液转移至10 mL容量瓶中,用70%乙腈溶液定容,获得质量浓度为100 μg/mL的混标储备液,置于冰箱中避光保存待用。
1.3.2.2 方法参数的确定
UPLC-QQQ-MS/MS主要由UPLC分离系统和三重四极杆质谱检测系统串联组成。其中,UPLC系统包括二元泵、自动进样器、柱温箱等模块。
本研究采用两根不同的色谱柱对不同类型的成分进行分离分析。一方面,采用Hypersil GOLD C18柱(100 mm×2.1 mm,1.9 μm)对儿茶素、酚酸、黄酮进行洗脱分离,具体的色谱条件:柱温35 ℃,进样量1 μL,流动相为0.1%甲酸溶液(A)和乙腈(B),流速0.2 mL/min,梯度洗脱:0.01~1 min,92%~87% A、8%~13% B;1~2 min,87%~83% A、13%~17% B;2~3 min,83%~80% A、17%~20% B;3~9 min,80%~75% A、20%~25% B;9~10 min,75%~68% A、25%~32% B;10~11 min,68%~50% A、32%~50% B;11~12 min,50%~40% A、50%~60% B;12~14 min,40%~15% A、60%~85% B;14~18 min,15%~92% A、85%~8% B;另一方面,采用色谱柱Hypercarb C18柱(100 mm×2.1 mm,3 μm)对生物碱、氨基酸、有机酸、核苷及核苷酸等亲水性成分进行洗脱分离,具体条件为柱温40 ℃,进样量1 μL。流动相为0.2%甲酸+1 mmol/L甲酸铵溶液(A)和乙腈(B),流速0.3 mL/min,梯度洗脱:0~1 min,95%~85% A、5%~15% B;1~3.5 min,85%~75% A、15%~25% B;3.5~4.5 min,75%~65% A、25%~35% B;4.5~6.5 min,65%~60% A、35%~40% B;6.5~7 min,60%~40% A、40%~60% B;7~7.01 min,40%~10% A、60%~90% B;7.01~8 min,10%~5% A、90%~95% B;8~8.5 min,5%~40% A、95%~60% B;8.5~9 min,40%~60% A、60%~40% B;9~9.5 min,60%~95% A、40%~5% B;9.5~12 min,95% A、5% B。
质谱条件:干燥气流速15 L/min,吹扫气流速3 L/min,接口电压4.5 kV,CID气压230 kPa,离子传输管温度300 ℃,加热板温度400 ℃,检测电压2.08 kV。此外,采用仪器自带的软件对多反应监测离子对、碰撞电压进行优化和选择。
1.3.2.3 方法学考察
方法学考察的内容包括标准曲线、检测限、定量限、精密度、加标回收率以及基质效应,基于这些指标评价方法的精密度和准确度。制作标准曲线时,用70%乙腈溶液将标准品的储备液梯度稀释,获得一系列不同质量浓度的混标溶液(100~0.01 μg/mL),用定量出的峰面积与其对应的质量浓度通过回归拟合绘制标准曲线。检测限以及定量限分别以信噪比的3 倍和10 倍进行计算。精密度包括日内和日间精密度,选择高(100 μg/mL)、中(10 μg/mL)、低(0.5 μg/mL)混标溶液进行测定,分别在1 d内完成6 次重复进样和3 d内重复进样6 次。测定之后,计算各成分含量的日内和日间相对标准偏差(relative standard deviation,RSD),用以表征日内和日间精密度。茶叶基质较为复杂,含有茶多酚、生物碱、色素、糖类等多种物质,加标回收可以表征样品中的其他成分对目标分析物离子响应强度的影响。采用样品加标回收法进行回收率实验,将高(100 μg/mL)、中(10 μg/mL)、低(0.5 μg/mL)3 个质量浓度的混标溶液加入茶叶样品中进行检测。测定加入标准品的质量浓度,然后通过比较实际质量浓度和测定质量浓度计算回收率。溶剂基质常对分析物的分析过程有显著的干扰,并影响分析结果的准确性。在甘油和乙腈溶液中加入相同量的标准品母液,稀释相同的倍数,纯溶剂中分析物响应值与样品基质中添加相同含量分析物响应值的比值为基质效应的数值,评价甘油溶液对于各类目标成分的基质效应。
1.4 数据处理
UPLC-QQQ-MS/MS 原始数据由仪器自带的Labsolution软件处理,获得各个物质的峰面积,通过标准曲线拟合,获得各目标物的质量浓度(mg/mL)。根据样品量、稀释倍数等一系列数据,将质量浓度转化为茶样中目标物的含量(mg/kg)。实验结果以表示。
2 结果与分析
2.1 不同溶剂提取效果比较
选取咖啡因、茶氨酸、没食子酸、表没食子儿茶素没食子酸酯((-)-epigallocatechin-3-gallate,EGCG)等21 种成分作为代表性物质,用于评价各提取溶剂的性能,这些代表性成分在茶叶中含量较高,包括酚酸类、氨基酸、茶碱、儿茶素等类别。如图1所示,甲醇、乙醇、1,4-丁二醇、2,3-丁二醇以及甘油的提取效果较好,它们对各物质提取峰面积总和均高于1.1×108。相比之下,纯水的提取效果最差,峰面积总和低于0.6×108,这可能是因为水的极性最大,对中极性物质(酚类)的提取效果不好。上述溶剂中,甘油对氨基酸的提取效果最佳,峰面积高达0.7×108。甘油由于介电常数较低,对酚类的提取效果也较好。由于甘油的综合提取性能以及本身的绿色性质,最终作为本研究的提取溶剂,实现一次提取并对多类成分定量分析的目的。

图1 不同溶剂的茶叶化学物质提取效果比较Fig.1 Comparison of the extraction efficiency of different solvents for the extraction of compounds from tea
2.2 单因素试验结果
目前茶叶化合物的提取方法主要有:超声辅助提取法、热水浸提法、有机溶剂萃取法和微波辅助提取法。由于超声波具有空化作用,有助于植物的细胞壁破裂,使有效成分高效溶出,超声辅助提取已被证明可以提高目标成分的提取率[28]。影响超声辅助提取效率的因素包括提取时间、固液比、溶剂含水量、提取温度等,本研究通过单因素试验进行考察并优化,结果如图2所示。
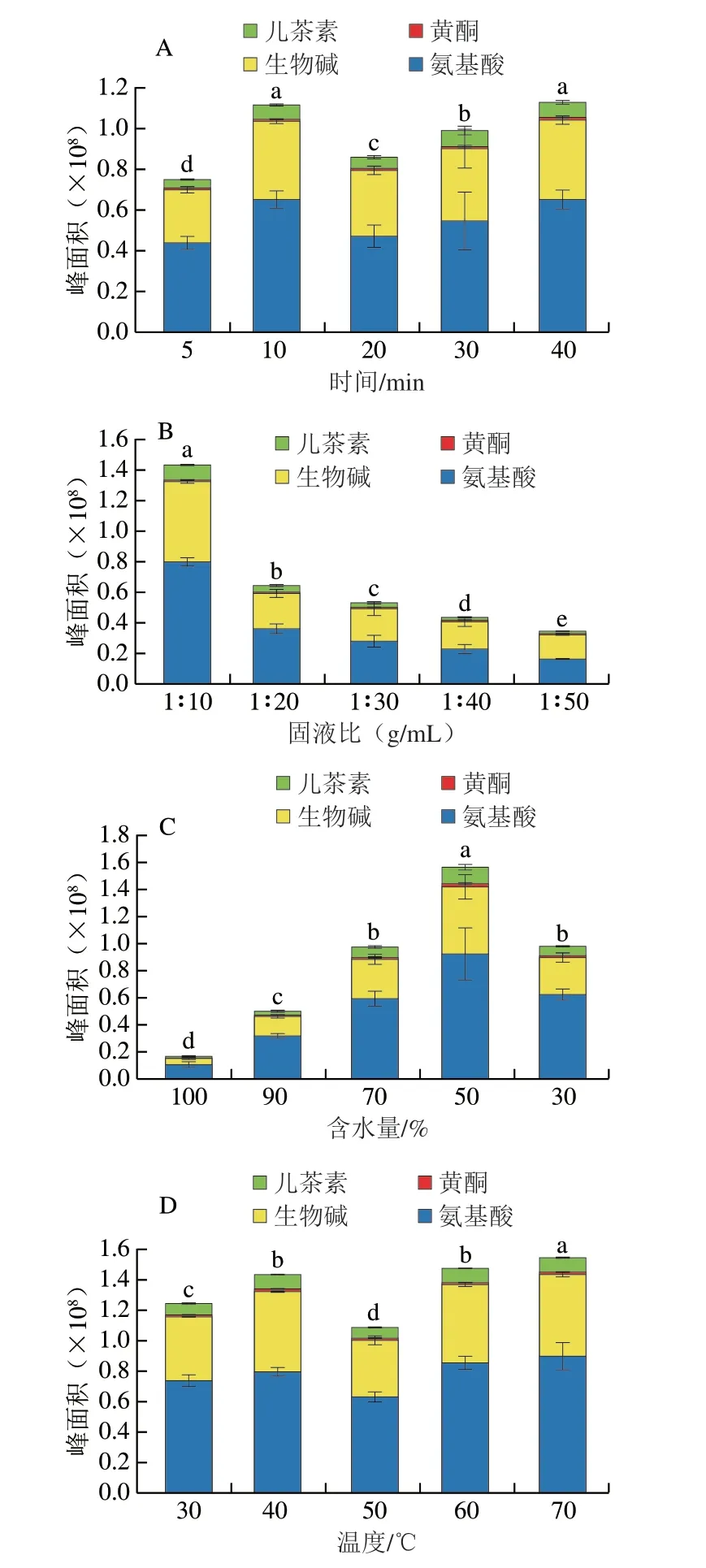
图2 单因素对茶叶化学物质提取效果的影响Fig.2 Effect of operating parameters on the extraction efficiency of tea components investigated by single factor experiments
由图2A可知,随着超声时间的延长,待测物提取率增加,在10~40 min内整体呈现先下降后上升的趋势。其中,在10 min和40 min时提取效果最好,总体峰面积超过1×108,且不存在显著差异。超声的空化作用以及机械作用可以加速目标物从茶叶中向提取试剂中转移,同时有可能对目标物存在破坏作用[29-30],所以在20 min时提取效果仅好于5 min。考虑到时间成本,最终确定10 min为最佳提取时间。
由图2B可知,固液比的改变对提取效果影响较大。随着固液比的增大提取效果降低,固液比1∶10时,提取效果最好,总体峰面积超过1.4×108。茶叶中的化合物在固液比1∶10时已经全部溶出,最终采用固液比1∶10。
由图2C可知,茶叶目标物的提取效果随着甘油含水量的增加呈先增后降的趋势。当甘油含水量达到50%时提取效果最好,总体峰面积超过1.6×108,约是含水量70%(0.976×108)和30%(0.979×108)时提取峰面积的1.6 倍。甘油与水可以任意比例互溶,加入水后黏度降低,活性物从茶叶转移到提取试剂的阻力变小。当含水量高于50%时,提取试剂极性与目标物极性相差较大,提取效果降低。在甘油的存在下水溶液的极性和黏度需要达到平衡,因此,最终选择甘油的含水量为50%。
由图2D可知,超声提取温度从30 ℃升高到40 ℃时,提取效果明显提高,从40 ℃升高到70 ℃,提取效果先降低后增高。提取温度为40、60、70 ℃时,总体峰面积均超过1.4×108,且在40 ℃与60 ℃条件下提取效果没有明显差异。产生这种现象的原因可能是温度升高使分子运动加速,目标物提取率增大,但随着温度继续升高目标物成分受到破坏,使得提取率降低。继续升温,特征物质在溶剂中的溶解度增加。从经济成本看,提取温度40 ℃效果最佳。
2.3 液相色谱-质谱条件的优化
色谱条件的优化主要包括流动相组成、洗脱梯度以及色谱柱的选择。色谱条件优化后可以使目标物获得良好分离,提高定量的准确性。梯度洗脱可以使一个复杂样品中性质差异较大的组分实现良好的分离,确保在较短的时间内样品中不同极性的组分均能被洗脱出来。
参考课题组前期的研究,本实验采用Hypersil GOLD C18色谱柱对茶叶中的儿茶素、黄酮和酚酸等酚类物质进行分离[11],流动相为0.1%甲酸溶液(A)和乙腈(B),对洗脱梯度进行微调,具体见1.3.2.2节。前期工作中,课题组采用亲水作用的Syncronis HILIC色谱柱检测茶叶中的生物碱、核苷、核苷酸、氨基酸4 类亲水性物质[16]。亲水色谱柱的柱效通常随流速增大而降低,不利于快速色谱分离,此外该类型色谱柱需要较长的柱平衡时间。Hypercarb色谱柱是一类采用多孔石墨碳作为填料的C18色谱柱,对极性化合物有较强的保留能力,对结构相近物质能很好分离,有较宽的pH值范围并且高温条件下仍能保持稳定性。因此,本研究选择Hypercarb C18色谱柱用于有机酸、生物碱、核苷、核苷酸、氨基酸5 类亲水性成分的分离分析,通过条件优化,最终确定流动相为0.2%甲酸+1 mmol/L甲酸铵(A)和乙腈(B),具体的洗脱梯度见1.3.2.2节。应用优化的UPLC-QQQ-MS/MS条件,对7 类共130 个化学成分进行分离分析,结果如图3所示,可以看出这些成分均获得了良好分离且具有较好的峰形,为准确定量分析奠定了基础。

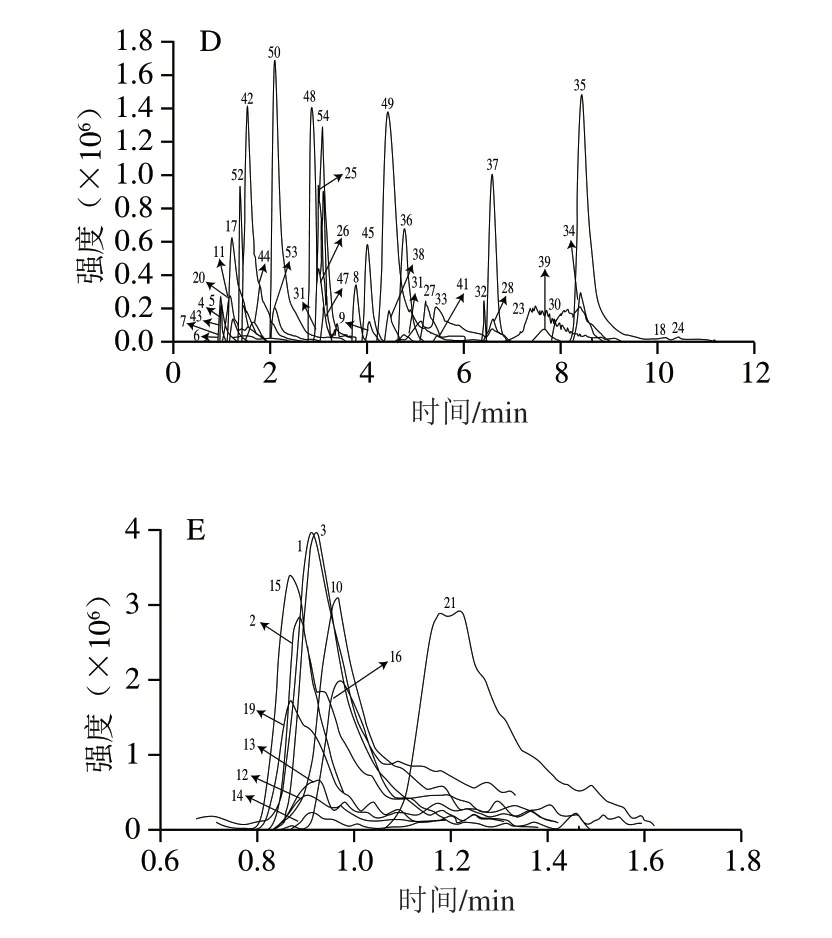
图3 130 种物质总离子流图Fig.3 Total ion chromatograms of 130 substances
2.4 方法学验证
检测限、定量限、精密度、加标回收率、准确度以及基质效应结果见表1、2,7 类化合物均在0.018~96.150 µg/mL内呈现良好的线性关系(0.4~12 000 mg/kg,R2≥0.990)。检测限和定量限分别为0.000 1~4.332 1 mg/kg与0.000 2~12.996 3 mg/kg,表明该方法具有很高的灵敏度。在高、中、低3 个质量浓度下,日内、日间精密度分别为0.04%~14.94%和0.35%~14.90%,表示仪器稳定性较好,实验结果比较可靠。目标物的加标回收率以及RSD分别在80.10%~121.12%和0.26%~25.68%之间,证明该方法准确度较高。基质效应在72.00%~118.27%之间,结果可被接受。以上结果表明本研究建立的甘油提取结合UPLC-QQQ-MS/MS定量分析方法有良好的准确性和精密度。

表1 酚类物质UPLC-QQQ-MS/MS方法学验证结果Table 1 Analytical figures of merit of UPLC-QQQ-MS/MS for phenolics
2.5 方法的应用
将建立的方法应用于实际茶叶样本及其副产物的化学成分定量分析,首先采用甘油结合超声处理提取多类化学成分,然后利用验证后的UPLC-QQQ-MS/MS进行定量分析。定量结果如表3所示,共检测出酚类成分41 种、有机酸6 种、氨基酸16 种、生物碱1 种、核苷2 种,未检出的成分可能是未提取到或是其含量低于检测限。
将各检测到的化学成分含量相加,加合总含量如图4所示。可以看出,不同样本的总含量相差较大,在86 622.93~219 652.94 mg/kg范围内。其中,加合总含量最高的样本分别为普洱生茶6号(219 652.94 mg/kg)、普洱生茶4 号(169741.61 mg/kg)和黄片(151 354.49 mg/kg)。所有样本中,普洱生茶5号(112 235.94 mg/kg)和茶渣(86 622.93 mg/kg)的加合总含量较低。

图4 不同茶叶被测物质加合总含量比较Fig.4 Comparison of the total contents of all detected compounds in tea samples
定量结果表明,茶叶及其副产物的样本中含量较高的化学成分包括表儿茶素(2 399.42~21 207.83 mg/kg)、表没食子儿茶素(1 369.47~7 934.14 mg/kg)、表儿茶素没食子酸酯(5 168.42~26 854.46 mg/kg)、E GCG(6 484.68~28 844.07 mg/kg)、3-没食子酰基奎宁酸(2 230.36~15 722.18 mg/kg)、茶氨酸(5901.84~14458.35 mg/kg)、咖啡因(6506.29~12017.14 mg/kg)、奎宁酸(5 649.48~29 529.46 mg/kg)。具体含量对比如图5所示,黄片和茶渣中的化学成分比较丰富。例如,茶渣中上述物质总含量较低,但是其咖啡因含量(9 969.66 mg/kg)仅次于普洱生茶7号(12 017.14 mg/kg)。咖啡因是茶叶中提供苦涩味的主要物质之一,对人体具有一定的促兴奋作用,还具有一定的药理功能。普洱生茶3、6、7、8号以及黄片的茶氨酸含量均大于13 000 mg/kg,说明茶氨酸是普洱生茶及其副产物中含量最高的氨基酸,茶氨酸约占茶叶氨基酸总量50%~60%,具有甜味和鲜爽味,是茶叶的滋味物质。氨基酸成分中除茶氨酸外,精氨酸(1 114.87~3 679.68 mg/kg)、天冬氨酸(1344.32~3459.21 mg/kg)、谷氨酰胺(796.21~1653.41 mg/kg)、天冬酰胺(401.38~1938.94 mg/kg)和谷氨酸(2 387.83~6 554.72 mg/kg)的含量也较高。儿茶素类化合物是茶叶中的主要功能成分,占茶叶干质量的12%~24%,是茶汤苦涩味的呈味物质和茶汤的呈色物质。普洱生茶2、3、4、6号总儿茶素含量超过60 000 mg/kg,普洱生茶1、5、7、8号和黄片总儿茶素含量介于40 000~60 000 mg/kg之间,茶渣含量为15 830.05 mg/kg。
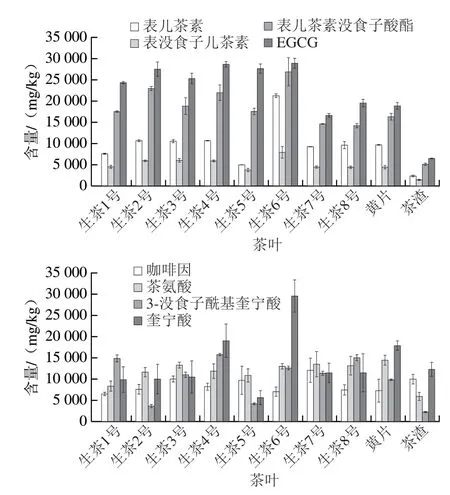
图5 不同种类茶叶主要化学成分的含量Fig.5 Contents of major chemical components detected in different types of tea
黄片是指加工过程中外观不满足生产标准,而被人工剔除用于其他生产的茶箐。本研究的结果表明,黄片中化学成分的含量与正常茶叶样本相当,如其EGCG、咖啡因、茶氨酸的含量分别为18 806.25、9 969.66 mg/kg和14 458.35 mg/kg,甚至高于某些正常茶叶样本的含量。茶渣是茶叶加工中产生的另一类主要副产物,包括挑拣剩下的茶末、茶梗。定量结果表明茶渣中含量较高的化学成分包括表儿茶素(2 399.42 mg/kg)、表没食子儿茶素(1 369.47 mg/kg)、表儿茶素没食子酸酯(5 168.42 mg/kg)、EGCG(6 484.68 mg/kg)、3-没食子酰基奎宁酸(2 230.36 mg/kg)、木犀草素(44.91 mg/kg)、精氨酸(1 163.86 mg/kg)、天冬氨酸(1 374.07 mg/kg)、茶氨酸(5 901.84 mg/kg)、咖啡因(9 969.66 mg/kg)、奎宁酸(12 322.43 mg/kg)、乳酸(10 107.8 mg/kg)和草酸(7 542.81 mg/kg)。因此,茶渣作为茶叶加工的副产物,同样含有丰富的生物活性成分,存在进一步利用的价值。
3 结论
本研究建立了一种以甘油为溶剂的超声辅助提取方法,可以同时高效提取茶叶中的多类化学成分,在此基础上进一步优化建立了茶叶中7 类共130 种化学成分的UPLC-QQQ-MS/MS定量分析方法。方法学考察结果表明所建立方法具有良好的线性关系(0.4~12 000 mg/kg,R2≥0.990)、检测限(0.000 1~4.332 1 mg/kg)、定量限(0.000 2~12.996 3 mg/kg)、日内精密度(0.04%~14.94%)、日间精密度(0.35%~14.90%)、加标回收率(80.10%~121.12%)、RSD(0.26%~25.68%)。此外,基质效应为70.70%~118.27%。以上结果表明所建方法具有良好的线性范围、精密度和准确度。基于所建立的方法,成功测定了普洱生茶及其加工副产物中各类化学成分的准确含量,结果表明茶叶副产物同样含有丰富的化学成分,尤其是儿茶素、咖啡因、茶氨酸等主要成分。虽然甘油适用于茶叶化合物的绿色提取,但是甘油黏性较大,一般使用其水溶液。本研究为茶叶化学成分提取提供了思路,且进一步探索了茶叶副产物中这些成分的组成和含量。

