玻璃态液氮速冻对蓝莓品质特性的影响
黄碧飞,李 洋,胡泽茜
(东北林业大学土木与交通学院,黑龙江 哈尔滨 150040)
蓝莓,又名越橘,果实香气宜人、皮薄汁多,果肉细腻、酸甜可口[1]。蓝莓富含花青素、维生素等营养物质,素有“浆果之王”的美称,被联合国粮食及农业组织认定为人类五大健康食品之一,研究表明经常食用蓝莓有助于消除眼睛疲劳、强化视力、抗氧化和延缓衰老等[2-3]。蓝莓鲜果水分极多,采后呼吸代谢旺盛,易造成水分流失和霉菌生长,导致果实腐烂变质和营养成分流失,不能长期存放[4]。因此需要有效的方法延长蓝莓果实保质期且最大限度地保留其营养成分。冷冻是食品保鲜的基础和核心技术,是保持食品原始质量并延长贮藏寿命最广泛使用的方法之一,许多食品甚至可以直接在冷冻状态食用[5]。
食品的冷冻贮藏温度高于安全贮藏温度会对其新鲜度和其他重要的质量参数产生负面的影响,因此,在安全温度下贮藏对于增强食品的稳定性是必要的[6]。基于玻璃化转变的概念,当贮藏温度低于玻璃化转变温度,分子迁移率显著降低[7],所以食物在玻璃化状态下高度稳定。因此,可以采用贮藏温度低于玻璃化转变温度方式,最大限度地控制食品内部营养成分的流失。对于含水量高(含有冷冻水)的食品,玻璃化转变和结冰是较为复杂的过程,食品的稳定性可以根据其状态图的特征玻璃化转变温度(Tg′或Tg″)和特征冻结终点温度(Tm′)确定[8]。一些研究报道,低于Tg′的冷冻贮藏可以提供更高的食品质量。Li Xianxian等[9]的研究表明,Tg′、Tm′对芒果冷冻贮藏过程中的稳定性十分重要。Xu Congcong等[10]建立了芹菜的状态图,发现低于Tg′的温度是保持冷冻芹菜质量和结构的最佳选择。Tian You等[11]得出结论,低于玻璃化转变温度的冷冻储存更能保持冬虫夏草的质量。
为了实现完全的玻璃化转变,通常需要106K/s的降温速率,而在实际应用过程中,对于水分含量高的食品,很难达到这么高的冷冻速率[12]。液氮速冻传热速率快,能够促进短时间内细小冰晶的形成,从而提供质量更好的冷冻食品。对荔枝[13]、杨梅[14]研究表明,相比于浸渍冷冻和冰柜冷冻,液氮喷雾速冻在冻荔枝、冻杨梅的品质保持上具有显著优势。Cao Xuehui等[15]将蓝莓在液氮中浸渍冷冻约30 s至中心温度达到-18 ℃,发现果实出现霜冻开裂,导致更高的滴水损失和其他品质下降。Cheng Lina等[16]评估了液氮喷雾冷冻(-100~-20 ℃)蓝莓至中心温度-20 ℃的质量变化,认为液氮-80 ℃是蓝莓的最佳冷冻温度。赵远恒等[17]认为液氮速冻可以实现食品处于玻璃化状态。
目前关于蓝莓玻璃化转变温度的报道相对匮乏,尤其是液氮速冻结合特征玻璃化转变温度冷冻蓝莓。基于此,本研究通过测定蓝莓的玻璃化转变温度,构建状态图确定其特征玻璃化转变温度,以蓝莓特征玻璃化转变温度为冻结终点,对比分析超低温冰箱冷冻(-80 ℃)、液氮速冻(-80、-100、-120 ℃)对冷冻蓝莓品质特性的影响,探究适宜的冷冻条件保持冷冻蓝莓的品质。
1 材料与方法
1.1 材料与试剂
‘北村’蓝莓采自哈尔滨红旗乡中沃蓝莓基地,挑选无病虫害、无机械损伤、成熟度一致、大小均匀的新鲜果实于4 ℃冷藏备用。
氯化锂、乙酸钾、氯化镁、碳酸钾、溴化钠、碘化钾、氯化钠、氯化钾、硫酸钾、百里香酚、聚乙烯吡咯烷酮(均为分析纯),变色硅胶(化学纯)西陇科学股份公司;氢氧化钠标准溶液、酚酞指示剂、淀粉指示剂 广州和为医药科技有限公司;淀粉指示剂、碘酸钾标准溶液、乙酸-乙酸钠缓冲液、戊二醛固定液、磷酸盐缓冲液 福州飞净生物科技有限公司;盐酸、甲醇、硫代巴比妥酸、三氯乙酸、聚乙二醇6000、曲拉通X-100、愈创木酚、过氧化氢溶液、邻苯二酚、无水乙醇国药集团化学试剂有限公司。
1.2 仪器与设备
FD-1A-80真空冷冻干燥机 上海比朗仪器有限公司;ML204电子天平 梅特勒-托利多仪器(上海)有限公司;DH3600II电热恒温培养箱 河北菲斯福仪器有限公司;DSC214 Polyma差示扫描量热仪(differential scanning calorimeter,DSC)德国NETZSCH公司;MDF-U33V 型-86 ℃超低温冰箱 日本PHC bi公司;BCD215SEEB多温度冰箱 青岛海尔电器有限公司;YET-640X温度记录仪 兴化市苏玛电器仪表有限公司;GY-3硬度计 衢州艾普计量仪器有限公司;Master RI手持式折光仪 上海仪电分析仪器有限公司;TGL-20B离心机 上海安亭科学仪器厂;T6新世纪型紫外-可见分光光度计 北京普析通用仪器有限责任公司;DDS-11A电导率仪 上海越平科学仪器有限公司;Sigma500扫描电子显微镜 德国ZEISS公司。
1.3 方法
1.3.1 样品制备
蓝莓果实放入真空冷冻干燥机进行冻干,冷阱温度为-60 ℃,绝对压力为10 Pa,持续干燥48 h,将冻干样品打成粉末,并将其放置于含有变色硅胶的干燥器中2 周,使蓝莓粉脱水至恒质量,即为蓝莓冻干粉。参考Zhao Jinghong等[18]的方法,为获得不同水分活度(aw)的样品,分别称取1 g蓝莓冻干粉于称量瓶内,放置于装有不同饱和盐溶液的干燥器上方,当aw>0.75时,在干燥器内放置一个装有适量百里香酚的称量瓶防止样品发霉,然后将干燥器转移至温度为25 ℃的恒温箱内平衡48 h。使用不同饱和盐溶液(氯化锂、乙酸钾、氯化镁、碳酸钾、溴化钠、碘化钾、氯化钠、氯化钾、硫酸钾),得到aw分别为0.11、0.23、0.33、0.43、0.58、0.69、0.75、0.84、0.97的样品。此外,为获得aw>0.97的样品,将预先计算好的蒸馏水和冻干粉直接加入到称量瓶中,并将密封后的称量瓶置于4 ℃干燥器中平衡24 h。样品的含水率通过平衡前后冻干粉的质量差计算。
1.3.2 玻璃化转变温度测定
参照楚文靖等[19]的方法并略作修改,使用DSC测定不同含水率样品的玻璃化转变温度。将5~10 mg样品放入坩埚中并密封,于室温条件下加载到仪器上,每次分析均使用空的密封坩埚作为参考,使用双重扫描程序。aw为0.11~0.69的样品测定条件:温度范围为-80~40 ℃,升温和降温速率均为10 ℃/min,并在-80 ℃保持5 min。aw>0.75的样品测定条件:温度范围为-100~20 ℃,升温和降温速度率均为10 ℃/min,并在-100 ℃保持5 min。使用与仪器搭配的Proteus软件分析扫描热流曲线,得到不同含水率样品的玻璃化转变初始点(Tgi)、中点(Tgm)和终点(Tge),以及部分样品的初始冻结温度(TF)和冻结终点温度(Tm)。本实验以Tgm为样品的玻璃化转变温度,TF为冰晶熔融吸热峰的峰值温度,Tm为冰晶熔融吸热曲线的基线与吸热曲线左边的交点处温度。
利用Gordon-Taylor(GT)方程(式(1))对样品湿基含水率和玻璃化转变温度(Tgm)之间的关系进行模拟,利用Clausius-Clapeyron(CC)方程(式(2))对样品湿基含水率和冻结温度(TF)之间的关系进行模拟,由固形物质量分数高的样品Tm平均值计算得出最大冻结浓缩状态Tm′,绘制出蓝莓的状态图,确定蓝莓的Tg′(即Tm′垂直线与玻璃化转变曲线交点处温度)和Tg″(即冻结曲线与玻璃化转变曲线交点处温度)及其对应的固形物质量分数Xs′和Xs″。
式中:Tgm为样品的玻璃化转变温度/℃;Tgs为固体的玻璃化转变温度/℃;Tgw为水的玻璃化转变温度(-135 ℃);Xs为样品固体质量分数(湿基)/%;Xw为样品含水率(湿基)/%;k为GT方程拟合参数。
式中:ΔT为冻结温度降低值/℃(ΔT=Tw-TF,Tw水的冻结点温度/℃,TF为样品的初始冻结温度/℃);β为水的冻结常数(1 860 kg·K/(kg·mol));λw为水的分子质量;E为水和固体分子质量之比(E=λw/λs,λs为固体分子质量);Xs为样品的固体质量分数(湿基)/%。
1.3.3 蓝莓冷冻处理
将蓝莓果实分别在超低温冰箱-80 ℃(记为RF-80 ℃)冷冻和液氮-80、-100、-120 ℃浸渍冷冻(以下分别用LN-80 ℃、LN-100 ℃、LN-120 ℃表示),当果实中心温度降至-53 ℃(低于蓝莓Tg′=-52.55 ℃)时,冷冻完成。冷冻后的样品放置在-60 ℃(低于蓝莓Tg′)冰箱中贮藏72 h,于4 ℃冰箱解冻后进行指标测定。
1.3.4 冻结曲线的测定
使用K型热电偶和温度记录仪测定冷冻过程中蓝莓果实中心温度的变化,记录不同冷冻处理组所花费的时间。根据不同冷冻条件下蓝莓果实通过最大冰晶生成带(-5~-1 ℃)的时间计算冻结速率[11],如式(3)所示:
式中:T1=-5 ℃;T2=-1 ℃;Δt为通过最大冰晶生成带的时间/s。
1.3.5 蓝莓品质指标的测定
汁液损失率测定参考张晓敏等[20]的方法并略作修改,分别测定蓝莓果实冷冻前和解冻后的质量,按式(4)计算:
硬度用硬度计测定(单位为N/cm2)。总可溶性固形物(total soluble solids,TSS)质量分数(%)用手持折光仪测定。可滴定酸(titratable acid,TA)质量分数(%)用酸碱滴定法测定[21]。抗坏血酸(VC)含量用碘酸钾滴定法测定[21],单位为mg/100 g。花青素含量用紫外分光光度计法测定[21],单位为ΔOD/g。丙二醛(malondialdehyde,M D A)含量用紫外分光光度法测定[21],单位为nmol/g。相对电导率测定参考张晓敏等[20]的方法,单位为%,用相对电导率表示细胞膜透性。过氧化物酶(peroxidase,POD)和多酚氧化酶(polyphenol oxidase,PPO)活性分别用愈创木酚比色法和邻苯二酚比色法测定[21]。
1.3.6 微观结构的观察
参考Cheng Lina等[16]的方法,使用扫描电镜观察样品微观结构。
1.4 数据处理
2 结果与分析
2.1 不同水分含量蓝莓的玻璃化转变温度
食品的玻璃化转变温度与食品自身的水分含量、溶质的成分和分子质量密切相关,大多数物料呈含水率越高玻璃化转变温度越低的变化规律,可根据样品的DSC热流曲线是否有熔融峰出现判断样品含非冻结水或冻结水[8]。如表1所示,由于水的塑化作用,蓝莓的玻璃化转变温度随着含水率的增加而降低,当样品(湿基)水分质量分数由2%增加至80%时,其玻璃化转变温度由-7.99 ℃降至-60.56 ℃。如图1A所示,当蓝莓冻干粉样品的aw<0.75、水分质量分数<23%时,仅发生玻璃化转变,未检测出样品的Tm和TF,说明这些样品在冻结过程中并没有冰晶生成,含非冻结水。这与楚文靖等[19]的研究结果保持一致。如图1B所示,当蓝莓冻干粉样品(湿基)水分质量分数在31%~80%时,DSC热流曲线同时检测出样品的Tm、TF和玻璃化转变温度,说明这些样品含冻结水。当水分质量分数>80%时,蓝莓鲜果(Xw=85%)的热流曲线如图1C所示,只观察到Tm和TF出现,未检测到玻璃化转变温度。随着固体质量分数由15%增加至69%,蓝莓的Tm从-14.20 ℃降至-35.41 ℃,而当样品固体质量分数>39%时,样品的Tm十分接近,几乎保持不变。当固体质量分数为53%和69%时,Tm的平均值为-34.17 ℃。
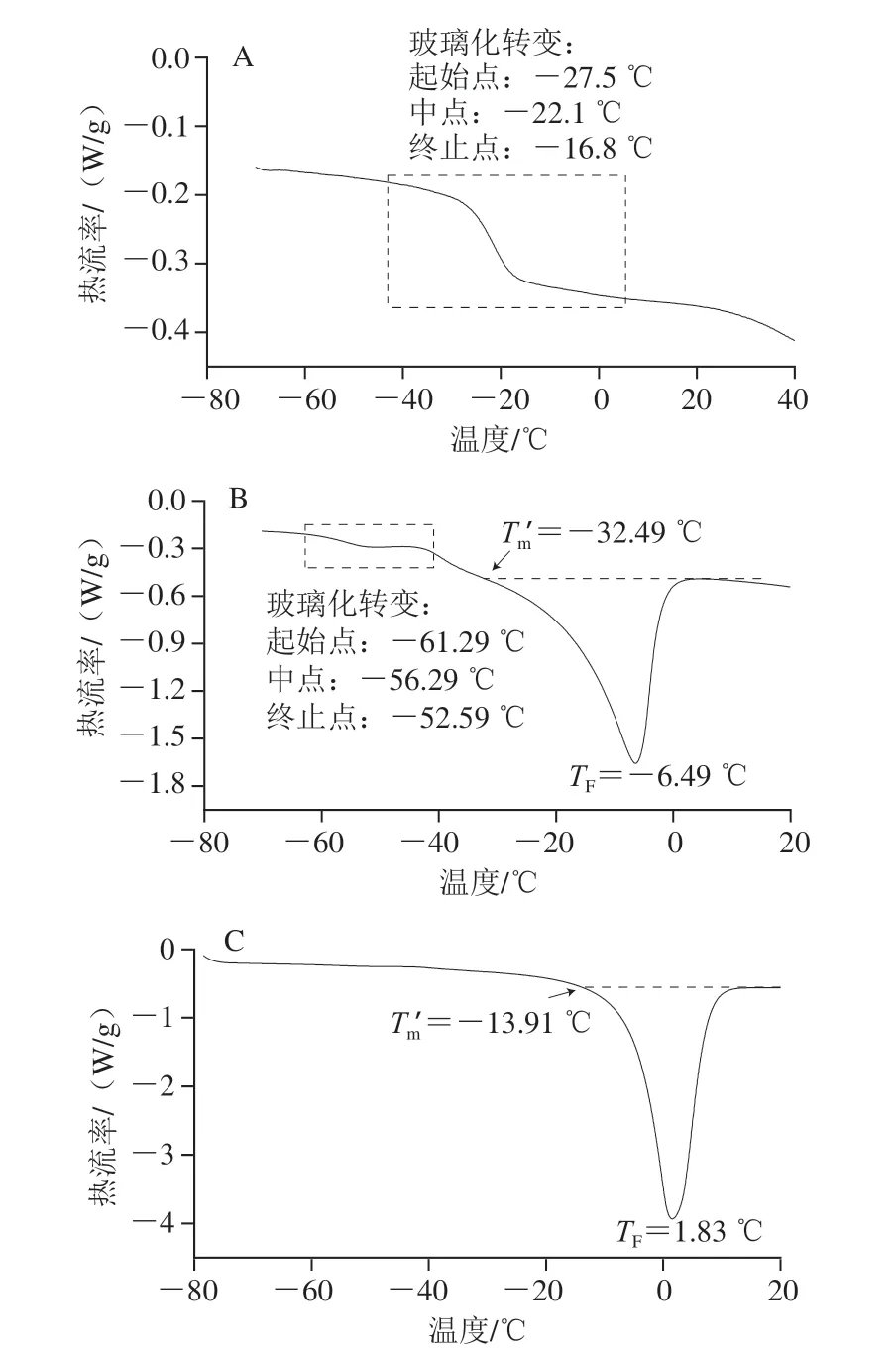
图1 蓝莓的典型DSC热流曲线Fig.1 Typical DSC heat flow curves of blueberries

表1 不同水分含量蓝莓的玻璃化转变温度Table 1 Glass transition temperature of blueberries at different moisture contents
状态图是食品不同状态时的水分含量或固体含量和温度的关系图,可用于评估低水分质量分数食品和冷冻食品的贮藏稳定性,以及选择合适的温度和水分含量条件进行加工[22]。蓝莓的状态图由玻璃化转变曲线(EF)、冻结曲线(AC)和最大冻结浓缩状态(B点)组成。如图2所示,玻璃化转变曲线经由GT方程拟合(R2=0.983),得出方程参数Tgs和k分别为0.22和2.04。冻结曲线由CC方程拟合(R2=0.972),得出参数E为0.1,蓝莓中固形物的相对分子质量为218.28。当所有可冻结的水完全转化为冰,并且在实际的时间尺度上停止冰的形成,冻结浓缩达到其组成的最大值,并被称为最大冻结浓缩状态[8]。最大冻结浓缩状态B点即特征冻结终点Tm′为-34.17 ℃,对应的Xs′为76%,而对应的Xw′(24%)被认为是不可冻结水的质量分数。不可冻结水包括未结晶的自由水和附着在固体基质上的结合水。根据状态图确定蓝莓的特征玻璃化转变温度Tg′(D点)和Tg″(C点)分别为-52.55 ℃和-46.03 ℃,对应的固体质量分数分别为76.0%和79.6%。

图2 蓝莓的状态图Fig.2 State diagram of blueberries
根据玻璃化转变概念,当温度降至食品最大冷冻浓缩状态的Tg′以下,则可以认为此时食物处于玻璃化状态,稳定性最高。因此,本研究的冷冻实验选择-53 ℃(低于-52.55 ℃)作为蓝莓的冻结终点。
2.2 不同冷冻方式对蓝莓冻结曲线的影响
如图3所示,RF-80 ℃、LN-80 ℃、LN-100 ℃、LN-120 ℃组的蓝莓果实中心温度降至终点温度Tg′所需时间分别为4 057.50、799.08、673.26、550.44 s,通过最大冰晶生成带的时间分别为153.33、137.95、124.88、108.76 s,冻结速率分别为1.57、1.74、1.92、2.21 ℃/min。冷冻过程中,液氮冷冻的总时间和通过最大冰晶生成带的时间明显短于冰箱冷冻,冻结速率明显高于冰箱冷冻,这是因为液氮传热速度比较快。液氮冷冻组随着冷冻的环境温度的降低,总冷冻时间和通过最大冰晶生成带的时间也缩短,冻结速率提高。冷冻速率与冷冻食品的质量有直接关系,一般来说,快速冷冻有利于在果实细胞内外形成细小且分布均匀的冰晶,进而保护果实内部细胞结构的完整性,从而有利于保持冷冻果实的品质[23]。

图3 不同冷冻冷冻方式下的蓝莓冻结曲线Fig.3 Freezing curves of blueberries under different freezing methods
2.3 不同冷冻方式对蓝莓汁液流失和硬度的影响
水分是保持果实品质及感官良好的决定性物质,水分流失会导致果实硬度下降,破坏其内部结构,降低各类感官品质[24]。冷冻样品解冻后的水分通常会产生一定的损失,这会影响样品整体的品质变化,因此,汁液流失是评价其质量的重要指标之一。如图4A所示,4 种不同冷冻温度对蓝莓样品汁液流失的影响存在显著差异,且果实的汁液流失率随冷冻温度的降低而减少。LN-120 ℃冷冻组的汁液流失率最低,为1.57%,与LN-100 ℃组样品无显著差异,与LN-80 ℃组和RF-80 ℃组差异显著;而RF-80 ℃冷冻组的汁液流失率最高,为2.44%。Cheng Lina等[16]研究发现随着温度的进一步降低,汁液流失不断减少,这表明一定程度上高冷冻速率有利于果实内部水分的保持。
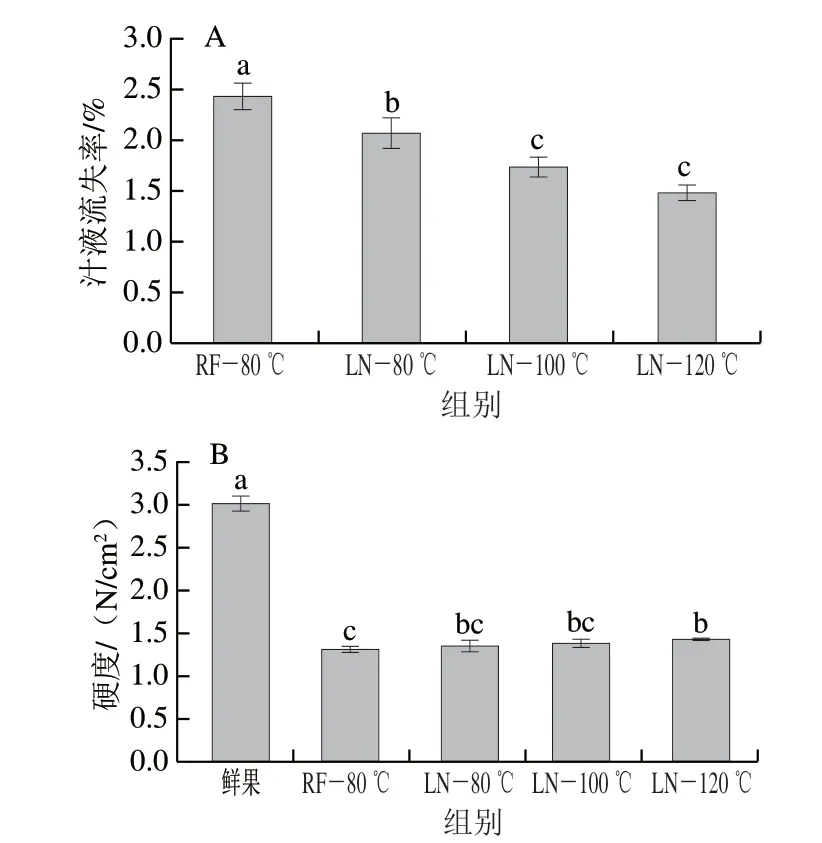
图4 不同冷冻方式下的蓝莓果实汁液流失率(A)和硬度(B)Fig.4 Juice loss (A) and hardness (B) of blueberry fruit under different freezing methods
冷冻样品经历冷冻和解冻(冰晶的形成和冰晶的融化)两次相变过程会对果实的组织结构造成一定程度的不可逆破坏,进而影响样品的质地。研究发现,与缓冻相比,速冻形成的小尺寸冰晶对细胞结构的破坏更小,对样品质地的影响更小[25]。冷冻果实的质地变化通常由果实的硬度反映,如图4B所示。样品经过冷冻再解冻后硬度显著降低,RF-80 ℃、LN-80 ℃、LN-100 ℃、LN-120 ℃冷冻蓝莓的硬度分别是鲜果的43.27%、45.03%、45.92%、47.46%,经过冷冻处理后的果实硬度都不足鲜果的50%,呈现出冷冻温度越高,硬度越低的规律。RF-80 ℃和LN-120 ℃存在显著差异,其他处理组之间的差异不显著。
2.4 不同冷冻方式对蓝莓营养物质的影响
蓝莓果实的口感风味与TSS和TA含量有关;VC和花青素是蓝莓主要的营养成分和抗氧化成分,其含量与果实品质密切相关;这些营养物质都是水溶性物质,容易伴随汁液流失而减少。如图5A、B所示,与鲜果相比,冷冻后蓝莓果实的TSS和TA含量都有所降低。RF-80 ℃、LN-80 ℃、LN-100 ℃、LN-120 ℃冷冻蓝莓的TSS质量分数分别为11.83%、12.10%、12.37%、13.67%,TA质量分数分别为0.85%、0.85%、0.87%、0.90%,LN-120 ℃冷冻蓝莓的TSS和TA保留率最高。如图5C、D所示,与TSS和TA含量的变化类似,冷冻后的蓝莓果实的VC和花青素含量也出现不同程度的降低。RF-80 ℃、LN-80 ℃、LN-100 ℃、LN-120 ℃冷冻蓝莓的VC含量分别为27.34、28.12、29.36、30.41 mg/100 g,花青素含量依次为LN-120 ℃>LN-100 ℃>LN-80 ℃>RF-80 ℃,其中LN-120 ℃的花青素含量最高,为1.12 ΔOD/g。RF-80 ℃冷冻组蓝莓的TSS、TA、VC和花青素含量都比液氮速冻组低,液氮速冻组蓝莓的营养物质含量随着冷冻温度的降低有所增长。

图5 不同冷冻方式下的蓝莓果实TSS含量(A)、TA含量(B)、VC含量(C)和花青素含量(D)Fig.5 TSS (A),TA (B),VC (C) and anthocyanin (D) contents of blueberry fruit under different freezing methods
水分是维持蓝莓风味营养物质的必要条件,当大量水分流失时,溶于果实水分中的营养成分也随之流失[26]。杨瑾莉等[23]的研究结果显示,随着液氮速冻温度下降,火龙果的汁液流失率下降,TSS和TA含量上升。王喜芳等[27]的研究结果显示,冻结温度越低,草莓中VC和花青素的保留率越高。结合冷冻蓝莓的汁液流失情况与TSS、TA、VC和花青素含量的变化结果,可以发现蓝莓TSS、TA、VC和花青素含量的变化随汁液流失的增加而降低。由此推断,低温液氮速冻使果实内部水分在短时间内快速冻结,在一定程度上抑制水分发生大规模迁移和内部结构损伤,因而有助于减缓蓝莓营养物质的流失。
2.5 不同冷冻方式对蓝莓细胞膜完整性的影响
当果蔬受到损伤时,细胞膜结构会遭到破坏,膜透过性增高,继而膜内电解质外泄,使得相对电导率升高;MDA是生物细胞膜脂质发生过氧化的产物,会破坏膜结构,增加膜透性,因此,相对电导率和MDA含量可以评判细胞膜完整性和破损程度[28]。如图6所示,冷冻处理后的蓝莓的相对电导率和MDA皆显著升高,且冻结速率越慢上升幅度越大。对比鲜果,RF-80 ℃、LN-80 ℃、LN-100 ℃、LN-120 ℃冷冻蓝莓的相对电导率分别升高71.00%、53.97%、40.92%、32.71%,MDA含量分别增加34.41%、32.13%、28.30%、24.61%,LN-120 ℃组显著低于其他冷冻处理组。有研究表明,冷冻处理对草莓细胞膜透性有显著影响,-80 ℃快速冻结组相对电导率较-18 ℃慢冻组小,细胞破坏程度轻[29]。张晓敏等[20]研究发现,在冷冻过程中加入超声波能够使冷冻速率更快,在一定程度上抑制相对电导率和MDA含量的升高,保护蓝莓果实细胞膜的完整性。上述研究结果与本研究结果一致,说明提高冻结速率有利于保护果实的细胞膜完整性。

图6 不同冷冻方式下的蓝莓果实相对电导率(A)和MDA含量(B)Fig.6 Relative conductivity (A) and MDA content (B) of blueberry fruit under different freezing methods
2.6 不同冷冻方式对蓝莓酶活性的影响
PPO和POD会引起酚类化合物的氧化,造成酚类化合物的降解和果实褐变。研究表明,POD和PPO活性越低,越有利于蓝莓的实际生产[30]。Zhu Zhiwei等[31]研究发现,冷冻后枸杞PPO和POD活性显著降低,因为植物细胞中的PPO和POD以游离和结合状态存在,冷冻可以部分灭活游离态酶,而细胞壁和其他细胞器中的部分结合态酶可以释放从而转化为游离态。如图7所示,经过冷冻处理后的蓝莓的POD和PPO活力并没有降低,与Zhu Zhiwei等[31]的研究结果不同。冷冻后蓝莓的POD和PPO活性均显著高于鲜果。这一趋势与液氮喷雾冷冻板栗的酶活性变化相同,随着冷冻速率的提高,POD和PPO活性逐渐降低[32]。对比鲜果,RF-80 ℃冷冻组的POD和PPO活力分别增加了41.75%和35.23%,而LN-120 ℃组的POD和PPO活力仅增加10.84%和8.81%。这可能是由于较高的冷冻速率生产较小的冰晶,对细胞的损伤较小,这使得酶位于最初的细胞区域内,更好地保护了酶的结构,因此对酶活力影响较小。

图7 不同冷冻方式下的蓝莓果实POD活性(A)和PPO活性(B)Fig.7 POD (A) and PPO (B) activity of blueberry fruit under different freezing methods
2.7 不同冷冻方式对蓝莓微观结构的影响
在冷冻过程中,蓝莓果实内部水分发生相变,冰晶的形成和生长过程中内部水分会发生迁移,果实的内部细胞形态也随之变化[33]。如图8所示,经过冷冻后的蓝莓果实内部细胞结构出现明显变化。蓝莓鲜果的内部组织无明显的变形和断裂,组织结构饱满;RF-80 ℃组的内部组织出现大小不一的孔洞和空隙,结构变形程度比较严重。液氮冷冻组的蓝莓结构同样也出现不同程度的变形,LN-120 ℃组的蓝莓样品无较大孔洞,结构更接近新鲜蓝莓;LN-100 ℃组蓝莓产生一些大小比较接近的孔洞;LN-80 ℃组蓝莓产生大小不一的孔洞且大孔洞居多;LN-120 ℃组样品的内部结构的完整性和紧密性明显优于LN-80 ℃和LN-100 ℃组。经过冷冻处理的蓝莓果实内部结构不可避免地遭到破坏,提高冷冻速率在一定程度上能减轻冷冻对果实细胞结构产生的损伤。这与张方方[34]和Cheng Lina等[16]观察到的趋势一致,冻结速度越快越有利于维持冷冻过程中的细胞结构。
3 结论
本研究以蓝莓的特征玻璃化转变温度Tg′为冻结终点,采用液氮-120 ℃的冷冻条件对蓝莓进行冷冻处理,该条件能够很好地保持冻结蓝莓的品质特性。LN-120 ℃明显缩短了蓝莓的冷冻总时间和通过最大冰晶生成带的时间,提高冷冻速率;该条件下蓝莓的TSS质量分数、TA质量分数、VC含量和花青素含量分别为13.67%、0.90%、30.41 mg/100 g和1.12 ΔOD/g,保留率均在90%以上,能够最大限度地减少蓝莓营养成分的流失;相比于鲜果,相对电导率和MDA含量分别提高了32.71%和24.61%,POD和PPO活力提高了10.84%和8.81%,微观结构的完整性和紧密性与鲜果更接近,可有效减缓蓝莓的膜脂过氧化和组织损伤程度。本研究可为蓝莓速冻加工提供理论支撑和技术参考。

