白花蛇舌草多糖对异烟肼致肝损伤的影响及机制 Δ
庄秀萍 ,李 莉 ,陈 超 ,王丽媛 ,曹广尚 ,周 朋 ,王 信 (.山东中医药大学药学院,济南 5055;.山东中医药大学附属医院儿科,济南 500;.山东中医药大学附属医院药学部,济南 500)
肝损伤是各种肝脏疾病的病理基础,长期肝损伤可导致肝纤维化、肝硬化、肝癌,甚至肝功能衰竭。药物性肝损伤(drug-induced liver injury,DILI)是由化学药物、生物合成药物、天然药物等及其代谢产物引起的肝脏损害,发病率逐年上升,已成为全球肝病死亡的第五大诱因[1―2]。在我国,引起DILI 的药物种类包括非甾体抗炎药、抗结核药、抗肿瘤药等,其中抗结核药导致的肝损伤发生率高达21.99%[3]。异烟肼是WHO推荐的标准抗结核治疗方案中的首选药物,但其在抗结核药中引起的肝损伤最多,发生率约为48%[4]。儿童是结核病的高发人群,异烟肼预防性治疗可使儿童结核潜伏感染发展为活动性结核病的风险降低50%及以上[5],但由于儿童肝脏功能发育不成熟等因素,儿童异烟肼用药诱导产生的肝损伤已成为不容忽视的问题。目前,西医治疗异烟肼致肝损伤大都存在毒副作用大、疗效不理想等问题,而中医药治疗肝损伤具有多层次、多靶点、多途径综合调控的特点,在改善患者症状、降低肝损伤风险、延缓病情进展、增强机体修复能力等方面优势明显[6]。
氧化应激与DILI 的发生发展密切相关[7],沉默信息调节因子1(silent information regulator 1,Sirt1)/核转录因子红系2 相关因子2(nuclear factor-erythroid 2-related factor 2,Nrf2)信号通路是机体重要的抗氧化应激通路,Sirt1激活能促进Nrf2核易位,从而上调血红素加氧酶1(heme oxygenase-1,HO-1)、醌氧化还原酶1(quinone oxidoreductase 1,NQO1)等抗氧化因子的转录与表达,发挥对DILI 的改善作用[8]。白花蛇舌草为茜草科植物白花蛇舌草Hedyotis diffusaWilld.的干燥全草,具有清热解毒、消肿散结之效[9]。白花蛇舌草多糖(polysaccharides fromH. diffusa,HDP)作为其主要成分和重要活性物质,具有抗炎、抗氧化、抗肿瘤、增强免疫等多种药理作用,尤其是显著的抗氧化作用为其在氧化损伤类疾病治疗中的应用提供了有力支撑[10]。本研究基于结核病儿童发病特点及异烟肼用药肝损伤风险,选择生理、发育和代谢与人类高度相似的斑马鱼幼鱼为模型,研究HDP对异烟肼致肝损伤的影响,同时结合人肝L02细胞模型,初步探讨其改善作用机制,旨在为DILI的治疗提供参考。
1 材料
1.1 主要仪器
本研究所用主要仪器包括1260 型高效液相色谱仪(美国Agilent 公司),EP214C 型万分之一电子天平、AB135-S型十万分之一天平(瑞士Mettler Toledo公司),EG1150 型石蜡包埋机、RM2235 型石蜡切片机(德国Leica 公司),KQ-250 型超声波清洗器(昆山市超声仪器有限公司),H1650-W型台式高速离心机(湖南湘仪实验室仪器开发有限公司),SZX16 型荧光显微镜、FSX100型显微镜(日本Olympus 公司),HT7800 型透射电子显微镜(日本Hitachi公司),Fusion FX7型多功能成像系统(法国Vilber公司),CMax Plus型酶标仪(上海美谷分子仪器有限公司),CO2恒温细胞培养箱(上海精宏实验设备有限公司)。
1.2 主要药品与试剂
异烟肼对照品(批号MKBQ8553V,纯度≥99%)购自德国Fluka 公司;白花蛇舌草饮片(批号220602,产地河南确山)购自安徽亿源药业股份有限公司;丙氨酸转氨酶(alanine transaminase,ALT)、天冬氨酸转氨酶(aspartate transaminase,AST)、谷胱甘肽(glutathione,GSH)酶联免疫吸附测定(ELISA)试剂盒和BCA 蛋白测定试剂盒(批号分别为20220412、20211215、20220354、20211224)均购自南京建成生物工程研究所;苏木精-伊红(HE)染色试剂盒(批号20211218)购自北京索莱宝科技有限公司;DMEM 高葡萄糖培养基(批号70090200)购自北京兰杰柯科技有限公司;胎牛血清(批号22020702)购自美国Gibco 公司;CCK-8 检测试剂盒(批号G2026-1000T)购自武汉赛维尔生物科技有限公司;吖啶橙/碘化丙啶(AO/PI)双染试剂盒(批号VD144718)购自北京百奥莱博科技有限公司;兔Sirt1 单克隆抗体、兔Nrf2多克隆抗体、兔HO-1单克隆抗体、兔NQO1单克隆抗体、兔甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphate dehydrogenase,GAPDH)多克隆抗体和辣根过氧化物酶标记的山羊抗兔IgG 二抗(批号分别为ab189494、ab137550、ab189491、ab80588、ab9485、ab150077)均购自英国Abcam公司;甲醇、乙醇等其他试剂均为分析纯;水为娃哈哈纯净水。
1.3 实验动物与细胞
具有肝脏特异性荧光的转基因斑马鱼(L-FABP:EGFP)由齐鲁工业大学生物研究所提供。斑马鱼的养殖繁育参照TheZebrafish Book,操作遵循经济合作与发展组织标准。斑马鱼养殖条件如下:水温(28±0.5)℃,pH 7.0~7.2,电导率450~550 μs/cm,黑暗/光照周期为10 h/14 h,成年斑马鱼每日喂食丰年虾幼虫3 次。斑马鱼胚胎置于斑马鱼胚胎培养液(5 mmol/L NaCl、0.17 mmol/L KCl、0.4 mmol/L CaCl2、0.16 mmol/L MgSO4)中,(28.0±0.5)℃下控光培养,每24 h更换胚胎培养液并及时去除死胚,胚胎密度控制在5枚/mL。
人肝L02细胞(货号SNL-141)购自武汉尚恩生物技术有限公司。
2 方法
2.1 HDP的制备及含量测定
HDP的制备参考文献方法[11]:取1 000 g白花蛇舌草饮片粉碎,以15 倍量的80%乙醇回流脱脂;收集药渣,挥干溶剂后,加10倍量水提取2次,每次2 h;合并滤液,减压浓缩至相对密度约1.015(60 ℃),滤过;滤液过D101型大孔吸附树脂柱,收集药液,减压浓缩至一定体积,采用Savage 法去除蛋白;上清液加入乙醇使醇含量达90%,静置过夜,滤过,沉淀用乙醇洗涤,于60 ℃减压干燥,得HDP。应用苯酚-浓硫酸法测定HDP 的质量分数[12]。
2.2 基于斑马鱼模型评价HDP对异烟肼致肝损伤的保护作用
2.2.1 HDP干预浓度的筛选
斑马鱼胚胎发育3 d 后,选择正常发育的斑马鱼幼鱼,以每孔30 尾置于6 孔板中,随机分为正常组、模型组、HDP 组,每组设3 个复孔。正常组斑马鱼给予胚胎培养液,模型组斑马鱼给予含4 mmol/L异烟肼的胚胎培养液[13],HDP组斑马鱼给予含4 mmol/L异烟肼和不同浓度HDP(800、600、400、200、150、100、50 μg/mL,加胚胎培养液超声处理使溶解)的胚胎培养液。将所有平板置于28 ℃恒温培养箱中孵化,浸浴给药72 h,每24 h 换1次药液。以心脏骤停作为斑马鱼死亡的标准,通过一般形态特征来确定畸变评分。以斑马鱼幼鱼的存活率和畸变率为指标,筛选HDP的干预浓度。
2.2.2 斑马鱼肝脏荧光面积及荧光强度的测定
浸浴给药72 h 后,随机选取“2.2.1”项下正常组、模型组和HDP 低、高浓度组(50、100 μg/mL,根据“2.2.1”项下实验结果选择)斑马鱼幼鱼8尾,在荧光显微镜下观察斑马鱼的局部肝脏形态,使用Image J 软件分析肝脏荧光面积和荧光强度。
2.2.3 斑马鱼肝组织病理学观察
浸浴给药72 h 后,随机选取“2.2.1”项下正常组、模型组和HDP 低、高浓度组(50、100 μg/mL,根据“2.2.1”项下实验结果选择)斑马鱼幼鱼3尾,用4%多聚甲醛和2.5%戊二醛固定。取4%多聚甲醛固定的幼鱼,用分级乙醇脱水,加入二甲苯,石蜡包埋,切片,进行HE 染色,使用显微镜观察组织切片并拍照。取2.5%戊二醛固定的斑马鱼幼鱼,再用1%锇酸固定,用分级丙酮脱水,置包埋液中,固化,超薄切片,用醋酸铀、柠檬酸铅染色,使用透射电子显微镜观察组织切片并拍照。
2.3 基于L02细胞模型研究HDP对异烟肼致肝损伤的保护作用及机制
2.3.1 异烟肼和HDP干预浓度的筛选
将L02细胞按1×104个/孔的密度接种于96孔板中,培养24 h后,分别加入浓度为2、4、6、8、16、32 mmol/L的异烟肼培养24 h,每个浓度设4个复孔,采用CCK-8法检测细胞存活率,具体操作按试剂盒说明书方法进行。以同样方法检测质量浓度分别为1、2、4、8、16、24 mg/mL的HDP处理后的细胞存活率。细胞存活率=(给药组平均光密度值-校准平均光密度值)/(细胞空白对照组平均光密度值-校准平均光密度值)×100%。
2.3.2 HDP对异烟肼致损伤L02细胞存活的影响
按照“2.3.1”项下方法接种、培养细胞24 h,然后分为正常组、模型组和HDP低、高浓度组(2、4 mg/mL),每组设4 个复孔。正常组细胞给予含10%胎牛血清的DMEM 培养基,模型组细胞给予含4 mmol/L 异烟肼的培养基,HDP低、高浓度组细胞分别给予含4 mmol/L异烟肼和相应浓度HDP(2、4 mg/mL)的培养基,培养24 h,采用CCK-8法检测细胞存活率。同法处理细胞后,收集细胞按AO/PI试剂盒说明书方法进行双重染色,使用酶标仪观察细胞存活情况。
2.3.3 HDP对L02细胞上清液中ALT、AST水平及细胞裂解液中GSH含量的影响
将L02细胞以1×106个/孔的密度接种于6孔板中,培养24 h 后,按“2.3.2”项下方法分组、处理,每组设3 个复孔,收集细胞上清液和细胞裂解液,按试剂盒说明书方法分别检测细胞上清液中AST、ALT水平及细胞裂解液中GSH含量。
2.3.4 HDP 对L02 细胞中Sirt1/Nrf2 信号通路相关蛋白表达的影响
采用Western blot 法检测。将“2.3.3”项下各组细胞裂解液与上样缓冲液混合,煮沸变性,电泳分离,转膜,用5%脱脂牛奶封闭后,在4 ℃下分别加入Sirt1、Nrf2、HO-1、NQO1、GAPDH 抗体(稀释比例分别为1∶1 000、1∶1 000、1∶1 000、1∶1 000、1∶2 000),孵育过夜,洗涤3次后,加入二抗(稀释比例为1∶5 000),室温孵育1 h,用ECL试剂进行显影,并用多功能成像系统进行扫描。采用Image J 软件分析蛋白条带灰度值,以目的蛋白条带灰度值与内参蛋白(GAPDH)条带灰度值的比值评价目的蛋白的表达水平。
2.4 统计学处理
采用GraphPad Prism 8.0 软件进行分析。实验数据以±s表示,多组间比较采用单因素方差分析,进一步两两组间比较采用LSD-t检验。检验水准α=0.05。
3 结果
3.1 HDP的提取得率与质量分数
1 000 g白花蛇舌草饮片,可提取获得12.35 g HDP,得率为1.24%;HDP的质量分数为61.47%。
3.2 HDP对异烟肼致斑马鱼肝损伤的保护作用
3.2.1 HDP对斑马鱼存活率和畸变率的影响
HDP质量浓度在150 μg/mL及以上时,斑马鱼的存活率均低于95%,畸变率均高于15%,结果见表1。综合考虑,选择100、50 μg/mL 作为后续斑马鱼实验HDP 的高、低浓度。
表1 不同浓度HDP 对斑马鱼存活率和畸变率的影响(±s,n=3)

表1 不同浓度HDP 对斑马鱼存活率和畸变率的影响(±s,n=3)
组别正常组模型组HDP组药物浓度4 mmol/L异烟肼4 mmol/L异烟肼+800 μg/mL HDP 4 mmol/L异烟肼+600 μg/mL HDP 4 mmol/L异烟肼+400 μg/mL HDP 4 mmol/L异烟肼+200 μg/mL HDP 4 mmol/L异烟肼+150 μg/mL HDP 4 mmol/L异烟肼+100 μg/mL HDP 4 mmol/L异烟肼+50 μg/mL HDP存活率/%100 98.89±1.92 0 21.51±3.85 35.56±1.92 76.87±3.33 94.84±3.84 100 100畸变率/%0 7.85±1.86 100 56.56±3.15 34.70±2.84 18.82±1.74 10.00±3.33 7.78±1.92
3.2.2 HDP对斑马鱼肝脏荧光面积及荧光强度的影响
与正常组比较,模型组斑马鱼肝脏荧光面积和荧光强度均显著减小(P<0.01),说明肝损伤造模成功;与模型组比较,HDP 低、高浓度组斑马鱼肝脏荧光面积均显著增加(P<0.05或P<0.01),HDP高浓度组斑马鱼肝脏荧光强度显著增加(P<0.01)。结果见表2。
表2 各组斑马鱼肝脏荧光面积和荧光强度的测定结果(±s,n=8)
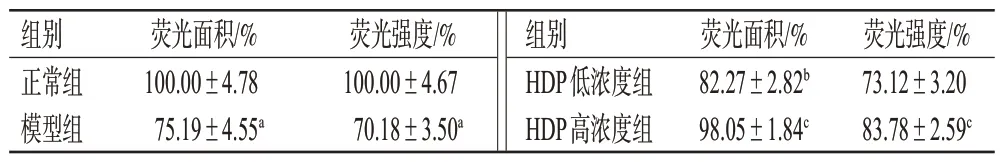
表2 各组斑马鱼肝脏荧光面积和荧光强度的测定结果(±s,n=8)
a:与正常组比较,P<0.01;b:与模型组比较,P<0.05;c:与模型组比较,P<0.01。
组别正常组模型组荧光面积/%100.00±4.78 75.19±4.55a荧光强度/%100.00±4.67 70.18±3.50a组别HDP低浓度组HDP高浓度组荧光面积/%82.27±2.82b 98.05±1.84c荧光强度/%73.12±3.20 83.78±2.59c
3.2.3 HDP对斑马鱼肝组织病理变化的影响
与正常组比较,模型组斑马鱼肝细胞胞浆稀疏、核萎缩、空泡化及炎症细胞聚集,出现明显的肝损伤坏死特征;与模型组比较,HDP低、高浓度组斑马鱼上述肝损伤坏死特征均有不同程度改善。结果见图1。
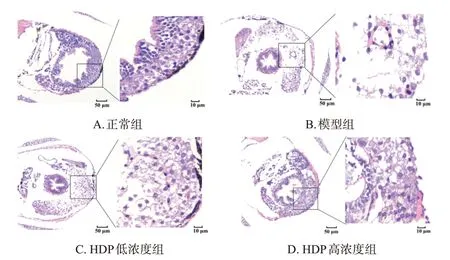
图1 各组斑马鱼肝组织病理变化的显微镜图(HE染色)
3.2.4 HDP对斑马鱼肝组织超微病理变化的影响
与正常组比较,模型组斑马鱼肝细胞核出现萎缩、畸变,线粒体的数量和嵴均明显减少、形状发生扭曲变形;与模型组比较,HDP低、高浓度组斑马鱼肝细胞核和线粒体的病理变化均有不同程度改善,其中HDP高浓度组改善更明显。结果见图2。

红色箭头:细胞核萎缩、畸变;黄色箭头:线粒体的数量和嵴;蓝色箭头:线粒体形状扭曲变形。图2 各组斑马鱼肝组织超微病理变化的显微镜图(醋酸铀、柠檬酸铅染色)
3.3 HDP对异烟肼致L02细胞损伤的保护作用及机制
3.3.1 异烟肼和HDP干预浓度的筛选结果
如图3(A)所示,L02细胞存活率随异烟肼浓度的升高而降低,当异烟肼浓度为4 mmol/L 时,细胞存活率约为80%,满足Western blot 实验提取蛋白的要求,综合考虑选择4 mmol/L 作为异烟肼诱导肝损伤的给药浓度。如图3(B)所示,L02细胞存活率随HDP质量浓度的升高而降低,当HDP 质量浓度大于4 mg/mL 时,细胞存活率低于100%,综合考虑选择2、4 mg/mL 作为HDP 干预的低、高浓度。

图3 异烟肼和HDP对L02细胞存活率的影响
3.3.2 L02细胞存活率的测定结果
与正常组比较,模型组L02 细胞存活率显著降低(P<0.01);与模型组比较,HDP 低、高浓度组L02 细胞存活率均显著升高(P<0.05或P<0.01)。结果见图4。

a:与正常组比较,P<0.01;b:与模型组比较,P<0.05;c:与模型组比较,P<0.01。图4 各组L02细胞存活率的测定结果(±s,n=4)
3.3.3 L02细胞存活情况的染色结果
AO 可透过正常细胞膜,使细胞核呈绿色或黄绿色均匀荧光;PI无膜通透性,不能透过活细胞膜,只能进入损伤的细胞及死细胞,呈红色荧光。如图5所示,正常组视野以绿色荧光的活细胞为主;与正常组比较,模型组呈绿色荧光的活细胞数量明显减少,呈红色荧光的损伤或死亡细胞数量明显增加;与模型组比较,HDP低、高浓度组呈绿色荧光的活细胞数量均明显增加,呈红色荧光的损伤或死亡细胞数量均明显减少。

图5 各组L02细胞存活情况AO/PI荧光染色图
3.3.4 L02 细胞上清液中AST、ALT 水平及细胞裂解液中GSH含量的测定结果
与正常组比较,模型组L02 细胞上清液中AST 和ALT 水平均显著升高(P<0.01),细胞裂解液中GSH 含量显著降低(P<0.01)。与模型组比较,HDP 低浓度组L02 细胞上清液中AST 水平显著降低(P<0.05);HDP高浓度组L02细胞上清液中AST、ALT水平均显著降低(P<0.05),细胞裂解液中GSH 含量显著升高(P<0.01)。结果见图6。

a:与正常组比较,P<0.01;b:与模型组比较,P<0.05;c:与模型组比较,P<0.01。图6 各组L02 细胞上清液中AST、ALT 水平及细胞裂解液中GSH含量的测定结果(±s,n=3)
3.3.5 L02 细胞中Sirt1/Nrf2 信号通路相关蛋白表达的测定结果
与正常组比较,模型组L02 细胞中Sirt1、NQO1、HO-1 蛋白表达水平均显著降低(P<0.05 或P<0.01),Nrf2 蛋白表达水平有升高趋势,但差异无统计学意义(P>0.05);与模型组比较,HDP 低浓度组L02 细胞中Nrf2、NQO1 蛋白表达水平均显著升高(P<0.05),HDP高浓度组L02 细胞中Sirt1、Nrf2、NQO1、HO-1 蛋白表达水平均显著升高(P<0.05 或P<0.01)。结果见图7、图8。

图7 各组L02细胞中Sirt1、Nrf2、NQO1、HO-1蛋白表达的电泳图
4 讨论
异烟肼诱导的肝损伤与线粒体呼吸链酶活性抑制、通透性转化孔持续开放、动力学失衡等功能障碍密切相关,其可导致线粒体膜通透性增加、肿胀畸形、数量减少、嵴密度降低等[6],这与本研究结果一致。HDP能显著改善异烟肼诱导的斑马鱼肝组织病理变化,尤其是对线粒体形态、嵴密度等有较好的恢复作用,提示HDP 对肝损伤的改善作用可能与调控线粒体功能相关。后期本研究团队将进一步探讨HDP对线粒体功能的影响。
异烟肼可诱导氧化还原蛋白Nrf2核外表达积累,抑制Nrf2 入核,导致肝细胞抗氧化能力降低而发生损伤,故氧化应激是异烟肼致肝损伤的重要因素[14]。Sirt1 作为细胞氧化还原状态的传感器和氧化应激的保护器,可增加下游Nrf2靶基因的转录活性并上调其蛋白表达,促进Nrf2核易位及下游抗氧化因子GSH、HO-1等表达,提高机体抗氧化能力,在肝损伤氧化应激反应中发挥重要作用。研究表明,激活Sirt1/Nrf2 信号通路可保护细胞避免氧化应激诱导的损伤进而改善胆汁淤积肝损伤[7];Sirt1可通过增加Nrf2核移位提高机体抗氧防御能力,对四氯化碳、对乙酰氨基酚诱导的肝损伤产生良好的保护作用[15]。本研究结果表明,与正常组比较,模型组L02细胞中Nrf2蛋白表达水平有升高趋势,Sirt1、NQO1、HO-1蛋白表达水平均显著降低,这可能是肝损伤过程中导致的Nrf2 代偿性增加;而HDP 可显著提高L02 细胞中Sirt1、Nrf2、NQO1、HO-1 蛋白表达水平,提示HDP 可能通过激活Sirt1/Nrf2信号通路,提高抗氧化能力,发挥对异烟肼致肝损伤的改善作用。
综上所述,HDP对异烟肼诱导的肝损伤具有一定的改善作用,其机制可能与激活Sirt1/Nrf2信号通路、改善线粒体功能、提高抗氧化能力相关。后期本研究团队将进一步对HDP成分的分离纯化、构效评价、作用靶点等方面进行深入研究,旨在为HDP的综合开发利用提供支撑。

