大豆异黄酮对幼年小鼠生殖发育的影响 Δ
许文达,董思林,张 晗,宋迎琳,迟镜仪,赵振军,石 慧 (烟台大学生命科学学院,山东 烟台 264005)
大豆异黄酮(soybean isoflavones,SI)主要存在于豆科植物中,是通过苯丙醇途径合成的一种具有较强生物活性的重要次生代谢物[1]。由于饮食结构的差异,亚洲人群SI 摄入量明显高于欧美人群[2]。研究表明,SI 对人体健康有积极作用,具有缓解骨质疏松症[3]、预防心血管疾病[4]、调节血脂[5]和抗氧化、抗炎、抗肿瘤、提高免疫[6]等活性,并可影响子宫内膜细胞和颗粒细胞的增殖与凋亡[7]。
近年来,随着“内分泌干扰物”概念的引入,人们对激素有了进一步的认识[8]。SI作为一种激素类内分泌干扰物,若长期、大剂量摄入是否会产生副作用,目前尚无定论。探索性研究发现,SI可能会破坏生殖内分泌系统的平衡,甚至影响机体的发育和生殖功能[9]。幼年期为生长发育的重要阶段,是生殖功能发育和成熟的关键时期,容易受到内外因素的影响。有研究指出,长期饲喂同为内分泌干扰物的果糖可改变机体脂质代谢和激素水平,进而影响生殖功能[10];此外有研究证实,胎儿和新生儿期SI 暴露与小鼠成年后生殖系统疾病的发生有关[8]。因此,本研究拟观察不同剂量SI 对幼年小鼠生殖发育的影响,旨在为其安全性评估提供实验参考。
1 材料
1.1 主要仪器
本研究所用主要仪器包括820 型组织切片机(美国Reichert-Jung 公司)、Ti-S 型双端口倒置荧光显微镜(日本Nikon 公司)、DM1000 LED 型生物光学显微镜(德国Leica公司)、SpectraMax iD3型多功能酶标仪[美谷分子仪器(上海)有限公司]、DHG-9140A型烘箱(上海一恒科学仪器有限公司)等。
1.2 主要药品与试剂
SI 原料药(批号C12916812,纯度40%)购自上海麦克林生化科技有限公司;吐温80(批号M25HS179460)和甘油(分析纯)均购自上海源叶生物科技有限公司;Davidson’s 固定液(批号20140210)购自北京索莱宝科技有限公司;苏木精-伊红(HE)染色试剂盒(批号011623230614)、一步法TUNEL 细胞凋亡检测试剂盒(批号112822230321)均购自上海碧云天生物技术股份有限公司;睾酮检测(干粉法)试剂盒(批号20230605)、雌二醇检测(干粉法)试剂盒(批号20230605)、谷胱甘肽过氧化物酶(glutathione peroxidase,GSH-Px)检测试剂盒(批号20220530)、超氧化物歧化酶(superoxide dismutase,SOD)检测试剂盒(批号20220530)、微量丙二醛(malondialdehyde,MDA)检测试剂盒(批号20220530)、总抗氧化能力(total antioxidant capacity,T-AOC)检测试剂盒(批号20220530)均购自南京建成生物工程研究所。
1.3 实验动物
SPF级C57BL/6幼鼠30只(2周龄,体重8~10 g,雌雄各半),购自济南朋悦实验动物繁育有限公司,动物生产许可证号为SCXK(鲁)2019 0003。小鼠分笼饲养并自由进食、饮水,饲养条件为每12 h明暗交替、室温16~25 ℃、相对湿度45%~60%。本研究实验方案经烟台大学动物伦理委员会审查批准(编号YTU20210203-2)。
2 方法
2.1 分组与给药
取幼鼠30 只,适应性喂养3 d 后随机分为对照组(1%吐温80溶液)和SI小、大剂量组(10、100 mg/kg),每组10只,雌雄各半。各组幼鼠雌雄分开饲养,以耳钉标号区分。对照组幼鼠灌胃1%吐温80溶液,SI各剂量组幼鼠灌胃相应药液(以1%吐温80 溶液为溶剂,剂量参考相关文献[11―12]设置),每天15:00灌胃1次,持续2周。
2.2 体重测定
于每天灌胃前及末次灌胃后称定各组幼鼠体重,并按下式计算体重增长百分比:体重增长百分比=(末次灌胃后幼鼠体重-首次灌胃前幼鼠体重)/首次灌胃前幼鼠体重×100%。
2.3 血清性激素水平测定
末次给药后,幼鼠禁食不禁水3 h,于眼眶静脉丛采血,血样于室温下静置20 min 后,以3 000 r/min 离心15 min,取上层血清适量,严格按照相应试剂盒说明书操作,使用酶标仪检测血清中雌二醇和睾酮水平。
2.4 生殖器官氧化应激指标检测
取血后,各组幼鼠以颈椎脱臼法处死,分别分离雌性幼鼠的卵巢组织和雄性幼鼠的睾丸组织。取上述组织适量,称重后加生理盐水,制成10%匀浆液,以3 000 r/min 离心10 min,分离上清液,严格按照相应试剂盒说明书操作,使用酶标仪检测上述组织匀浆中SOD、GSHPx活性,MDA含量和T-AOC。
2.5 生殖器官病理学观察
取各组雌性幼鼠卵巢组织和雄性幼鼠睾丸、附睾组织适量,置于固定液中,于室温下固定48 h 后,进行脱水、透明、浸蜡、包埋、切片,经HE染色后,使用光学显微镜观察并随机选取每张切片的6个视野拍照,记录各组幼鼠上述组织的病理变化。
2.6 生殖器官细胞凋亡检测
取“2.5”项下各组雌性幼鼠卵巢组织和雄性幼鼠睾丸、附睾组织的石蜡切片,脱蜡后滴加不含DNA酶的蛋白酶K(20 μg/mL)适量,于37 ℃下孵育15 min;以磷酸盐缓冲液(PBS)清洗3次后,加TUNEL检测液50 μL,于37 ℃下避光孵育1 h;以PBS清洗3次,用抗荧光淬灭封片液封片后使用荧光显微镜观察。随机选取每张切片的5个视野观察并拍照,使用Image J软件记录视野内的凋亡阳性细胞(呈绿色荧光)数量及细胞总数,并计算凋亡率:凋亡率=凋亡阳性细胞数量/细胞总数×100%。
2.7 统计学方法
3 结果
3.1 幼鼠体重增长情况
雌性幼鼠的体重增长百分比有随SI 剂量增大而逐渐升高的趋势,其中SI 大剂量组显著高于对照组(P<0.05);雄性幼鼠的体重增长百分比有随SI 剂量增大而逐渐下降的趋势,其中SI大剂量组显著低于对照组(P<0.01)。结果见图1。
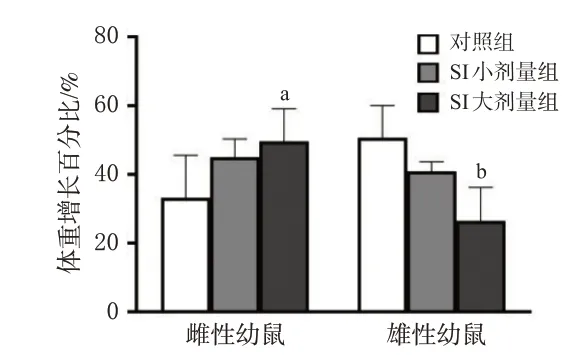
a:与对照组比较P<0.05;b:与对照组比较P<0.01。图1 SI对幼鼠体重增长百分比的影响(±s,n=5)
3.2 幼鼠血清中性激素水平
与对照组比较,SI各剂量组雌性幼鼠的血清睾酮水平和雄性幼鼠的血清睾酮、雌二醇水平均显著升高(P<0.05),而雌性幼鼠的血清雌二醇水平均显著降低(P<0.05)。结果见表1。
表1 SI 对幼鼠血清中性激素水平的影响(±s,n=5,pg/mL)

表1 SI 对幼鼠血清中性激素水平的影响(±s,n=5,pg/mL)
a:与对照组比较,P<0.05。
组别对照组SI小剂量组SI大剂量组雌性幼鼠睾酮62.56±2.42 206.28±2.20a 204.71±1.56a雌二醇23.92±0.15 16.50±0.03a 16.20±0.41a雄性幼鼠睾酮216.87±2.08 669.19±5.61a 495.48±4.97a雌二醇13.83±0.09 15.70±0.15a 14.12±0.11a
3.3 幼鼠生殖器官组织中氧化应激指标水平
与对照组比较,SI 大剂量组雌性幼鼠卵巢组织中SOD 活性和SI 小、大剂量组雌性幼鼠卵巢组织中MDA含量均显著降低,SI 小剂量组雌性幼鼠卵巢组织中GSH-Px 活性和SI 小、大剂量组雌性幼鼠卵巢组织中TAOC 均显著升高(P<0.01),而SI 各剂量组雄性幼鼠睾丸组织中上述指标与对照组比较差异均无统计学意义(P>0.05)。结果见表2、表3。
表2 SI 对幼鼠卵巢组织中氧化应激指标水平的影响(±s,n=5)

表2 SI 对幼鼠卵巢组织中氧化应激指标水平的影响(±s,n=5)
a:与对照组比较,P<0.01。
组别对照组SI小剂量组SI大剂量组SOD/(U/mg)11.11±1.00 13.32±17.11 2.79±1.43a GSH-Px/(U/mg)422.90±65.90 961.55±805.57a 453.37±147.96 T-AOC/(mmol/L)0.14±0.01 0.52±0.01a 0.53±0.01a MDA/(nmol/mg)10.12±6.23 1.63±1.16a 2.39±1.08a
表3 SI 对幼鼠睾丸组织中氧化应激指标水平的影响(±s,n=5)
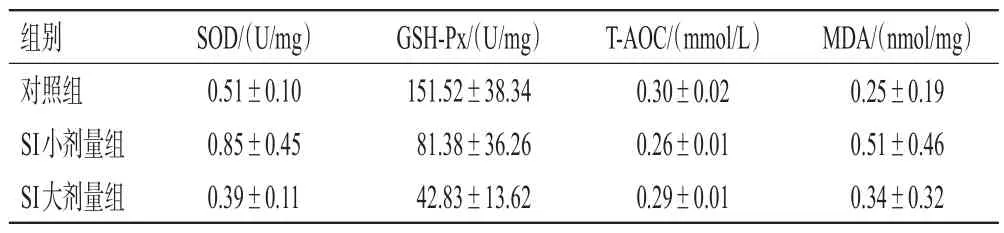
表3 SI 对幼鼠睾丸组织中氧化应激指标水平的影响(±s,n=5)
组别对照组SI小剂量组SI大剂量组SOD/(U/mg)0.51±0.10 0.85±0.45 0.39±0.11 GSH-Px/(U/mg)151.52±38.34 81.38±36.26 42.83±13.62 T-AOC/(mmol/L)0.30±0.02 0.26±0.01 0.29±0.01 MDA/(nmol/mg)0.25±0.19 0.51±0.46 0.34±0.32
3.4 幼鼠生殖器官组织病理变化情况
对照组雌性幼鼠卵巢组织中可见多层立方颗粒细胞和内含液体的窦卵泡;SI小剂量组雌性幼鼠卵巢组织中可见发育良好的囊性卵泡,并可见一层厚且有序、形状完整的颗粒细胞,而SI 大剂量组囊性卵泡更大,卵泡膜向卵泡腔内塌陷,出现明显白体。结果见图2。

黑色箭头:窦卵泡;蓝色箭头:囊性卵泡;红色箭头:白体。图2 SI 对雌性幼鼠卵巢组织病理形态影响的显微图(HE染色)
对照组雄性幼鼠睾丸组织中各级生精细胞和附睾组织中上皮细胞均排列紧密有序。SI小、大剂量组雄性幼鼠睾丸组织中部分生精细胞脱落,各级精母细胞排列较为松散;附睾组织中上皮细胞皱缩、排列松散,且部分上皮细胞脱落。结果见图3、图4。

黑色箭头:精母细胞;蓝色箭头:支持细胞;红色箭头:长形精子。图3 SI 对雄性幼鼠睾丸组织病理形态影响的显微图(HE染色)
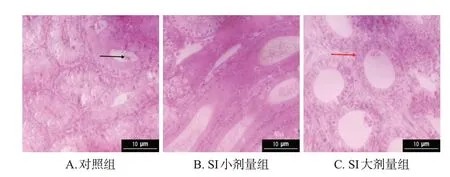
黑色箭头:脱落的上皮细胞团;红色箭头:尾部的上皮细胞。图4 SI 对雄性幼鼠附睾组织病理形态影响的显微图(HE染色)
3.5 幼鼠生殖器官细胞凋亡情况
与对照组比较,SI各剂量组雌性幼鼠卵巢组织中凋亡阳性细胞有所减少,细胞凋亡率均显著降低(P<0.05);而SI 各剂量组雄性幼鼠睾丸及附睾组织中凋亡阳性细胞均有所增加,细胞凋亡率均显著升高(P<0.05)。结果见图5、表4。
表4 SI对幼鼠生殖器官组织细胞凋亡率的影响(±s,n=5,%)

表4 SI对幼鼠生殖器官组织细胞凋亡率的影响(±s,n=5,%)
a:与对照组比较,P<0.05。
组别对照组SI小剂量组SI大剂量组卵巢组织22.90±0.42 6.20±3.11a 5.92±1.81a睾丸组织3.06±0.28 14.40±9.44a 25.02±3.95a附睾组织15.50±14.85 67.10±27.01a 86.60±4.53a

图5 SI 对幼鼠生殖器官组织细胞凋亡影响的显微图(TUNEL染色)
4 讨论
SI对成年个体的有益作用已得到了初步证实,但随着人们对内分泌干扰物认识的不断深入,作为内分泌干扰物的SI 对幼年个体生殖发育是否绝对有益,仍值得探讨。
本研究首先考察了SI 对幼鼠体重的影响,结果显示,SI 对雌性幼鼠的体重增长有促进作用,但对雄性幼鼠的体重增长有抑制作用。随后,本研究通过检测幼鼠生殖器官组织细胞凋亡率、氧化应激指标和观察其生殖器官组织病理改变情况发现,SI可显著提高雌性幼鼠卵巢组织中GSH-Px活性(小剂量)和T-AOC(小、大剂量),并可显著降低MDA 含量(小、大剂量)和细胞凋亡率(小、大剂量),提示该成分可提高雌性幼鼠卵巢组织的抗氧化应激能力,减轻卵巢组织的氧化应激损伤并减少细胞凋亡,可见SI对雌性幼鼠的卵巢组织具有一定的保护作用,与赵洪强等[13]的研究结果基本一致,即SI 具有保护卵巢的作用,可修复外界毒性物质所导致的氧化应激损伤。需要注意的是,从病理观察结果来看,SI 各剂量组雌性幼鼠卵巢组织均可见囊性卵泡,但是否会对其生殖发育产生影响,尚需进一步确认。同时,本研究结果显示,SI对雄性幼鼠生殖器官的抗氧化应激能力并无明显改善,且睾丸及附睾组织的细胞凋亡率均较对照组显著升高,并伴有明显的细胞脱落现象。SI属于低毒性物质,当短期内少量摄入时,该成分可在10~14 h 内被完全排出体外;同时,SI 具有蓄积毒性,即长期服用后,蓄积的SI 可能对机体各组织器官产生危害[14]。本研究结果初步显示,持续2周摄入SI对雄性幼鼠睾丸及附睾组织具有一定的蓄积毒性。
为分析SI生殖毒性的产生原因,本研究还检测了雌雄幼鼠的血清性激素水平。结果显示,SI各剂量组雌性幼鼠血清睾酮水平均显著升高,雌二醇水平均显著降低;而SI 各剂量组雄性幼鼠血清睾酮、雌二醇水平均显著升高,与王文祥等[15]的研究结果基本一致。笔者推测,SI对雌雄幼鼠生殖器官的不同影响可能与其对小鼠血清性激素水平的影响差异有关,但具体机制还有待于进一步探索。
综上所述,SI可提高雌性幼鼠卵巢组织的抗氧化应激能力,减少其氧化应激损伤,但对雄性幼鼠的生殖器官具有一定的蓄积毒性。

