黄芪多糖对腹膜透析大鼠腹膜纤维化和血管生成的影响及机制 Δ
冯 雪,彭 斌,冯 立,朱双益,胡 溪,熊 玮,高 智 (武汉市中医医院肾病科,武汉 430014)
腹膜透析(peritoneal dialysis,PD)常用于终末期肾病的治疗,全球有11%~15%的终末期肾病患者接受PD治疗,在中国接受PD的人群也在逐年增多[1]。PD的前提是腹膜功能具有完整性,但是随着PD 治疗时间的延长,非生理性透析液长期使用,使得患者腹膜通透性随之增加,腹膜超滤功能随之衰竭,最终导致PD治疗失败。其中超滤功能衰竭是终末期肾病患者PD治疗失败的主要原因,而腹膜纤维化及腹膜血管新生在其发生过程中起着重要作用[2]。低氧诱导因子1α(hypoxia-inducible factor-1α,HIF-1α)/血管内皮生长因子(vascular endothelial growth factor,VEGF)信号通路参与器官组织纤维化及血管生成进程,抑制HIF-1α/VEGF信号通路可以抑制肾小管上皮细胞凋亡,从而抑制肾脏纤维化[3]。由此推测,HIF-1α/VEGF信号通路也可能参与腹膜纤维化进程。
黄芪多糖(Astragaluspolysaccharide,APS)是黄芪的主要活性成分,具有抗炎、抗氧化等作用,可以减轻大鼠肾组织的炎症反应,改善肾组织纤维化程度[4],但其具体机制尚不明确。有研究显示,APS 可通过抑制HIF-1α、VEGF表达,减少肺小动脉胶原纤维沉积面积,改善低氧诱导的肺动脉高压小鼠肺血管重构[5]。基于此,本研究考察了APS对PD大鼠腹膜纤维化和血管生成的影响,并基于HIF-1α/VEGF 信号通路研究其作用机制,以期为PD的治疗提供理论依据。
1 材料
1.1 主要仪器
本研究所使用的主要仪器包括TBA-2000FR 型全自动生化分析仪(日本Toshiba 公司)、BX51 型显微镜(日本Olympus公司)等。
1.2 主要药品与试剂
APS对照品(批号R014309-100g,纯度70%)购自上海易恩化学技术有限公司;HIF-1α激动剂二甲基乙二酰氨基乙酸(DMOG,货号HY-15893,纯度99.77%)购自美国MCE公司;PD液(含2.5%葡萄糖)购自广州百特医疗用品有限公司;苏木精-伊红(HE)染色试剂盒(批号20200115)购自北京索莱宝科技有限公司;血清肌酐(serum creatinine,Scr)、尿素氮(blood urea nitrogen,BUN)试剂盒(批号分别为YS04392B、YS06475B)均购自上海雅吉生物科技有限公司;Masson 试剂盒(批号HR8326-EIM)购自北京百奥莱博科技有限公司;兔源α-平滑肌肌动蛋白(α-smooth muscle actin,α-SMA)单克隆抗体(批号19245)购自美国CST公司;兔源HIF-1α、VEGF单克隆抗体(批号分别为sc-13515、sc-7269)均购自美国Santa Cruz 公司;兔源层粘连蛋白(laminin,LN)单克隆抗体(批号LM-0821R)购自上海联迈生物工程有限公司;兔源甘油醛-3-磷酸脱氢酶(GAPDH)、血小板内皮细胞黏附分子1(又称CD31)单克隆抗体和辣根过氧化物酶标记的山羊抗兔IgG(H&L)二抗(批号分别为ab181602、ab182981、ab6702)均购自英国Abcam公司。
1.3 实验动物
SPF级SD雄性大鼠65只,体重200~250 g,购自湖北贝恩特生物科技有限公司,生产许可证号为SCXK(鄂)2021-0027。大鼠饲养环境:温度22~24 ℃,相对湿度50%~60%,正常光照,自由摄食饮水。本研究已获得武汉华联科生物技术有限公司动物伦理委员会审批,伦理批件号为HLK-202203213。
2 方法
2.1 分组、建模与给药
大鼠适应性喂养1 周后,取12 只作为正常对照组(Control组),其他53只进行造模处理:行5/6肾切除术,术后1 周检测Scr 和BUN 水平显著高于正常大鼠后,在大鼠右下腹靠近腹股沟中点处腹腔注射1.5%PD 液100 mL/(kg·d),构建PD大鼠模型,以PD管冲洗通畅判定为PD 造模成功[6]。正常大鼠腹腔注射等体积生理盐水。造模期间,大鼠死亡5只。将48只造模成功的大鼠随机分为模型组(PD 组)、70 mg/kg APS 组(APS-L 组)、140 mg/kg APS 组(APS-H 组)、140 mg/kg APS+40 mg/kg DMOG 组(APS-H+DMOG 组)[7―8],每组12 只。各给药组大鼠腹腔注射PD液同时灌胃相应剂量的APS及腹腔注射相应剂量的DMOG,Control组和PD 组大鼠灌胃等体积生理盐水。每天给药1次,连续4周。
2.2 腹膜功能检测
各组大鼠末次给药后,腹腔注射4.25%葡萄糖PD液25 mL,取0、4 h大鼠尾静脉血,测定血液中葡萄糖浓度。4 h后麻醉大鼠处死,抽吸腹腔液体计量,再打开腹腔,称量干净纱布质量,再用纱布收集腹腔内未抽净的液体计量。按下式计算大鼠腹膜超滤量(peritoneal ultrafiltration,UF)和葡萄糖转运量(mass transfer of glucose,MTG):UG=(纱布吸水后的质量-纱布的质量)×1 mL/g+腹腔抽吸量-腹腔注射量;MTG=(0 h葡萄糖浓度×PD 液注入体积)-(4 h 葡萄糖浓度×PD 液注入体积)[9]。
2.3 血清中Scr和BUN水平检测
取“2.2”项下麻醉处死前各组大鼠眼眶后静脉丛血,离心后取上清液,按试剂盒说明书方法操作,使用全自动生化分析仪检测血清中Scr和BUN水平。
2.4 腹膜组织病理学观察
每组取6只大鼠的腹膜组织,用4%多聚甲醛固定,制作石蜡切片。石蜡切片行HE 染色,封片后使用显微镜观察各组大鼠腹膜组织病理变化。石蜡切片行Masson 染色,封片后使用光学显微镜观察各组大鼠腹膜组织纤维化变化;每个切片随机选择5个视野计算腹膜厚度及胶原纤维沉积占比。
2.5 腹膜组织微血管密度及α-SMA、LN蛋白表达检测
取“2.4”项下石蜡切片,脱蜡复水后,加入CD31、α-SMA、LN一抗(稀释比例分别为1∶50、1∶1 000、1∶500),4 ℃孵育;随后加入二抗(稀释比例为1∶2 000),室温孵育,行DAB、苏木精染色,漂洗后,干燥封片,使用显微镜观察并采集图片。显微镜下观察CD31的染色情况并计数被染色的阳性微血管数,以5个视野阳性微血管数的均值为微血管密度。使用Image J 软件分析,以光密度值表示α-SMA、LN蛋白的表达水平。
2.6 腹膜组织中HIF-1α/VEGF信号通路相关蛋白检测
取各组剩余6只大鼠的腹膜组织,研磨后离心,取上清液,检测蛋白浓度,煮沸变性,电泳分离,转膜,封闭,加入HIF-1α、VEGF、GAPDH 一抗(稀释比例分别为1∶500、1∶500、1∶1 000),4 ℃孵育;加入二抗(稀释比例为1∶2 000),室温孵育,再加入ECL 共孵育,曝光显影。使用Image J 软件采集图像并分析条带灰度值,以目的蛋白与内参蛋白(GAPDH)的灰度值比值表示目的蛋白的表达水平。
2.7 统计学处理
3 结果
3.1 APS对大鼠腹膜UF和MTG的影响
与Control 组比较,PD 组大鼠腹膜UF 显著降低,MTG 显著升高(P<0.05);与PD 组比较,APS-L 组、APS-H 组大鼠腹膜UF 均显著升高,MTG 均显著降低(P<0.05),且APS-H 组改善效果优于APS-L 组(P<0.05);与APS-H 组比较,APS-H+DMOG 组大鼠腹膜UF显著降低,MTG显著升高(P<0.05)。结果见表1。
表1 各组大鼠腹膜UF 和MTG 的检测结果(±s,n=12)
a:与Control组比较,P<0.05;b:与PD组比较,P<0.05;c:与APS-L组比较,P<0.05;d:与APS-H组比较,P<0.05。
组别Control组PD组APS-L组APS-H组APS-H+DMOG组UF/mL 16.35±1.85 5.16±0.74a 8.74±0.93b 14.65±1.54bc 10.67±1.16d MTG/(mmoL/kg)11.23±1.20 20.56±2.13a 17.38±1.82b 12.24±1.25bc 16.54±1.71d
3.2 APS对大鼠血清中Scr和BUN水平的影响
与Control 组比较,PD 组大鼠血清中Scr 和BUN 水平均显著升高(P<0.05);与PD组比较,APS-L组、APSH组大鼠血清中Scr和BUN水平均显著降低(P<0.05),且APS-H 组改善效果优于APS-L 组(P<0.05);与APSH 组比较,APS-H+DMOG 组大鼠血清中Scr 和BUN 水平均显著升高(P<0.05)。结果见表2。
表2 各组大鼠血清中Scr和BUN水平的检测结果(±s,n=12)

表2 各组大鼠血清中Scr和BUN水平的检测结果(±s,n=12)
a:与Control组比较,P<0.05;b:与PD组比较,P<0.05;c:与APS-L组比较,P<0.05;d:与APS-H组比较,P<0.05。
组别Control组PD组APS-L组APS-H组APS-H+DMOG组Scr/(μmol/L)30.22±2.76 86.74±7.64a 62.17±5.51b 38.52±3.12bc 55.31±4.83d BUN/(mmol/L)4.32±0.33 9.76±0.89a 7.34±0.63b 5.16±0.46bc 6.45±0.57d
3.3 APS对大鼠腹膜组织病理变化的影响
Control 组大鼠腹膜组织间皮细胞排列整齐、紧密;与Control 组比较,PD 组大鼠腹膜组织结构松散,腹膜间皮细胞脱落,腹膜层及间皮下基质增厚,大量成纤维样细胞及单核、巨噬细胞浸润,纤维素样物质沉积;与PD 组比较,APS-L 组、APS-H 组大鼠只有少部分腹膜间皮细胞排列不整齐并有脱落,腹膜组织腹膜层及间皮下基质增厚减少,细胞浸润减少;与APS-H 组比较,APS-H+DMOG 组大鼠腹膜组织松散,间皮细胞脱落增多,腹膜层及间皮下基质增厚,细胞浸润增多。结果见图1。
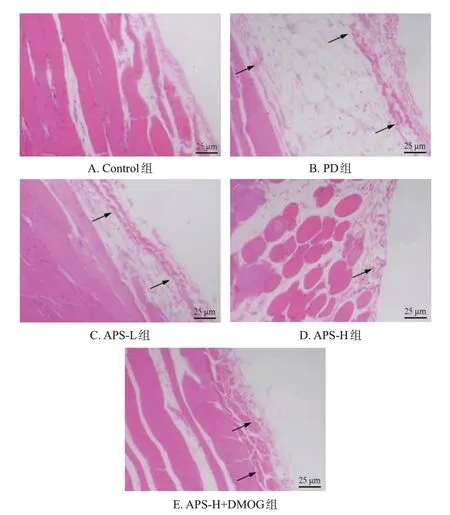
→:病变部位。图1 各组大鼠腹膜组织病理形态显微镜图(HE染色)
3.4 APS对大鼠腹膜组织纤维化的影响
与Control 组比较,PD 组大鼠腹膜厚度和胶原纤维沉积占比均显著增加(P<0.05);与PD 组比较,APS-L组、APS-H组大鼠腹膜厚度和胶原纤维沉积占比均显著减少(P<0.05),且APS-H 组改善效果优于APS-L 组(P<0.05);与APS-H 组比较,APS-H+DMOG 组大鼠腹膜厚度和胶原纤维沉积占比均显著增加(P<0.05)。结果见图2和表3。

→:胶原纤维沉积。图2 各组大鼠腹膜组织纤维化显微图(Masson染色)
表3 各组大鼠腹膜厚度、胶原纤维沉积占比的检测结果(±s,n=6)

表3 各组大鼠腹膜厚度、胶原纤维沉积占比的检测结果(±s,n=6)
a:与Control组比较,P<0.05;b:与PD组比较,P<0.05;c:与APS-L组比较,P<0.05;d:与APS-H组比较,P<0.05。
组别Control组PD组APS-L组APS-H组APS-H+DMOG组腹膜厚度/μm 8.67±0.92 36.68±3.27a 28.32±2.33b 16.34±1.49bc 26.17±2.21d胶原纤维沉积占比/%0.17±0.02 0.85±0.09a 0.61±0.06b 0.26±0.03bc 0.52±0.05d
3.5 APS对大鼠腹膜组织微血管密度的影响
与Control 组比较,PD 组大鼠腹膜组织微血管密度显著升高(P<0.05);与PD 组比较,APS-L 组、APS-H 组大鼠腹膜组织微血管密度均显著降低(P<0.05),且APS-H 组改善效果优于APS-L 组(P<0.05);与APS-H组比较,APS-H+DMOG 组大鼠腹膜组织微血管密度显著升高(P<0.05)。结果见图3和表4。
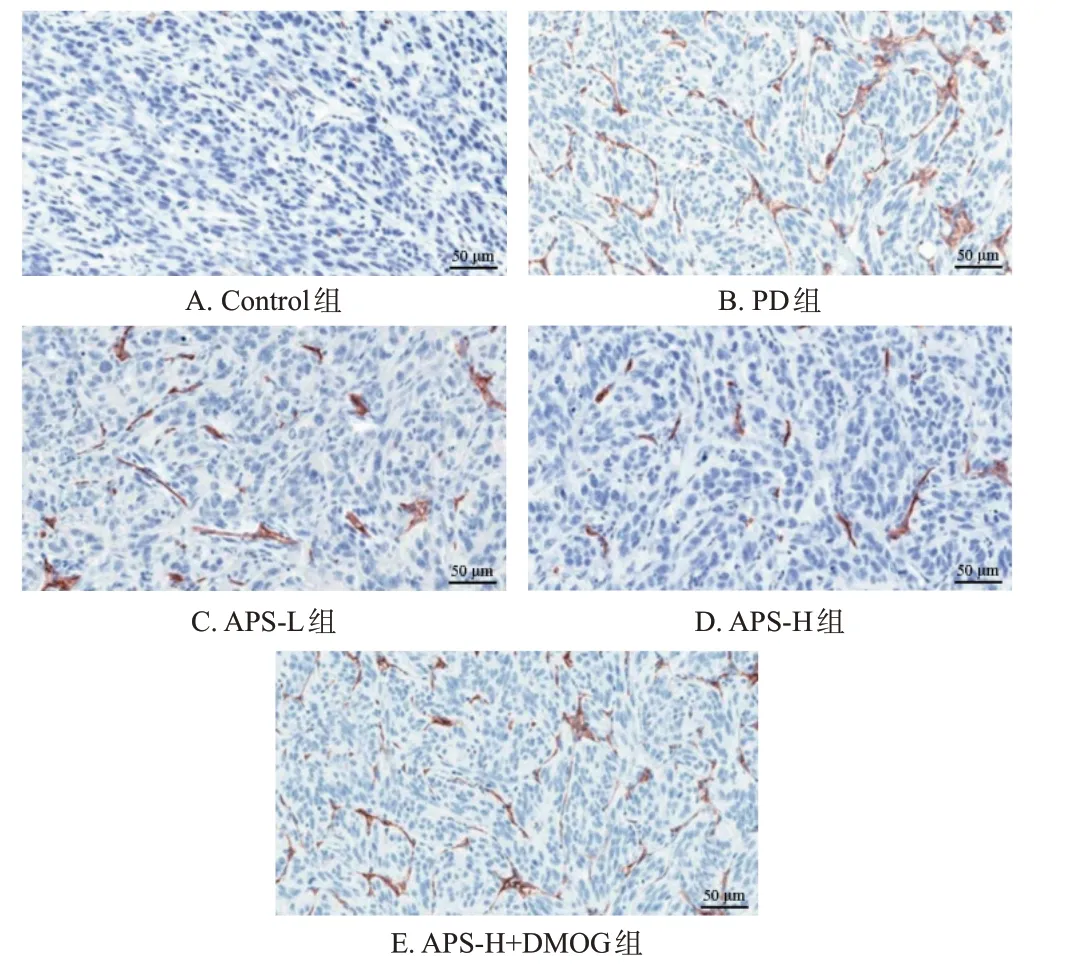
图3 各组大鼠腹膜组织微血管的显微镜图(免疫组化染色)
表4 各组大鼠腹膜组织微血管密度和α-SMA、LN 蛋白表达的检测结果(±s,n=6)

表4 各组大鼠腹膜组织微血管密度和α-SMA、LN 蛋白表达的检测结果(±s,n=6)
a:与Control组比较,P<0.05;b:与PD组比较,P<0.05;c:与APS-L组比较,P<0.05;d:与APS-H组比较,P<0.05。
组别Control组PD组APS-L组APS-H组APS-H+DMOG组微血管密度/(个/视野)0 15.50±7.32a 11.17±5.21b 6.33±3.17bc 13.83±6.19d α-SMA光密度值0.036±0.004 0.089±0.009a 0.066±0.007b 0.043±0.004bc 0.059±0.006d LN光密度值0.021±0.002 0.076±0.008a 0.059±0.006b 0.032±0.003bc 0.047±0.005d
3.6 APS 对大鼠腹膜组织中α-SMA、LN 蛋白表达的影响
与Control 组比较,PD 组大鼠腹膜组织中α-SMA、LN蛋白表达水平均显著升高(P<0.05);与PD组比较,APS-L组、APS-H组大鼠腹膜组织中α-SMA、LN蛋白表达水平均显著降低(P<0.05),且APS-H 组改善效果优于APS-L 组(P<0.05);与APS-H 组比较,APS-H+DMOG 组大鼠腹膜组织中α-SMA、LN 蛋白表达水平均显著升高(P<0.05)。结果见图4和表4。
3.7 APS 对大鼠腹膜组织中HIF-11α/VEGF 信号通路相关蛋白表达的影响
与Control 组比较,PD 组大鼠腹膜组织中HIF-1α、VEGF 蛋白表达水平均显著升高(P<0.05);与PD 组比较,APS-L 组、APS-H 组大鼠腹膜组织中HIF-1α、VEGF蛋白表达水平均显著降低(P<0.05),且APS-H 组改善效果优于APS-L 组(P<0.05);与APS-H 组比较,APSH+DMOG 组大鼠腹膜组织中HIF-1α、VEGF 蛋白表达水平均显著升高(P<0.05)。结果见图5和表5。
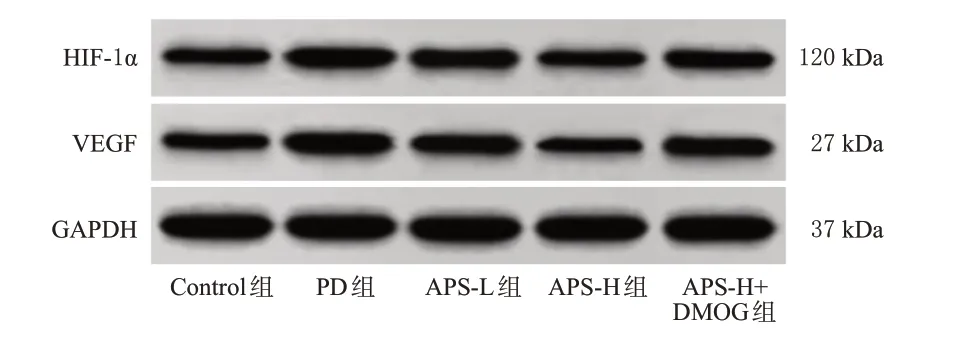
图5 各组大鼠腹膜组织中HIF-11α、VEGF 蛋白表达的电泳图
表5 各组大鼠腹膜组织中HIF-11α、VEGF 蛋白表达的检测结果(±s,n=6)

表5 各组大鼠腹膜组织中HIF-11α、VEGF 蛋白表达的检测结果(±s,n=6)
a:与Control组比较,P<0.05;b:与PD组比较,P<0.05;c:与APS-L组比较,P<0.05;d:与APS-H组比较,P<0.05。
组别Control组PD组APS-L组APS-H组APS-H+DMOG组HIF-1α 0.48±0.06 0.89±0.04a 0.73±0.05b 0.52±0.02bc 0.66±0.03d VEGF 0.53±0.03 0.96±0.03a 0.78±0.06b 0.57±0.06bc 0.71±0.07d
4 讨论
PD主要是利用腹膜生物半透膜特性清除体内代谢产物和超滤水分,维持电解质和酸碱平衡。长期使用PD 液特别是含有高浓度葡萄糖的PD 液可使腹膜的结构和功能发生改变,导致透析效能降低、超滤失败。本研究结果显示,APS 可以增加PD 大鼠腹膜UF,减少MTG 和血清中Scr、BUN 水平,从而抑制腹膜纤维化及血管新生。
腹膜纤维化是导致超滤衰竭的主要原因之一,而腹膜结构基础的间皮细胞是影响腹膜纤维化的关键。研究显示,α-SMA 表达增加可以导致腹膜纤维化发生,抑制腹膜间皮分泌α-SMA 可以延缓腹膜间皮细胞转分化,从而防治腹膜纤维化[10]。LN为细胞外基质的主要成分,也是胶原形成过程的中间产物,参与体内纤维化进程,其水平也可以间接反映体内纤维化的程度。研究显示,降低LN 蛋白表达水平可以阻止肾间质成纤维细胞的激活,抑制肾纤维化的发生[11]。本研究结果显示,APS可以下调α-SMA、LN蛋白表达,从而防治腹膜纤维化。
血管新生是在原有血管基础上出芽、套叠增生而成,参与机体的生长发育、组织修复、肿瘤形成等生理病理进程。新生的腹膜血管可以增大腹膜毛细血管的交换面积,加速腹膜吸收葡萄糖的速度,导致腹腔渗透浓度梯度消失加快、腹膜超滤减少,致使体内的水分及尿液中毒素物质不能及时清除,严重时可能造成心脏超负荷,甚至危及生命[12]。HIF-1α 是血管生成的启动因子,可以诱导血管生成;VEGF是内皮细胞特异性生长因子,可以诱导内皮细胞增殖、分化与迁移,修复损伤,促使血管新生,保持血管壁通透性与完整性等,是血管新生的标志性指标;另外VEGF是HIF-1α 主要靶基因之一,在缺氧条件下,可被HIF-1α 迅速诱导活化。研究显示,下调VEGF 的表达可以抑制大鼠肾脏病理性血管新生从而减轻纤维化损伤[13];抑制HIF-1α/VEGF信号通路可以降低关节炎大鼠炎症水平,抑制相关蛋白的表达,减缓血管的扩张及新生[14]。本研究结果显示,APS 可以抑制HIF-1α、VEGF蛋白表达,从而抑制腹膜血管新生及腹膜纤维化;而作为HIF-1α 激动剂的DMOG 可以逆转APS对腹膜血管新生及腹膜纤维化的抑制作用。
综上所述,APS可以通过抑制HIF-1α/VEGF信号通路来抑制PD大鼠腹膜纤维化及血管新生。

