乌奴龙胆组培快繁体系研究
鲁跃东 尼珍 央金拉姆
西藏自治区高原生物研究所,拉萨 850000
乌奴龙胆Gentiana urnulaH.Smith 属龙胆科龙胆属多年生草本植物,二级濒危藏药植物[1],藏文名为“岗嘎琼”。其药用历史悠久,始载于《四部医典》《晶珠本草》,后被《部藏标》《藏标》《中国藏药》收录,是现行部颁标准藏药制剂“二十五味大汤丸”等的主要成分,是著名藏药“佐太”“二十五味松石丸”等制剂中松石炮制过程必备的解毒藏药之一[2]。其味苦,全草用于血和赤巴并发症,木布病、血管闭塞病、中毒性发热、热性腹泻、流行性感冒发烧、咽喉肿痛、黄疸病[3]。
乌奴龙胆主产于中国西藏和青海西南部,生于高山砾石带、高山草甸和沙石山坡、海拔3900~5700m等地[4],在尼泊尔、锡金、不丹也有分布,以我国西藏所产的质量较优。高4~6cm,具发达的匍匐茎,须根多数,略肉质、淡黄色、枝多数、稀疏丛生、直立、极低矮、节间短缩,花果期8—10月。
据调查,乌奴龙胆野生资源趋于濒危状态,远不能满足藏药生产对乌奴龙胆的需求,因此建立乌奴龙胆的快繁体系十分必要。关于乌奴龙胆的研究报道很少,主要集中于研究其化学成分[4-8],在组培扩繁方面未见报道,本研究选用采自西藏自治区拉萨市堆龙德庆区羊达乡境内的乌奴龙胆植株进行组培快繁实验,重点探讨不同外植体不同HgCl2溶液消毒时间的消毒效果、不同不定芽诱导分化培养基的诱导效果以及不同生根培养基的生根效果,旨在总结出一套适合乌奴龙胆的组培方法,建立其组培快繁体系,以达到充实市场需求和减缓野生资源保护压力的目的。
1 材料与方法
1.1 实验材料
供试乌奴龙胆植株于2018 年6 月采集于西藏自治区拉萨市堆龙德庆区羊达乡境内。组培实验在西藏自治区高原生物研究所植物组培研究室的实验室进行。

图1 乌奴龙胆植株Figure 1 Gentiana urnula plants
1.2 实验方法
1.2.1 培养基配置
1.2.1.1 初始培养基。初始培养基用于外植体消毒实验,配方为:MS+0.1g/L 肌醇+30g/L 蔗糖+5g/L 琼脂粉(pH5.6)。
1.2.1.2 不定芽诱导分化培养基。不定芽诱导分化培养基选用MS作为基础培养基,附加0.1g/L肌醇、30g/L蔗糖和5g/L 琼脂粉,再添加不同浓度的6-BA 和IAA,共设7个处理组和1个对照组,配方设计见表1。

表1 不定芽诱导分化培养基配方Table 1 Formula of adventitious bud inducting and differentiating culture medium
1.2.1.3 生根培养基。生根培养基选用1/2MS培养基作为基础培养基,附加0.1g/L 肌醇、30g/L 蔗糖和5g/L琼脂粉,再添加不同浓度的NAA和IBA,共设7个处理组和1个对照组,配方设计见表2。

表2 生根培养基配方Table 2 Rooting culture medium formula
1.2.2 培养条件。培养条件分白天、夜晚两个时段,白天温度22±2℃,光照强度1000~1500Lx;夜晚温度8±2℃,无光照。外植体消毒实验培养30d,不定芽诱导分化实验培养30d,生根培养实验培养60d。
1.2.3 外植体和消毒时间筛选。切取健壮且无病虫害的乌奴龙胆植株带节茎段(0.5~1cm)和叶片块(0.5~1cm2)作为外植体,用自来水把外植体表面污渍冲洗干净。然后用肥皂水清洗外植体3~5min,再用自来水反复将肥皂水残液冲洗干净,置于超净工作台上。接着用75%酒精清洗外植体15s,再用无菌水振荡清洗3 次,每次不低于1min。最后将外植体放入HgCl2溶液中分别消毒2、4、6、8、10min,再用无菌水振荡清洗3次,每次不低于1min。
将消毒好的外植体,用无菌滤纸吸干表面水分,去除接触HgCl2溶液的伤口部分,接入初始培养基。两种外植体每个处理接种10瓶,每瓶1个外植体,3次重复。培养30d后统计并计算未污染率和成活率。
1.2.4 不定芽诱导分化培养基筛选。选用成功消毒后的外植体作为实验材料,接入8种“不定芽诱导分化培养基”,每个处理接种10瓶,每瓶1个外植体,3次重复。培养30d 后统计并计算愈伤组织出愈情况、芽的增殖倍数、芽的平均长度、未白化率和未玻璃化率。
1.2.5 生根培养基筛选。经过诱导分化形成的丛生芽,待其发育成2~3cm 丛生苗,具有2~3 片叶时,转接入8种“生根培养基”,每个处理接种10瓶,每瓶1株苗,3 次重复。培养60d 后统计并计算平均生根数、平均根长度、平均根健康率和平均生根率。
2 结果与分析
2.1 数据处理
实验结果数据使用Excel 2016软件进行初步处理;SPSS 26进行单因素方差分析,多重比较采用LSD法。
结合3 次重复实验各指标的平均值,采用模糊隶属函数法对不同消毒时间、不同不定芽诱导分化培养基、不同生根培养基的效果进行综合评价,先计算出某一指标的隶属函数值,然后再计算出每个处理的平均隶属函数值,其计算方程为[9]:
式中:Uij为i处理j指标的隶属函数值,Xij为i处理j指标的值,Xjmax为所有处理中此指标的最大值,Xjmin为所有处理中此指标的最小值,Ui为i 处理各指标的平均隶属函数值,n为指标数。
2.2 不同乌奴龙胆外植体及不同消毒时间的消毒效果
计算3次重复实验各处理组外植体的平均未污染率和平均成活率。
平均未污染率=(未出现污染现象的瓶数/接种瓶数×100%)/3
平均成活率=(成活数/接种数×100%)/3
由表3 可知,平均未污染率与HgCl2溶液消毒时间呈正相关;带节茎段作为外植体的平均成活率与HgCl2溶液消毒时间呈负相关;叶片块作为外植体,所有处理的平均成活率都为0.00%.由此可见,消毒时间越长,污染数越少,但毒害也越大;乌奴龙胆叶片块不适合用作外植体消毒实验的材料。单因素方差分析和多重比较表明,带节茎段不同处理组间的平均未污染率(P=0.000<0.05)和平均成活率(P=0.000<0.05)呈现显著差异;叶片块不同处理组间的平均未污染率(P=0.000<0.05)呈现显著差异。
基于HgCl2溶液不同消毒时间带节茎段的平均未污染率和平均成活率,计算平均隶属函数值,对不同消毒时间的消毒效果进行综合评价,见表4。可知U6min>U8min>U4min>U10min=U2min,结果表明,综合各因素,带节茎段作为外植体的最佳消毒时间为6min。

表4 不同消毒时间带节茎段消毒结果指标隶属函数值Table 4 Subordinate function values of disinfection results for stem segments with different disinfection times
2.3 不同诱导分化培养基对不定芽诱导增殖的影响
选用成功消毒后的带节茎段作为实验材料,进行不定芽诱导增殖实验。计算3次重复实验各处理组的平均芽增殖倍数、平均芽长度、平均未白化率和平均未玻璃化率。
平均芽增殖倍数=(总分化芽数/接种数)/3
平均芽长度=(所有芽长度之和/总分化芽数)/3
平均未白化率=(未出现白化现象的瓶数/接种瓶数)/3
平均未玻璃化率=(未出现玻璃苗现象的瓶数/接种瓶数)/3
根据表5 实验结果数据,由“平均芽增殖倍数”数据可知,由于P1、P2、P5、P6、P7 处理组添加了6-BA,P3、P4处理组未添加6-BA,导致前者的平均芽增殖倍数明显大于后者,可见6-BA 对芽有明显的增殖效果;而P2、P7 处理组添加的6-BA 浓度大于P1、P5、P6 处理组,导致前者的平均芽增殖倍数大于后者,可见2.0mg/L 6-BA 的效果要强于1.0mg/L 6-BA。由“平均芽长度”数据可知,由于P3、P4、P5、P6、P7处理组添加了IAA,P1、P2 处理组未添加IAA,导致前者的平均芽长度明显大于后者,可见IAA 对芽的增长有明显的效果;而在其他条件相同的情况下,P4 处理组(2.0mg/L IAA)平均芽长度大于P3 处理组,P6 处理组(2.0mg/L IAA)平均芽长度大于P5 处理组,可见2.0mg/L IAA 的效果要强于1.0mg/L IAA。随着添加的激素总浓度的提高,出现白化现象和玻璃苗的情况有不同程度的增多。单因素方差分析和多重比较表明,不同处理组间的平均芽增殖倍数(P=0.000<0.05)、平均芽长度(P=0.000<0.05)和平均未玻璃化率(P=0.028<0.05)呈现显著差异,平均未白化率(P=0.057<0.05)差异不显著。

表5 不同诱导分化培养基对不定芽诱导增殖的影响Table 5 Effects of different inducing and differentiating media on the induction and proliferation of adventitious buds
实验过程中,各处理组均未发现愈伤组织的形成。
基于各处理组的平均芽增殖倍数、平均芽长度和平均未玻璃化率,计算平均隶属函数值,对不同不定芽诱导分化培养基的效果进行综合评价,见表6。由于各处理组间的平均未白化率差异不显著,所以该指标不加入计算分析。结果表明,UP7>UP6>UP5>UP1>UP2>UP3>UP0>UP4,综合各因素,P7 处理组(MS+0.1g/L肌醇+30g/L蔗糖+5g/L琼脂粉+2.0mg/L 6-BA+1.0mg/L IAA)为最佳不定芽诱导分化培养基。
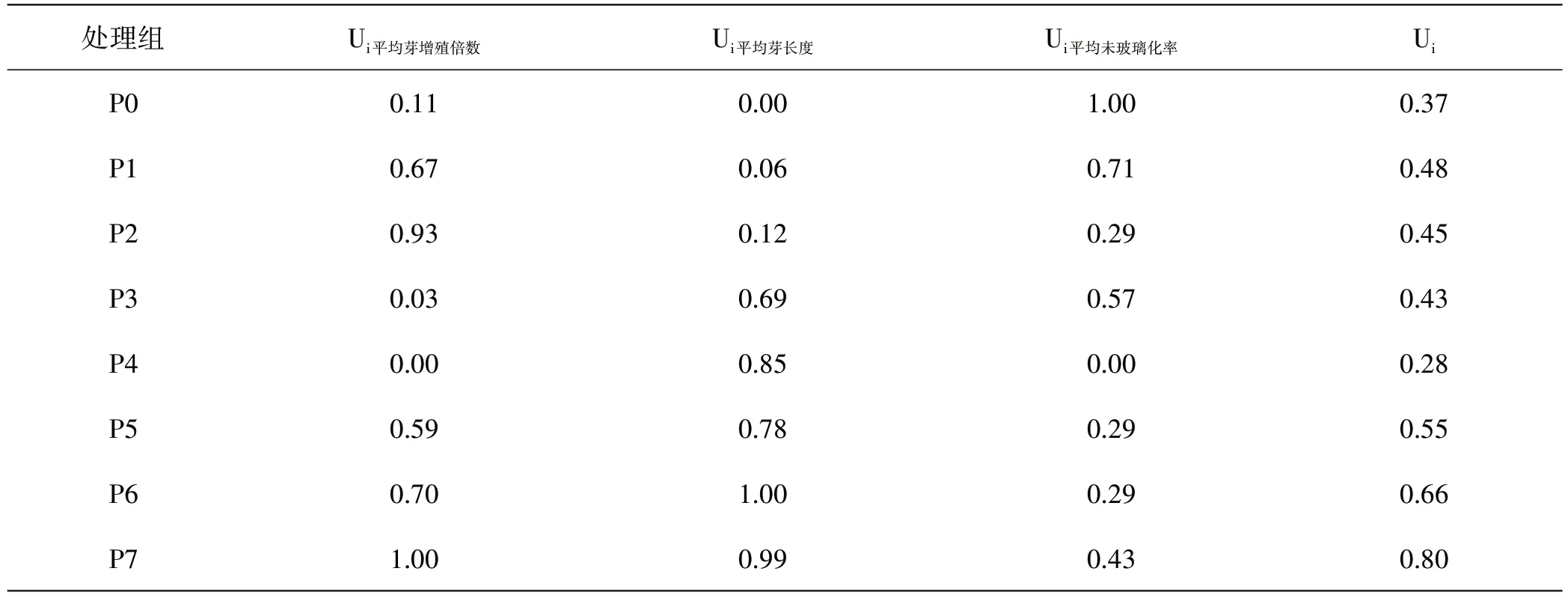
表6 不同不定芽诱导分化培养基处理结果指标隶属函数值Table 6 Subordinate function values of different inducing and differentiating media treatment results for adventitious buds
2.4 不同生根培养基对乌奴龙胆生根的影响
计算3 次重复实验各处理组的平均生根数、平均根长度、平均根健康率和平均生根率。
平均生根数=(总生根数/接种瓶数)/3
平均根长度=(所有根长度之和/总生根数)/3
平均根健康率=(健康颜色根数/总生根数)/3
平均生根率=(生根瓶数/接种瓶数)/3
由表7 可知,除CK 外,其他各处理组的平均生根率均为100%;NAA 和IBA 都对乌奴龙胆生根有明显的促进作用,且NAA 效果更佳;0.5mg/L NAA 促进生根作用要强于0.3mg/L NAA;IBA 对根的增长有明显促进作用,且0.5mg/L IBA 效果要强于0.3mg/L IBA;随着添加的激素总浓度的提高,根的颜色出现不健康的情况有不同程度的增多。单因素方差分析和多重比较表明,不同处理组间的平均生根数(P=0.000<0.05)、平均根长度(P=0.000<0.05)和平均根健康率(P=0.000<0.05)呈现显著差异。
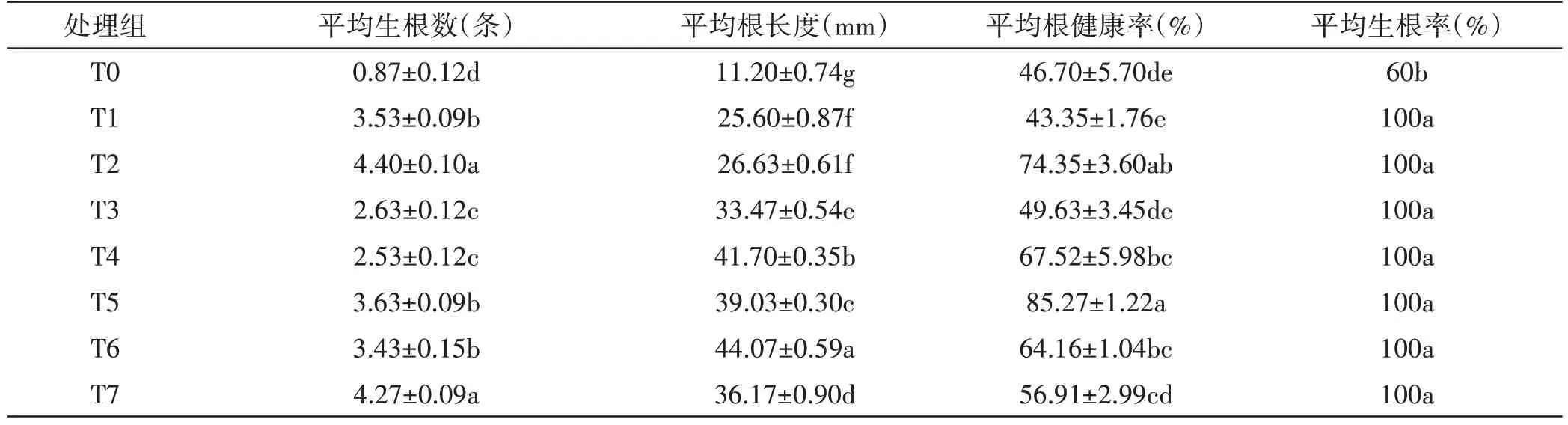
表7 不同生根培养基对乌奴龙胆生根的影响Table 7 Effects of different rooting culture media on the rooting of Gentiana urnula
基于各处理组的平均生根数、平均根长度和平均根健康率,计算平均隶属函数值,对不同生根培养基的生根效果进行综合评价,见表8。可知UT5>UT6=UT2>UT7>UT4>UT3>UT1>UT0,综合各因素,T5 处理组(1/2MS+0.1g/L 肌醇+30g/L 蔗糖+5g/L 琼脂粉+0.3mg/L NAA+0.3mg/L IBA)为最佳生根培养基。

表8 不同生根培养基处理结果指标隶属函数值Table 8 Subordinate function values of different rooting culture media treatment results

图2 乌奴龙胆组培过程Figure 2 Tissue culture process of Gentiana urnula
3 讨论
综上所述,为了建立乌奴龙胆的组培快繁体系,本研究选用采自西藏自治区拉萨市堆龙德庆区羊达乡境内的乌奴龙胆植株进行组培快繁实验。
本研究切取乌奴龙胆的带节茎段和叶片块作为外植体,采用HgCl2溶液设计出不同时间梯度,进行消毒实验;之后设计出7 种不定芽诱导分化培养基和7种生根培养基对乌奴龙胆进行诱导生芽和生根实验。实验结果表明,带节茎段适合作为乌奴龙胆组培实验中的外植体,叶片块不适合作为外植体;HgCl2溶液最佳消毒时间为6min;最佳不定芽诱导分化培养基为:P7 处理组(MS+0.1g/L 肌醇+30g/L 蔗糖+5g/L 琼脂粉+2.0mg/L 6-BA+1.0mg/L IAA);最佳生根培养基为:T5处理组(1/2MS+0.1g/L 肌醇+30g/L 蔗糖+5g/L 琼脂粉+0.3mg/L NAA+0.3mg/L IBA)。
乌奴龙胆的生根能力较强,在所有的生根培养基中生根率均达到了100%,且在实验过程中还发现在生根培养基(CK)和不定芽诱导分化培养基中亦有部分丛生苗生长出根,但是在添加不同浓度的NAA和IBA后,乌奴龙胆的生根数量和根长度有显著差异,其中NAA能明显促进乌奴龙胆生根,IBA能明显促进乌奴龙胆根的增长。与此同时,随着添加的激素总浓度升高,乌奴龙胆根的颜色出现不健康的情况也有不同程度的增多,在不定芽诱导增殖实验中同样有类似现象产生。
根据植物细胞的全能性,理论上任何完整的植物细胞都有形成新的完整植株的潜力[10],但是在实践中发现,不同器官的发育能力各不相同。在龙胆属植物的组织培养中,钟世浚利用红花龙胆带节茎段成功得到丛生苗[11],邢震利用蓝玉簪龙胆茎段成功得到丛生苗[12]。本研究中,乌奴龙胆叶片块进行消毒处理后全部褐化死亡,不适合作为乌奴龙胆组培外植体,这与钟世浚、邢震的实验结果相似。查阅更多文献后发现,目前对龙胆属植物的组培研究中,很少出现采用叶片外植体获得丛生苗的,这也许与龙胆属植物叶片中含有较多黄酮类物质而容易氧化导致褐化有关[13]。
植物组织培养是离体的组织,器官,经细胞脱分化形成愈伤组织,再分化形成芽、根,最终发育为完整植株的过程。本研究在进行不定芽诱导增殖实验过程中,各处理组均未发现愈伤组织的形成,但直接长出了不定芽。分析原因可能如下:(1)培养基激素浓度配比或培养条件不适合乌奴龙胆带节茎段愈伤组织的形成;(2)乌奴龙胆带节茎段不太容易形成愈伤组织[14],但是可以从节上长出腋芽(不定芽),从而跳过了形成愈伤组织这一过程。

