miR-145通过Notch通路调节免疫功能及炎症反应介导创伤性脑损伤的神经保护
胡德献 孙衍昶 冯基高 莫业和 (海南医学院第二附属医院神经外科,海口 570311)
创伤性脑损伤(traumatic brain injury,TBI)是死亡和残疾的最常见原因之一,给世界各地的患者带来巨大的心理和经济负担[1]。TBI包括原发性和继发性脑损伤,继发性损伤包括细胞凋亡、氧化应激、免疫反应和炎症的复杂级联反应[2]。据报道,神经炎症是继发性脑损伤的关键因素,大脑中的炎症反应通常涉及大量神经元坏死或死亡以及小胶质细胞激活[3]。既往研究表明,中度或重度创伤性脑损伤诱发慢性小胶质细胞激活,其可能是延迟细胞死亡和组织损伤的结果[4]。最近的研究表明,调节性T细胞(regulatory T cells,Tregs)在一些疾病中调节免疫和炎症,如脑缺血、病毒性心肌炎和重症肌无力[5-7]。然而,其潜在的病理和生理机制仍不清楚。微小核糖核酸(microRNA,miRNA)是一类小的非编码核糖核酸,通过与特定靶标mRNA的3'-非翻译区(3'-UTR)结合来负调控基因表达,从而抑制mRNA翻译或直接降解mRNA。据报道,多种微小核糖核酸的异常表达与TBI的发展有关。miR-145是最丰富和高度保守的miRNAs之一,与巨噬细胞极化有关[8]。研究表明,过表达miR-145可能通过抑制小胶质细胞活化预防缺血性脑卒中[9]。免疫/炎症反应在继发性脑损伤的病理过程中发挥重要作用,但miR-145在TBI后免疫/炎症反应调节中的作用尚不清楚。因此,本研究将探讨miR-145对神经预后的影响及其与神经炎症和免疫反应的关系。
1 材料与方法
1.1 材料
1.1.1 主要试剂与仪器 BCA试剂盒、ELISA试剂盒(上海碧云天公司);抗Notch1、p21、Hes1、NeuN抗体(Abcam公司);Trizol试剂(Invitrogen公司);流式细胞仪染色缓冲液(上海宾智生物科技有限公司);miR-145 agomir、NC agomir(上海捷瑞生物工程有限公司);TUNEL试剂[罗氏诊断产品(上海)有限公司]。动物立体定位仪(上海软隆科技发展有限公司);显微镜(Olympus公司);酶标仪(Thermo Fisher公司);荧光定量PCR仪(Bio-Rad公司)。
1.1.2 实验动物 8~10周龄雄性C57BL/6小鼠购于海南药物研究所有限责任公司,体质量21~23 g,生产许可证号:SCXK(琼)2020-0007,饲养于(20±2) ℃、(55±5)%湿度、12 h/12 h明暗循环的动物房中,使用许可证号:SYXK(琼)2017-0013。所有动物均自由摄食饮水。本研究所有动物程序均经海南医学院第二附属医院伦理委员会批准(202112-14)。
1.2 方法
1.2.1 构建TBI小鼠模型 麻醉小鼠,备皮消毒后,头皮矢状切开,露出颅骨,在右侧头盖骨bregma和lambda之间矢状缝合线外侧2 mm处钻一个直径3.5 mm的开口,假手术组即可完成手术。对于实验组小鼠,暴露硬脑膜后进行撞击脑挫伤,撞击速度为4.5 m/s,撞击持续时间为150 ms,深度为1.5 mm。击打结束后,立即缝合切口,使用加热垫对动物进行保暖,等待麻醉恢复。模型小鼠在损伤后24 h侧脑室注射0.5 nmol的miR-145 agomir或等浓度的阴性对照NC agomir。在损伤后第3天立即解剖海马组织,并在液氮中快速冷冻,用于后续实验。
1.2.2 改良神经损伤严重程度(mNSS)评分 mNSS评分用于评估创伤后神经功能。该测试包括运动(肌肉状态、异常运动)、感觉(视觉、触觉和本体感觉)、平衡木和反射测试。mNSS评分为0~18分,分数越大表示损伤越严重。本研究中,mNSS在TBI后的第1、3、5、9、14天进行评估。mNSS评分由两名不负责此研究的观察员进行评估。
1.2.3 莫里斯水迷宫(MWM) 迷宫是一个直径120 cm、深度50 cm的圆形水槽。水槽中装有深度为30 cm、温度为25 ℃的水。将水箱分成4个相等的象限,然后在一个象限的中心水面下1 cm处隐藏一个黑色圆形平台。所有小鼠在TBI后14 d连续训练5 d。在空间学习训练中,小鼠被随机放入迷宫中自由游泳直至找到平台。如果1只小鼠在60 s内找不到平台,则在平台上休息30 s。第6天,从任意方向测试,记录每只小鼠的运动情况,利用追踪分析软件评估小鼠认知功能。
1.2.4 Western blot 使用RIPA裂解缓冲液裂解同侧海马组织。每组中等量的蛋白质用SDS-PAGE凝胶电泳分离,然后将蛋白质转移至PVDF膜。室温下采用5%脱脂牛奶封闭膜1 h,随后将膜与一抗4 ℃过夜孵育,结束后与二抗在室温下孵育1 h。使用增强化学发光试剂显现条带。最后,使用Image J软件分析量化蛋白质表达。
1.2.5 实时荧光定量PCR(RT-qPCR) 使用Trizol试剂按照说明书从海马组织中提取总RNA。检测miRNA表达时,使用TaqMan microRNA逆转录试剂盒,根据说明书将其逆转录为cDNA。检测mRNA表达时,使用PrimeScript RT试剂盒将RNA反转录为cDNA。根据制造商的说明,使用SYBR Green PCR Master Mix试剂盒进行RT-qPCR分析。目的基因的相对表达量使用2-ΔΔCt方法计算。mRNAs或miRNAs分别使用GAPDH或U6作为内部对照。
1.2.6 ELISA 从损伤的大脑半球取海马组织匀浆。根据制造商说明,使用ELISA试剂盒检测海马组织中促炎细胞因子IL-1β、IL-6、TNF-α和抗炎细胞因子IL-4、IL-10和TGF-β浓度。
1.2.7 TUNEL染色 将组织切片脱蜡并与0.1%Triton X-100在室温下孵育10 min。柠檬酸盐缓冲液高温修复10 min后,将组织用TUNEL溶液在37 ℃下孵育60 min,然后用NeuN抗体4 ℃下孵育过夜。PBS洗涤3次,并与Cy3标记的山羊抗小鼠IgG在室温下孵育60 min。用抗荧光淬灭剂封片,并使用荧光显微镜观察外伤性病灶周围凋亡神经元细胞的数量。
1.2.8 流式细胞术 流式细胞术检测脑组织Treg淋巴细胞。取小鼠脑组织并制备脑组织单细胞悬液,使用小鼠Tregs染色试剂盒对分离的细胞进行染色。简而言之,用抗小鼠CD4-FITC和抗小鼠CD25-PE对细胞于4 ℃下染色30 min固定,然后用固定/透化溶液在4 ℃下透化过夜,随后用抗小鼠Foxp3-APC抗体染色,最后上机进行流式细胞分析。
1.2.9 免疫组化 将小鼠麻醉后,灌注4%多聚甲醛。随后立即取脑组织,4%多聚甲醛室温固定24 h。制作脑组织石蜡切片,用梯度乙醇和二甲苯脱蜡,在柠檬酸盐缓冲液(pH=6.0)中煮沸以修复组织抗原。PBS洗3次,将切片与3%过氧化氢(H2O2)孵育20 min,然后用3%牛血清白蛋白孵育60 min阻断非特异性结合。预处理后,将切片与兔抗小鼠Iba-1抗体孵育过夜。然后与生物素化的抗兔IgG在室温下孵育2 h。最后用抗生物素蛋白-生物素辣根过氧化物酶(HRP)复合物识别结合的抗体,并使用二氨基联苯胺溶液进行可视化检测HRP活性。每个切片中Iba-1阳性细胞的数量由两名对研究条件不了解的独立观察者在挫伤脑组织的5个区域中计数,计算阳性细胞数量。
1.3 统计学分析 使用SPSS22.0统计软件进行统计分析。实验结果以±s表示。两组之间使用t检验进行分析,多组间比较采用单因素方差分析。P<0.05为差异具有统计学意义。
2 结果
2.1 miR-145对TBI术后小鼠神经功能的影响 与Sham组比较,TBI组小鼠海马组织中miR-145表达显著降低,逃避潜伏期延长,穿越平台次数减少,严重程度评分显著升高(P<0.05);与TBI+NC agomir组比较,TBI+miR-145 agomir组小鼠海马中miR-145表达显著升高,逃避潜伏期缩短,穿越平台次数增加,小鼠第3、5、9、14天神经损伤严重程度评分显著降低(P<0.05),见图1。

图1 miR-145对TBI术后小鼠神经功能的影响Fig.1 Effect of miR-145 on neurological function of mice after TBI
2.2 miR-145对TBI术后小鼠脑组织中Tregs的影响 与Sham组比较,TBI组小鼠脑组织中Tregs在CD4+T细胞群中的百分比降低(P<0.05);与TBI+NC agomir组比较,TBI+miR-145 agomir组小鼠脑组织中Tregs细胞在CD4+T细胞群中的百分比显著升高(P<0.05),见图2。
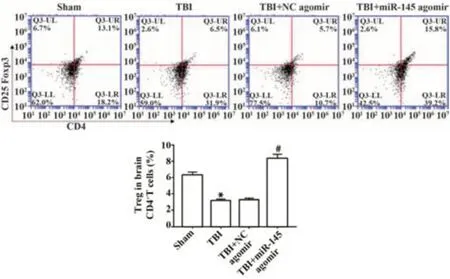
图2 miR-145对TBI术后小鼠脑组织中Tregs的影响Fig.2 Effect of miR-145 on Tregs in mice brain after TBI operation
2.3 miR-145对TBI术后小鼠炎症细胞因子的影响 与Sham组比较,TBI组小鼠海马组织中IL-1β、IL-6、TNF-α、IL-4、IL-10和TGF-β表达水平显著升高(P<0.05);与TBI+NC agomir组比较,TBI+miR-145 agomir组小鼠海马中促炎因子IL-1β、IL-6、TNFα表达水平显著降低,抗炎因子IL-4、IL-10和TGF-β表达水平显著升高(P<0.05),见图3。
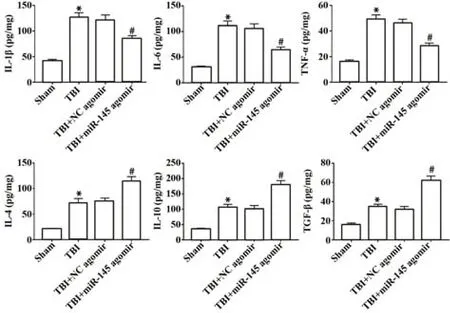
图3 miR-145对TBI术后小鼠炎症细胞因子的影响Fig.3 Effect of miR-145 on inflammatory cytokines in mice after TBI operation
2.4 miR-145对TBI术后小胶质细胞/巨噬细胞极化的影响 与Sham组比较,TBI组活化的小胶质细胞/巨噬细胞Iba-1数量增多(P<0.05);与TBI+NC agomir组比较,TBI+miR-145 agomir组活化的小胶质细胞/巨噬细胞Iba-1数显著减少(P<0.05),见图4。
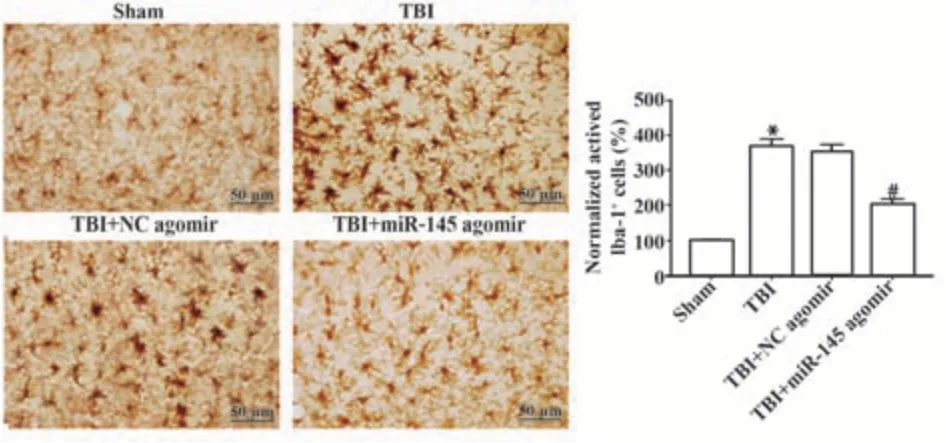
图4 miR-145对TBI术后小胶质细胞/巨噬细胞极化的影响Fig.4 Effect of miR-145 on microglia/macrophage polarization after TBI
2.5 miR-145对TBI术后M1/M2小胶质细胞/巨噬细胞极化的影响 与Sham组比较,TBI组小鼠M1小胶质细胞标志物基因iNOS和CD11b以及M2小胶质细胞标志物基因CD206和Arg1表达水平显著升高(P<0.05);与TBI+NC agomir组比较,TBI+miR-145 agomir组小鼠M1小胶质细胞标志物基因iNOS和CD11b表达水平显著降低,而M2小胶质细胞标志物基因CD206和Arg1表达水平显著升高(P<0.05),见图5。

图5 miR-145对TBI术后M1/M2小胶质细胞/巨噬细胞极化的影响Fig.5 Effect of miR-145 on M1/M2 microglia/macrophage polarization after TBI
2.6 miR-145对TBI术后海马细胞神经元凋亡的影响 与Sham组比较,TBI组小鼠海马神经元凋亡数量显著增加,凋亡神经元占总NeuN阳性神经元中的百分比升高(P<0.05);与TBI+NC agomir组比较,TBI+miR-145 agomir组小鼠凋亡的神经元数量显著减少,凋亡神经元占总NeuN阳性神经元中的百分比显著降低(P<0.05),见图6。

图6 miR-145对TBI术后神经细胞凋亡的影响Fig.6 Effect of miR-145 on nerve cell apoptosis after TBI
2.7 miR-145对TBI后小鼠海马Notch信号通路的影响 与Sham组比较,TBI组小鼠海马中Notch1、p21和Hes1 mRNA和蛋白水平均显著升高(P<0.05);与TBI+NC agomir组比较,TBI+miR-145 agomir组小鼠海马中Notch1、p21和Hes1 mRNA和蛋白水平均显著降低(P<0.05),见图7。
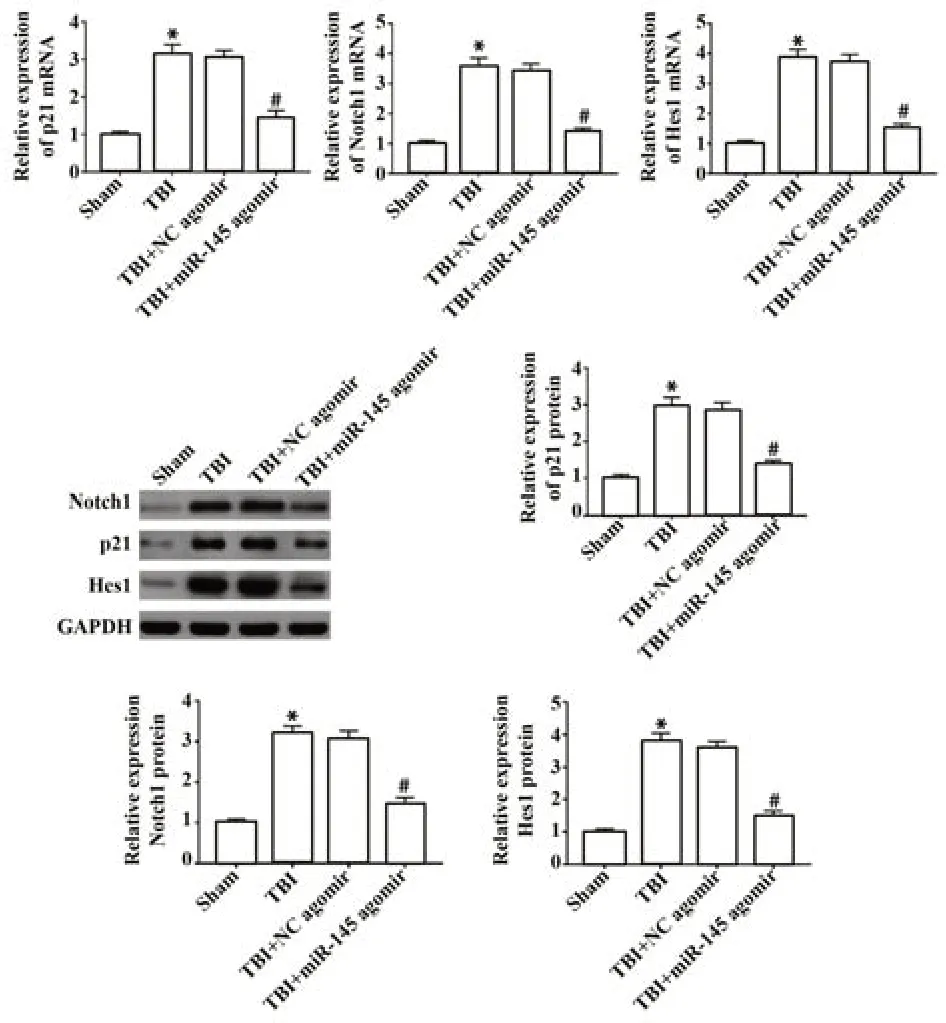
图7 miR-145对TBI术后Notch信号通路的影响Fig.7 Effect of miR-145 on Notch signaling pathway after TBI
3 讨论
研究表明,TBI后持续的小胶质细胞活化有助于神经变性和相关神经损伤的进展[10]。此外,多项研究计算了患者和创伤性脑损伤动物的miRNA谱,并确定了创伤性脑损伤中潜在的miRNA生物标志物[11-12]。然而,miR-145在TBI中的作用报道较少。为了研究miR-145在TBI中的作用,本研究构建TBI小鼠模型,通过侧脑室注射miR-145激动剂上调TBI后miR-145水平。首先研究miR-145对TBI术后神经功能结果的影响,结果发现过表达miR-145显著改善了TBI模型诱发的神经功能障碍。
此外,本研究证明了TBI后小鼠miR-145的抗炎和免疫调节特性。Treg是T淋巴细胞的一个子集,具有调节免疫/炎症功能的能力。Tregs可减少脑损伤,减少免疫/炎症细胞浸润和小胶质细胞激活,降低促炎细胞因子分泌,提高抗炎细胞因子水平[13]。本研究发现在TBI后3 d,脑组织中Tregs水平降低。过表达miR-145可显著增加中枢神经系统中Tregs数量。既往研究报道,TBI患者中Tregs水平显著降低,表明Tregs增加可能改善TBI的预后[14]。这与本研究结果一致。因此,增加Tregs可能在TBI中由miR-145治疗诱导的神经保护和免疫/炎症调节中起关键作用。
炎症是多种神经退行性疾病及其相关神经病理学的潜在组成部分。急性神经炎症通过引发促进细胞因子和/或趋化因子的分泌,以及中枢神经系统小胶质细胞的活化损害脑细胞[15]。本研究发现在小鼠TBI模型中,过表达miR-145显著抑制神经炎症,促炎细胞因子减少,抗炎细胞因子增加,并显著减轻了小胶质细胞活化。脑损伤后,活化的小胶质细胞/巨噬细胞作为中枢神经系统炎症过程中的主要执行者,在细胞形态和行为上发生了显著变化[16]。小胶质细胞/巨噬细胞可根据其宿主组织微环境分化为有害表型(M1)或有益表型。据报道,小胶质细胞/巨噬细胞的过度M1样激活也可诱发慢性炎症,阻止组织修复并诱发继发性损伤[17]。M2小胶质细胞/巨噬细胞被认为是M1的抗衡物,有助于损伤后的恢复,并分泌IL-10、IL-4、IL-13等抗炎介质及各种神经营养因子,以保持组织的完整性[18-19]。本研究通过分析与M1或M2相关的特征基因在海马的表达评估大脑小胶质细胞的极化,结果发现过表达miR-145后,M1小胶质细胞标志物基因iNOS和CD11b表达降低,M2小胶质细胞标志物基因CD206和Arg1表达水平显著升高,提示miR-145通过促进小胶质细胞/巨噬细胞从M1向M2表型的转变而发挥抗炎作用。
近期研究报道,脑损伤后Notch信号通路可被激活,并参与激活的小胶质细胞中神经炎症介质的释放。抑制Notch通路可减轻脑细胞损伤,改善功能[20]。此外,Notch信号通路在其他组织的损伤中也发挥重要作用。例如,抑制Notch通路可减轻急性肾损[21]。Notch信号是由许多miRNAs调控的,已有研究报道miR-145在Notch信号通路中发挥关键作用[22]。本研究结果表明,过表达miR-145可降低Notch1、Hes1和p21蛋白表达,提示miR-145可能通过抑制Notch信号通路促进海马小胶质细胞的M2极化及海马神经元凋亡。
综上所述,本研究表明过表达miR-145可通过减少创伤后神经炎症反应和免疫调节改善行为功能障碍,提高Treg水平,促进小胶质细胞M2极化,这可能是通过抑制Notch信号通路介导的。因此,miR-145有望成为改善创伤性脑损伤的有效治疗手段和潜在靶标。

