基于下丘脑-垂体-肾上腺轴探讨电针对功能性消化不良大鼠的作用机制*
乐 薇,姚函伶,杨格格,吴贻森,徐派的**
(1.武汉市中西医结合医院 武汉 430022;2.湖北中医药大学针灸骨伤学院 武汉 430065)
功能性消化不良(Functional dyspepsia,FD)是以进食后出现饱胀不适、上腹部烧灼性疼痛为主,伴恶心、嗳气,或见焦虑、抑郁等心理症状的非器质性胃肠疾病[1]。流行病学研究发现,功能性胃肠疾病在中国的发病率高达35%,其中FD的患病率约占比1/6[2]。目前关于FD 的研究多集中在胃排空延迟、脑-肠轴功能紊乱、内脏高敏性、十二指肠炎症等领域[3-6],其中脑-肠轴作为大脑和胃肠道的双向调节轴,在中枢神经系统层面可通过下丘脑-垂体-肾上腺(Hypothalamicpituitary-adrenal axis,HPA)轴分泌激素,在正常情况下,HPA 轴有维持内环境稳定,参与机体应激反应的作用。当长期慢性应激导致HPA 轴功能亢进时,可影响机体的消化、免疫、情志,导致FD 的发病[7]。5-羟色胺(5-Hydroxytryptamine,5-HT)与促肾上腺皮质激素释放激素(Corticotropin releasing homone,CRH)广泛分布于脑和胃肠组织中,可增强脑与胃肠之间的内在联系,被称之为“脑肠肽”[7]。研究显示,电针可抑制亢进的HPA轴,下调5-HT、CRH 的表达,有加速胃排空,恢复胃肠消化功能,抗焦虑等作用[8-9]。5-羟色胺3 受体(5-hydroxytryptamine-3 receptor,5-HT3R)作为5-HT唯一的离子通道型受体,其高电流密度可加重胃肠不适,并与抑郁情绪的产生密切相关[10]。促肾上腺皮质激素释放激素受体2(Corticotropin-releasing-factor receptor 2,CRHR2)是CRH 的亚型受体,可与CRH 多肽紧密结合,有减轻内脏疼痛,抗抑郁的作用[11]。NOD样受体蛋白6(Nod-like receptor pyrin domaincontaining protein 6,NLRP6)在肠上皮细胞中高度表达,可以组成炎症小体复合物[12]与杯状细胞一起参与肠道免疫的调控,在肠道黏液分泌、黏膜屏障、肠道炎症方面有正向的调节作用[13]。
本课题前期已从胃肠动力、内脏高敏性、十二指肠炎症、焦虑抑郁情绪等[14-17]层面展开研究,实验表明电针可有效提升FD 治疗效果,但电针降低FD 大鼠HPA 轴的具体作用机制还有待深入研究,本实验建立FD模型大鼠,以大鼠下丘脑、胃肠为观察点,旨在从行为学、细胞、分子学角度,观察电针对FD 模型大鼠旷场自主活动行为,胃黏膜细胞,十二指肠杯状细胞,下丘脑5-HT3R、CRH,十二指肠CRHR2、NLRP6 的水平,探讨电针对FD大鼠HPA轴的干预作用机制。
1 材料
1.1 实验动物与分组
SPF 级SD 雄性大鼠,40 只,体质量180-200 g,由三峡大学动物实验中心供应,许可证号:SCXK(鄂)2022-0012。SD 大鼠饲养于SPF 级动物房,室温(22±2)℃,昼夜明暗交替12 h,SD 大鼠自由采食无菌饲料、饮用无菌水,适应性喂养1 周后,随机取10 只SD 大鼠组成空白组,剩余SD 大鼠行造模处理,14 天造模结束后,随机取10 只SD 大鼠组成模型组,10 只SD 大鼠组成电针组。电针组继续予以14 天电针干预。本实验所有操作均符合《湖北省动物管理条例》条文规定(HUCMS202203001)[18]。
1.2 主要试剂与仪器
CRHR2抗体(武汉三鹰生物技术有限公司,货号:25267-2-AP);NLRP6 抗体(武汉爱博泰克生物科技有限公司,货号:A15628);内参抗体GAPDH(武汉赛维尔生物科技有限公司,货号:GB12002);HE 染液套装(武汉赛维尔生物科技有限公司,货号:G1003);阿利新蓝染液套装(武汉赛维尔生物科技有限公司,货号:G1027);三氯甲烷(国药集团化学试剂有限公司,货号:10006818);华佗穴位电针仪(南京济生医疗科技有限公司,型号:SDZ-Ⅱ型);一次性针灸针(苏州医疗用品厂有限公司,0.28 mm×25 mm);荧光定量PCR仪(美国Bio-Rad,型号:CFX);超微量分光光度计(赛默飞世尔中国科技有限公司,型号:NanoDrop2000);酶标仪(深圳雷杜生命科学股份有限公司,型号:RT-6100);台式高速冷冻离心机(北京大龙兴创实验仪器有限公司,型号:D3024R);转印电泳仪(武汉赛维尔生物科技有限公司,型号:SVT-2);正置光学显微镜(日本尼康公司,型号:Nikon Eclipse E100);全景切片扫描仪(三达科技股份有限公司,型号:PANNORAMIC 1000)等。
2 方法
2.1 建立FD大鼠模型
除10只空白组大鼠外,剩余大鼠均采取冰生理盐水灌胃+不规则饮食+夹尾造模处理[19],每日8∶30 和15∶00灌胃,提前解冻冰生理盐水待用,当出现部分流动液体后开始灌胃,每只灌胃2 mL。灌胃结束后行夹尾处理,采用240 mm 止血钳,将止血钳头部用自粘绷带包裹,夹取部位选择大鼠尾端1/3 处,轻轻夹起尾端,激怒大鼠,使其撕咬同笼大鼠,让全笼大鼠处于一种焦躁、恐慌的状态。操作过程中随时观察大鼠尾端情况,避免夹的太紧或时间过长而引发尾部缺血坏死,每次30 min,每天2 次,连续夹尾14 天。每日实验结束后,查看大鼠尾部状态,破皮处予以消毒处理,避免尾部感染。双日8∶00清除大鼠笼子里剩余的饲料,行禁食处理,补充无菌水,自由饮水。当大鼠表现为喜扎堆,蜷缩角落,少动,毛发杂乱发黄,大便稀软,可闻及刺激腥臭味,剩余饲料增多,体质量增长缓慢,提示造模成功[20]。
2.2 干预方法
空白组:常规饲养,不做特殊干预处理。模型组:造模成功后常规饲养,在电针组电针干预期间,抓取模型组大鼠,穿自制鼠衣,用相同的方法固定于鼠架上,每次30 min,每天1次,连续干预14天。电针组:造模结束第2天,用自制鼠衣将大鼠固定于鼠架上,暴露双侧上、下肢,取印堂(两眼眶上缘最高点连线的中点,向下平刺5 mm)、内关(前肢内侧,距腕关节约3 mm 的尺桡骨缝间,直刺1 mm)以及足三里(膝关节后外侧,在腓骨头下约5 mm处,直刺7 mm),定位参考《实验动物常用穴位名称与定位 第2部分:大鼠》[21],穴位消毒后,用一次性毫针(0.28 mm×25 mm)针刺,快速破皮,得气后,开启华佗牌电针仪,1 组电极连接同侧内关、足三里针柄,一共2 组电极,采用连续波,频率2 Hz,电流强度1 mA,四肢微微抖动即可,干预结束后,拔出电针,无菌棉球按压,避免出血。每次电针干预时长为30 min,每天1次,连续干预14天。
2.3 取材
电针干预结束后行最后1 次旷场实验,实验结束后,采用随机排列表法,每组选取5 只大鼠,予以禁食处理,为第2 天取材做准备。腹腔注射,麻醉大鼠,全身麻醉后,用手术刀片逐层切开,暴露腹腔,找到胃贲门及幽门,用细线结扎,剪断连接处,取出全胃,剪取胃窦,置于装有4%多聚甲醛的痰杯中固定。后用镊子分离与其他组织相连的肠管,剪取多段十二指肠组织,沿肠壁一侧剪开十二指肠,清除肠内容物后,置于-80℃保存待用。剪取脑,迅速剥离全脑,在冰台上取大鼠下丘脑组织,将分离出的下丘脑组织用冰生理盐水冲洗,除去血液后,再用滤纸吸干水分,置于冻存管内,后加入RNA 保存液,放入干冰中迅速冷冻待检。
2.4 观察指标与检测方法
2.4.1 大鼠一般状态
每日8∶00给各组大鼠称重,观察并记录各组大鼠实验过程中的活动度、进食量、体质量的变化情况、毛发的整洁度、大便的干燥度等。
2.4.2 旷场实验
采用旷场实验检测各组大鼠的自主行为以及对陌生环境的紧张度。分别于造模结束后、干预1 周及干预2周后进行旷场实验,调试好设备后,将大鼠放置于长宽均40 cm,高50 cm 的正方形反应箱的中央区域,适应30 s 后,开始计时,每只大鼠测试时长为5 min,采用Smart 3.0软件进行数据分析,记录5 min内大鼠的自主运动距离和运动速度,全程保持安静,以免干扰大鼠活动。每只大鼠检测完毕后,先喷洒75%乙醇酒精,再用酒精湿巾清洁前1 只大鼠留在反应箱内壁及底面的大小便,最后用干纸巾擦干,以排除前一只大鼠留下来的气味干扰。
2.4.3 大鼠胃窦组织病理学变化
采用HE 染色法检测,取胃窦组织,石蜡包埋,用切片机切成厚度5 µm的薄片,苏木素染色5 min,自来水洗,分化液分化,再次水洗,返蓝液蓝化,入伊红染液中染色5 min,漂洗透明,树胶封片。置于×200 光学显微镜下,观察大鼠胃窦组织形态。
2.4.4 大鼠下丘脑5-HT3R、CRH表达
采用实时荧光定量PCR 法检测,取100 mg冻存的下丘脑组织,剪碎后充分研磨至无肉眼可见组织块,用TRIzol 法提取总RNA,取10 µL RNA 逆转录成cDNA,最后用实时荧光定量PCR 仪进行目的mRNA含量检测。5-HT3R、CRH 和GAPDH 引物由武汉赛维尔生物科技有限公司合成,序列见表1。反应条件95℃持续30 min 预变性,然后95℃持续15 s,最后60℃持续30 s,连续40 次,监测熔解曲线,以2-△△Ct法算出大鼠下丘脑5-HT3R、CRH mRNA相对表达量。

表1 mRNA引物序列
2.4.5 大鼠十二指肠CRHR2,NLRP6蛋白表达
采用蛋白免疫印迹法(Western blot)检测,取50 mg 十二指肠组织,添加250 µL RIPA 裂解液,低温研磨,提取蛋白,用BCA 试剂盒测定蛋白的质量浓度;经SDS-PAGE 凝胶泳道上样,电泳后将蛋白转膜,室温封闭30 min;添加一抗(CRHR2 1∶1000,NLRP6 1∶1000),4℃恒温孵化一夜,用TBST 洗膜3 次,添加HRP标记的二抗(山羊抗小鼠IgG 1∶5000),室温孵化30 min,添加ECL 溶液曝光,GAPDH 为内参,采用Image J图像分析软件提取目的条带灰度值。
2.4.6 大鼠十二指肠杯状细胞的表达
采用阿利新蓝染色法检测,取冻存的十二指肠组织,石蜡包埋,超薄切片后,脱腊水洗,将切片浸泡于阿利新蓝A 染液中10 min,水洗后,用阿利新蓝B 染液浸染细胞核3 min,至细胞核清晰,脱水透明,树胶封片。使用CaseViewer2.2 扫描浏览软件选取组织的目的区域进行成像(×100),成像完成后使用Image-Pro Plus 6.0 分析软件分别测量每张切片中5 根绒毛上皮长度(mm),并计算上皮杯状细胞数量,可按照如下方法计算:单位长度杯状细胞=杯状细胞/肠腺上皮长度。
2.5 统计学处理
选用SPSS 27.0软件进行统计学分析,符合正态分布的计量资料用均数±标准差(±s)表示,组间比较用单因素方差分析,两两比较方差齐用LSD 检验,方差不齐采用Dunnett-t检验;组内比较采用重复测量方差分析法。以P<0.05 或P<0.01 为差异具有统计学意义的标准。
3 结果
3.1 各组大鼠的一般状态比较
造模前,各组大鼠反应灵敏,常有毛发修饰行为,粪便干燥。造模14天后,模型组和电针组大鼠反应迟钝,昏睡,毛发发黄杂乱,大便不成形伴腥臭味。电针干预14天后,与模型组相比,电针组大鼠机警,动作敏捷,毛发柔顺,大便颗粒状,无明显刺激异味。
3.2 各组大鼠旷场实验对比
造模后,与空白组相比,模型组和电针组大鼠的旷场自主运动距离明显缩短,运动速度明显减慢(P<0.01);干预2 周后,与空白组相比,模型组大鼠的旷场自主运动距离及运动速度均呈下降趋势(P<0.01),中央区运动减少,多在周围区徘徊。与模型组相比,电针组大鼠的旷场自主运动距离及运动速度均明显上升(P<0.01),其中央区穿行次数增多。见图1及表2-3。
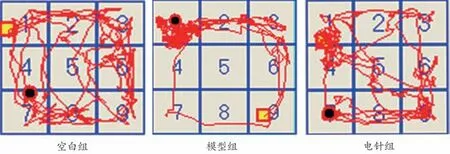
图1 各组电针干预2周后的旷场实验轨迹比较
表2 各组大鼠干预前后自主运动距离比较(±s,n=10,cm)
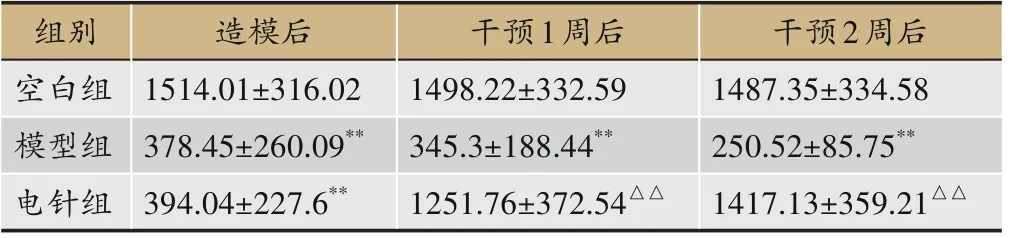
表2 各组大鼠干预前后自主运动距离比较(±s,n=10,cm)
注:与空白组比较,**P<0.01;与模型组比较,△△P<0.01。
干预2周后1487.35±334.58 250.52±85.75**1417.13±359.21△△组别空白组模型组电针组造模后1514.01±316.02 378.45±260.09**394.04±227.6**干预1周后1498.22±332.59 345.3±188.44**1251.76±372.54△△
表3 各组大鼠干预前后运动速度比较(±s,n=10,cm·s-1)
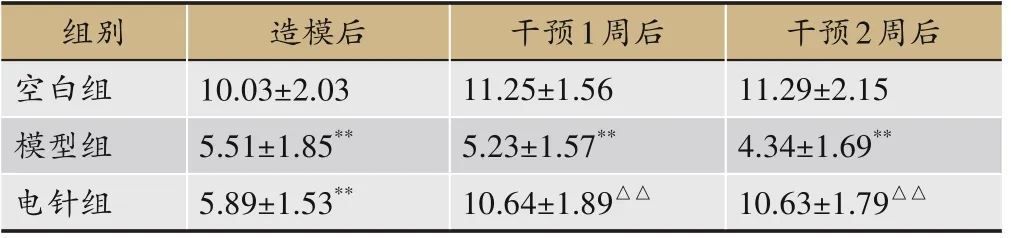
表3 各组大鼠干预前后运动速度比较(±s,n=10,cm·s-1)
注:与空白组比较,**P<0.01;与模型组比较,△△P<0.01。
干预2周后11.29±2.15 4.34±1.69**10.63±1.79△△组别空白组模型组电针组造模后10.03±2.03 5.51±1.85**5.89±1.53**干预1周后11.25±1.56 5.23±1.57**10.64±1.89△△
3.3 各组大鼠胃窦组织病理学形态比较
空白组大鼠的胃窦黏膜排列有序,各层肌纤维上色均匀,间质细胞无明显增生,未见炎症反应。模型组大鼠的胃窦基质组织液分泌增多,黏膜有轻度水肿,可见疏松的结缔组织,淋巴细胞。电针组大鼠的胃窦黏膜外观形态正常,各层肌纤维着色一致,细胞排列整齐,黏膜上皮完整,未见明显细胞脱落,没有炎症细胞聚集。见图2。
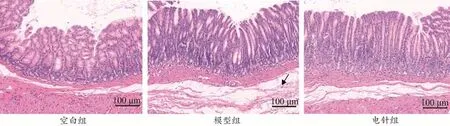
图2 各组大鼠胃窦组织病理学形态比较(HE染色,×200)
3.4 各组大鼠下丘脑中5-HT3R、CRH表达比较
与空白组相比,模型组大鼠下丘脑5-HT3R、CRH大幅升高(P<0.05)。与模型组相比,电针组大鼠下丘脑5-HT3R、CRH大幅降低(P<0.05)。见表4。
表4 各组大鼠下丘脑5-HT3R、CRH表达(±s,n=5)

表4 各组大鼠下丘脑5-HT3R、CRH表达(±s,n=5)
注:与空白组比较,*P<0.05;与模型组比较,△P<0.05,△△P<0.01。
CRH 0.81±0.18 2.02±0.2*0.78±0.13△△组别空白组模型组电针组5-HT3R 1.05±0.3 2.66±0.76*1.11±0.28△
3.5 各组大鼠十二指肠中CRHR2、NLRP6 蛋白表达比较
与空白组相比,模型组大鼠十二指肠CRHR2、NLRP6 蛋白表达量大幅降低(P<0.05)。与模型组相比,电针组大鼠十二指肠CRHR2、NLRP6 蛋白表达大幅升高(P<0.05)。见图3及表5。
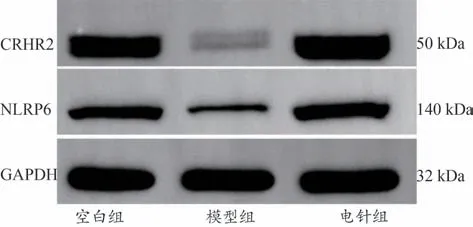
图3 各组大鼠十二指肠中CRHR2、NLRP6蛋白表达情况(±s)
表5 各组大鼠十二指肠CRHR2、NLRP6表达(±s,n=5)

表5 各组大鼠十二指肠CRHR2、NLRP6表达(±s,n=5)
注:与空白组比较,*P<0.05,**P<0.01;与模型组比较,△P<0.05,△△P<0.01。
NLRP6 0.87±0.22 0.39±0.06*0.93±0.22△组别空白组模型组电针组CRHR2 1.28±0.11 0.56±0.23**1.34±0.28△△
3.6 各组大鼠十二指肠单位长度杯状细胞数表达比较
与空白组相比,模型组大鼠十二指肠黏膜排列疏松,肠绒毛结构破碎,可见散在分布的上皮细胞,上皮杯状细胞严重缺失,单位长度杯状细胞数表达量明显降低。与模型组相比,电针组十二指肠绒毛排列紧密,组织完整无破碎,阿利新蓝染色均匀,杯状细胞无缺失,单位长度杯状细胞数表达量明显升高(P<0.05)。见图4及表6。
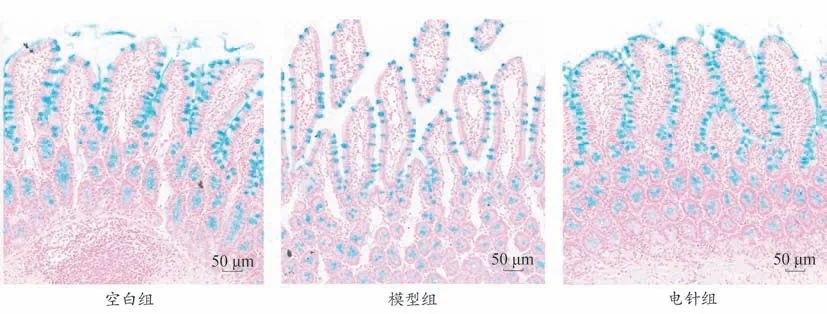
图4 各组大鼠十二指肠组织切片形态比较(阿利新蓝染色,×100)
表6 各组大鼠十二指肠单位长度杯状细胞数表达量(±s,n=5,n·mm-1)
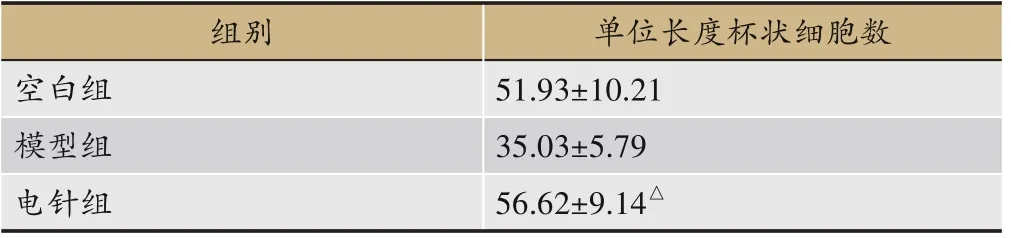
表6 各组大鼠十二指肠单位长度杯状细胞数表达量(±s,n=5,n·mm-1)
注:与模型组比较,△P<0.05。
组别单位长度杯状细胞数51.93±10.21 35.03±5.79 56.62±9.14△空白组模型组电针组
4 讨论
早在1991 年,Mearin 等[22]便提出实验假设,认为FD 患者的消化不良症状是由脑-肠轴功能失常而引发。目前有越来越多的学者更加深入地研究脑-肠轴功能与FD 的相关性, Xue等[23]发现脑肠肽及肠道菌群的异常可对脑-肠信号造成干扰,影响胃肠运动及短链脂肪酸的释放,诱导FD 患者出现肠道炎症和内脏高敏性。Șchiopu 等[24]通过多数据库的文献引证,认为伴有精神症状的FD 患者可通过肠道微生物群来调控HPA轴,其中HPA轴是脑-肠轴的关键参与者,可对外界压力、大脑和肠道信号做出反应,从而达到情志与胃肠的双向调节作用。
现代HPA 轴理论可从中医经络循行、脏腑功能角度加以理解。手阳明大肠经、足阳明胃经以及手太阳小肠经均上行络脑。脑为髓海,头部精气汇聚于脑,称为头气街;脾胃为水谷之海,胃肠精气汇聚于腹部,称为腹气街,两者由气街四海相贯通,渗灌气血津液于全身[25],可见经络、气街四海为脑与脾胃沟通的桥梁。“脑为元神之府”可主宰人体的生命活动,主司精神及感觉运动。胃肠的受纳功能依赖于大脑感知系统的正常运作,若大脑无法获取胃肠的饥饿信号,即使胃肠功能无异常,胃肠也无法正常受纳水谷。“脾在体合肉,主四肢”,脾胃运化水谷,化生气血津液充养全身,若脾胃虚弱,气血化生乏源,脑及四肢失于濡养,元神受损,则令人不寐,易感疲乏,日久则肉削肌痿,运动失司[26]。
足三里是水谷之海汇聚之所,内关是心包经气聚集之要,两者合用是临床治疗FD 的经典配穴[27]。前期研究表明,针刺足三里可刺激胃体收缩,增加胃肠道的蠕动,还可加速胃肠道黏膜的修复[28]。针刺内关可降低胃肠炎症反应,增强机体免疫力,又可下调脑区复杂度,缓解焦虑情绪[29]。郑嘉怡等[26]认为情志不畅可诱发或加重FD,减弱胃肠的运动功能;而胃肠排空的延迟易兴奋HPA 轴,刺激CRH 的释放,增加抑郁情绪的发作风险,表明压力可双向调节FD 大脑与胃肠功能。因此,本研究在足三里、内关的基础上搭配有解郁调神的印堂作为干预选穴。李翔等[30]研究发现,采用针刺印堂的方法来干预抑郁模型小鼠可增加小鼠旷场实验中央区活动时间,提升糖水偏好实验百分比,表明针刺印堂有缓解小鼠抑郁样行为的作用。三穴同用,以期能较好地探讨电针对FD 大鼠HPA 轴的作用机制。
旷场实验是一项用于评估实验大鼠抑郁状态的行为学指标,大鼠的自主活动水平可反映其兴奋性和对陌生环境的适应性[31]。本实验结果显示:造模后,与空白组大鼠相比,模型和电针组大鼠旷场自主运动水平显著下降,说明FD 大鼠经过多因素造模刺激后出现类似人类的抑郁样情绪,经过2周的干预后,电针组大鼠自主运动距离和运动速度及中央区穿行活动均得到提升,与本课题前期实验结果相一致,提示电针可有效改善大鼠的焦虑和抑郁行为。
5-HT 是调节胃肠功能的重要脑肠肽之一,在脑和肠道均有分布,异常释放的5-HT 与其受体结合,可增强内脏敏感性、诱发胃肠炎症、降低胃肠动力[32]。5-HT3R[33]是5-HT 的受体之一,被活化的5-HT3R 可改变Na+、K+、Ca2+离子的通透性,促进细胞外Na+、K+、Ca2+离子内流,增强5-HT3R 通道电流密度,可引发腹胀、腹痛等胃肠道不适症状,同时神经元Na+、K+、Ca2+在5-HT3R 受体介导的离子通道中异常流动,可加重抑郁情绪的发作[10]。队列调查研究显示,抑郁情绪或心理压力会增加FD 的发病风险。长期的慢性应激会过度兴奋HPA 轴,升高下丘脑CRH 水平,可促进炎症细胞因子的释放,增加肠道黏膜通透性[34]。CRHR2 是CRH受体之一,在脑和胃肠均有表达,与CRH 多肽Ucn2 和Ucn3 存在高亲和力,主要发挥拮抗应激反应的作用,如抗焦虑[11]。本研究结果显示,FD 大鼠下丘脑5-HT3R、CRH 明显增多,十二指肠CRHR2 蛋白表达减少,结合FD 大鼠旷场自主运动的减弱、光镜下观察到胃窦黏膜的水肿及炎症细胞的浸润情况,说明机体的过度应激致使HPA 轴兴奋性增高,体内的激素、神经递质释放增多,引发胃肠与心理情绪的异常。电针干预后,5-HT3R、CRH 显著下降,CRHR2 蛋白水平升高,旷场自主运动水平提升,胃窦肿胀及炎症情况得以改善,提示电针印堂、内关、足三里可下调5-HT3R、CRH 的表达,提升CRHR2 蛋白水平,这与电针抑制HPA 轴过度兴奋,降低胃肠炎症,缓解抑郁情绪的作用相一致。
NLRP6 可识别肠道微生物、细菌代谢产物、病毒RNA 以及细菌脂磷壁酸,有增强肠道防御、调节肠道微生态、参与机体炎症免疫应答的作用[35]。肠道黏膜屏障的缺损使体内的细菌、病毒等有害物质损害肠黏膜,引发肠道炎症反应。杯状细胞及其分泌物是黏液屏障的重要组成部分,具有维持肠道微生物稳态的作用[36]。Wlodarska 等[37]研究发现,缺乏NLRP6 炎症小体的小鼠,肠道的黏膜屏障受到损害,无法正常清除肠道黏膜表面的病原体,加大了肠道持续感染的风险,其机制可能是黏蛋白颗粒无法和肠上皮融合进而影响黏蛋白的胞吐作用,也可能是杯状细胞自噬缺陷干扰了肠道黏液的分泌。Holzer 等[38]认为慢性应激可兴奋HPA 轴,扰乱机体胃肠微生物菌群以及肠道稳态。众所周知,肠黏膜屏障是由肠黏膜细胞和免疫细胞所构成,是机体抵抗外界病原菌侵袭的一道重要防线。如果肠道黏膜屏障的功能受损,就会对肠道细菌和外源性有害物质的入侵产生影响,引发机体的过度免疫反应,进而引起机体的病变[39]。在这当中,杯状细胞以及其所分泌的黏蛋白组成了肠道免疫的第一道防线,在抵御外部刺激和微生物侵入的时候,为肠道提供了保障,对维持肠道共生菌群的平衡有很大的帮助作用,对维持十二指肠屏障的正常功能具有重要意义[40]。朱春洋等[41]采用四逆散干预FD 模型大鼠,采用阿利新蓝染色法观察到FD 模型大鼠十二指肠杯状细胞数量明显减少,与本实验结果一致。此外,杯状细胞还可通过其分泌物三叶因子-3 和肠道杯状细胞特异性蛋白-抵抗素样分子 β 共同保障肠道屏障的完整,在此过程中由杯状细胞表达的羟基转移酶可防止黏蛋白的降解,降低肠道炎症、癌细胞的致病风险[42]。本研究结果发现,多因素干预建立的FD 模型大鼠的NLRP6蛋白表达下降,在阿利新蓝染色实验中,模型组大鼠十二指肠肠绒毛排列疏松,上皮杯状细胞表达下降,提示FD 大鼠十二指肠黏膜屏障受损。电针组大鼠NLRP6 蛋白表达增高,肠绒毛排列紧密,组织染色均匀,上皮杯状细胞数明显增多,提示电针印堂、内关、足三里可激活NLRP6 蛋白,促进杯状细胞表达,进而增加肠道黏液的分泌,修复十二指肠黏膜屏障的同时还可清除有害的病原体。
综上所述,本研究从行为学、神经递质、激素和黏膜屏障等角度验证电针印堂、内关、足三里可作用于HPA轴,不仅可以调节胃肠动力,减轻胃肠炎症,修复黏膜屏障,而且在心理、抑郁情绪等方面有显著的调节作用,这也与中医学“脾(胃)-脑”神识系统理论[7]相符合。

