去泛素化酶OTUB2通过诱导DDX54活性增加中性粒细胞外诱捕网的形成以及促进结直肠癌细胞活力和侵袭能力
蒋良君,李 卫
结直肠癌(colorectal cancer,CRC)又称大肠癌,是一种起源于大肠上皮组织的恶性肿瘤,其发病率逐年上升,明确结肠癌的发病机制对于该疾病的诊断和治疗具有重要意义[1]。中性粒细胞胞外诱捕网(neutrophil extracellular traps,NETs)是一种由脱聚染色质和颗粒蛋白组成的细胞外网状结构,由活化的中性粒细胞在特定的刺激下产生并释放,NETs在先天性免疫和癌症转移中起着重要作用[2]。含OTU结构域的泛素醛结合蛋白2 (OTU deubiquitinase,ubiquitin aldehyde binding 2,OTUB2)是一种去泛素化酶,也被证明是一种致癌因子,研究[3]显示OTUB2在胃癌组织和细胞中高表达,过表达OTUB2促进胃癌细胞增殖、迁移和侵袭。OTUB2可通过抑制丙酮酸激酶M2型同工酶的泛素化诱导癌细胞糖酵解进而促进CRC进展[4]。此外,研究[5]表明RNA解螺旋酶54(DEAD-box helicase 54,DDX54)在CRC组织中高表达,与肿瘤的生长和不良预后有关。然而关于OTUB2调控DDX54在CRC中的作用和相关的分子机制仍不明确。该研究旨在探讨去泛素化酶OTUB2调控DDX54 对NETs的形成和CRC细胞活力、侵袭的影响。
1 材料与方法
1.1 主要材料与仪器人CRC细胞系(HCT116、SW480、DLD-1)和人正常结肠上皮细胞(NCM460)(武汉尚恩生物技术有限公司,货号:SNL-077、SNL-074、SNL-076、SNL-519);OTUB2野生型SW480细胞(OTUB2-WT)以及OTUB2敲除SW480细胞(OTUB2-KO)购自南京金斯瑞生物科技有限公司;DMEM培养基(美国Gibco公司,货号:12634010);佛波酯(phorbol-12-myristate-13-acetate,PMA)(美国MedChem Express公司,货号:HY-18739);脱氧核糖核酸酶Ⅰ(DNase Ⅰ)、谷胱甘肽S-转移酶(glutathione s-transferase,GST)抗体和组氨酸(histidine,His)抗体(美国Sigma公司,货号:D21962、G6511、GT359);vector、OTUB2过表达质粒、si-OTUB2、si-DDX45及相应的阴性对照(广州锐博生物科技有限公司);二甲基亚砜(dimethyl sulfoxide,DMSO)(北京索莱宝科技有限公司,货号:D8372);胎牛血清(fetal bovine serum,FBS)、Lipofectamine 3000试剂、TRIzol试剂、蛋白质A/G琼脂糖珠(美国Thermo Fisher Scientific公司,货号:A5669701、L3000075、15596018、78609);人外周血中性粒细胞分离试剂盒(北京索莱宝科技有限公司,货号:P9040);ELISA试剂盒:白细胞介素-8(Interleukin-8,IL-8)(货号:ab214030)、肿瘤坏死因子-α(tumor necrosis factor-alpha,TNF-α)(货号:ab181421)、一抗:MPO(货号:ab208670)、Cit-H3(货号:ab219407)、OTUB2(货号:ab74371)、抗泛素抗体(ab7780)、DDX54(货号:ab76947),二抗:HRP标记的山羊抗兔IgG(货号:ab6721)均购自英国Abcam公司;髓过氧化物酶(myeloperoxidase,MPO)-DNA复合物ELISA试剂盒(上海仁捷生物科技有限公司,货号:RJ23716);瓜氨酸组蛋白H3(citrullinated histone H3,Cit-H3)ELISA试剂盒(武汉纽莱生物科技有限公司,货号:NLH7890);Transwell小室(美国康宁公司,货号:3412);MTT溶液、结晶紫染色液、RIPA裂解液、BCA蛋白定量试剂盒(上海碧云天生物技术有限公司,货号:C0009S、C0121、P0013B、P0009);聚偏二氟乙烯(PVDF)膜(美国Millipore公司,货号:HVLP02500);ECL试剂盒(美国Bio-Rad公司,货号:1705061);HiScript Ⅱ Q RT SuperMix、SYBR Green qPCR Master试剂盒(南京诺唯赞生物科技股份有限公司,货号:R232-01、Q111-02); 大肠埃希菌BL21(上海泽叶生物科技有限公司,货号:ZY-12-174Y);HisTrap HP层析柱(上海桂宁实验器材有限公司,货号:17-5247-01)、谷胱甘肽-琼脂糖4B层析柱(上海信裕生物科技有限公司,货号:XY90421);Illumina测序仪(美国Illumina公司,型号:MiSeq);实时荧光定量PCR仪(瑞士Roche公司,型号:LightCycler 96);酶标仪(德国BioTek公司,型号:Cytation 5);荧光显微镜(德国Carl Zeiss公司,型号:Axio Imager 2);红外成像系统 (美国LI-COR公司,型号:Odyssey);紫外可见分光光度计(美国Thermo Fisher Scientific公司,型号:Nanodrop 2000)。
1.2 方法
1.2.1临床样本收集 收集2021年4月—2022年1月期间在南华大学衡阳医学院附属南华医院接受手术治疗的CRC患者的癌组织与癌旁组织(距离癌组织3 cm),共61例。纳入标准如下:① 病理活检诊断为CRC的患者;② 初次被诊断为CRC且之前未患过其他癌症;③ 术前未接受过手术切除、放化疗等任何形式的治疗。排除标准:①合并有肝、肾、心脏等严重器质性疾病的患者;② 临床资料不完整的患者。所有患者均签署书面知情同意书且本研究经过南华大学衡阳医学院附属南华医院医学伦理委员会备案(批号:NHYY2021a025)。标本放置在-80 ℃条件下保存。
1.2.2中性粒细胞分离和NETs诱导 收集CRC患者的外周血样本,使用外周血中性粒细胞提取试剂盒分离外周血中性粒细胞,分离的原代中性粒细胞在含10%FBS的RPMI-1640培养基中培养。将中性粒细胞分为对照组(中性粒细胞不做任何处理)、PMA组(中性粒细胞加入10 mmol/L NETs释放激活剂PMA)、PMA+DNase Ⅰ组(中性粒细胞被PMA处理后加入100 U/ml NETs抑制剂)。首先将外周血中分离的中性粒细胞(密度1×106)接种于24孔板中黏附1 h。PMA组加入100 nmol/L的PMA刺激4 h,PMA+DNase Ⅰ组在加入PMA的同时加入100 U/ml的DNase Ⅰ。各组细胞上清液用于ELISA检测。收集PMA组中含有NETs的上清液,在4 ℃下以10 000 r/min的转速离心10 min,再以40 000 r/min的转速离心20 min以得到纯化的NETs,储存在-80 ℃下以备后续实验。
1.2.3CRC细胞培养 人CRC细胞系(HCT116、SW480、DLD-1)和人正常结肠上皮细胞(NCM460)在DMEM培养基(添加有10%FBS和1%青-链霉素)中培养,并置于37 ℃、5%CO2加湿的培养箱中培养48 h。
1.2.4CRC细胞转染和分组 将SW480细胞接种于24孔板中,在37 ℃下培养过夜。使用Lipofectamine 3000试剂将OTUB2过表达质粒及其阴性对照vector和siRNA(si-OTUB2、si-DDX54)及对应的阴性对照(si-NC)转染至SW480细胞。转染48 h后,使用qRT-PCR法检测转染效率并用于后续研究。使用Transwell共培养系统将中性粒细胞和CRC细胞共培养,中性粒细胞接种于Transwell下腔,SW480细胞接种于Transwell上腔,具体细胞分组如下:对照组、NETs组、vector组、OTUB2组、OTUB2+DNase Ⅰ组、si-OTUB2组、NETs+si-OTUB2组、OTUB2+si-NC组和OTUB2+si-DDX54组。对照组SW480细胞不做任何处理,NETs组、NETs+si-OTUB2组(分别使用SW480细胞、转染了si-OTUB2的SW480细胞与PMA处理的中性粒细胞共培养),vector组、OTUB2组、si-OTUB2组、OTUB2+si-NC组、OTUB2+si-DDX54组(分别与转染了vector、OTUB2过表达质粒、si-OTUB2、OTUB2过表达质粒和si-NC、OTUB2过表达质粒和si-DDX54的SW480细胞与中性粒细胞共培养),OTUB2+DNase Ⅰ组(转染了OTUB2过表达质粒的SW480细胞与DNase Ⅰ处理的中性粒细胞共培养)。
1.2.5ELISA检测IL-8、TNF-α、MPO-DNA复合物水平和Cit-H3浓度 收集健康对照组和CRC患者血清样本,根据ELISA试剂盒说明中的要求检测IL-8和TNF-α的浓度;收集与NETs共培养后的SW480细胞,1 000 r/min离心5 min后取上清液。使用ELISA试剂盒检测上清液中MPO-DNA复合物相对表达量和Cit-H3浓度。
1.2.6Western blot检测蛋白表达 RIPA裂解液提取各组SW480细胞总蛋白,BCA法测定蛋白浓度,行SDS-PAGE凝胶电泳并转膜后,使用5% BSA将转移后的膜封闭2 h,并与一抗:抗MPO(1∶1 000)、抗Cit-H3(1∶1 000)、抗OTUB2(1∶1 000)和抗DDX54(1∶2 000)在 4 ℃ 下孵育过夜,然后与HRP标记的二抗(1∶2 000)在室温下孵育1 h。TBST 溶液洗膜 3次,ECL显色,ImageJ软件对蛋白条带进行定量。
1.2.7MTT检测细胞活力 将各组对数生长期的SW480细胞接种于96孔板(2×103)中孵育过夜,之后按照MTT试剂盒说明书要求对各组细胞活力进行检测。细胞活力(%)=(待测样品吸光度值﹣背景吸光度值)/(对照样品吸光度值﹣背景吸光度值)×100%。
1.2.8Transwell检测细胞侵袭 已转染的SW480细胞胰酶消化后,重悬于无血清的培养基中,调整细胞密度为1×105个/ml。Transwell小室(孔径8 μm)的上室预包埋有基质胶,然后向上室中加入各组细胞,下室中加入600 μl含10%FBS的培养基。孵育24 h后,取出Transwell膜,用棉签擦去未侵入的细胞,4%多聚甲醛固定,结晶紫染色后显微镜下观察染色结果。
1.2.9qRT-PCR检测mRNA表达 使用TRIzol试剂分别提取各组SW480细胞和CRC患者癌组织和癌旁组织中的RNA,Nanodrop 2000分光光度计测量总RNA的浓度和纯度。跟据HiScript Ⅱ Q RT Super Mix的说明将总RNA逆转录为cDNA,然后通过SYBR Green qPCR Master试剂盒在Light Cycler 96实时荧光定量PCR仪上进行PCR扩增。GAPDH作为内参,具体引物序列见表1。

表1 引物序列表
1.2.10生物信息学分析 UALCAN数据库(http://ualcan.path.uab.edu)用于分析OTUB2和DDX54在CRC中的表达。StarBase数据库(https://starbase.sysu.edu.cn)用于预测OTUB2的结合蛋白。采用韦恩图在线工具(http://bioinformatics.psb.ugent.be/webtools/Venn/)取RNA测序得到的敲减OTUB2后SW480细胞中的差异表达基因以及OTUB2的结合蛋白的交集。Timer数据库(https://cistrome.shinyapps.io/timer/)预测OTUB2表达和中性粒细胞的相关性。
1.2.11RNA测序 在人CRC细胞SW480细胞中转染si-OTUB2,从细胞中分离RNA,DNase Ⅰ处理总RNA,紫外分光光度计检测RNA的质量;将纯化后的RNA进行rRNA去除、片段化并且合成cDNA、修复cDNA末端、连接接头后构建测序样本文库;通过RNA测序测定敲减OTUB2后SW480细胞中的所有差异表达基因。依据cBot用户指南指示的流程,在Illumina测序仪的cBot上生成Cluster和测序引物杂交,准备测序试剂并将含cluster的flow cell上机并对数据进行实时分析。差异因子筛选条件为P<0.05且差异倍数≥1。
1.2.12免疫共沉淀(co-immunoprecipitation,Co-IP)反应和Western blot实验 Co-IP实验用于验证OTUB2和DDX54的相互作用。收集SW480细胞,将细胞使用裂解缓冲液裂解、胰蛋白酶消化后加入OTUB2(1∶1 000)、DDX54抗体(1∶2 000)和山羊抗兔IgG(1∶2 000)抗体在4 ℃下孵育4 h,之后加入蛋白质A/G琼脂糖珠捕捉抗原抗体复合物,收集沉淀后的蛋白行Western blot检测。Co-IP检测OTUB2对DDX54的泛素化修饰时,首先对OTUB2-WT和OTUB2-KO细胞进行裂解,之后向上清中加入抗泛素抗体(HA-Ubi)(1∶1 000)、HA-Ub-DDX54,将抗体与蛋白质A/G琼脂糖珠结合,使用缓冲液洗涤后行Western blot检测。
1.2.13蛋白质纯化与谷胱甘肽S-转移酶亲和纯化(glutathione s-transferase pull down,GST pull down) 采用GST pull down实验验证OTUB2和DDX54的互作用。重组 His 标记的 OTUB2和DDX54在大肠埃希菌BL21中表达,并使用HisTrap HP层析柱进行纯化。GST标记的OTUB2和DDX54也在大肠埃希菌BL21中表达,并使用谷胱甘肽-琼脂糖4B层析柱进行纯化。对于体外GST pull-down测定,GST标记蛋白与带有His标签的蛋白在PBS中4 ℃下孵育2 h。接下来,将谷胱甘肽-琼脂糖树脂添加到缓冲液中,并将混合物在4 ℃下孵育3 h。将珠子用PBS缓冲液洗涤3次,并用30 μl 2×SDS上样缓冲液煮沸,然后进行SDS-PAGE分析。
1.2.14His-tag pull-down His-tag pull-down实验验证OTUB2对DDX54的泛素化修饰情况。转染OTUB2过表达质粒的SW480细胞室温下在8 ml His-tag pull down裂解缓冲液中裂解2 h。将细胞裂解物与50 μl Ni NTA珠在室温下孵育6 h。用 His-tag pull-down 洗涤缓冲液Ⅰ、Ⅱ、Ⅲ和Ⅳ依次洗涤珠子。珠子在30 μl His-tag pull-down 洗脱缓冲液中洗脱,并用 30 μl 2×SDS上样缓冲液煮沸。对样品进行蛋白质印迹分析。
1.3 统计学处理使用 GraphPad Prism 8.0软件进行统计分析。实验结果统计以平均值±标准差表示,两组间比较采用t检验,多组之间比较采用单因素方差分析,多组间数据的两两比较采用SNK-q检验,P<0.05为差异有统计学意义。
2 结果
2.1 CRC患者外周血中NETs的形成增加并促进CRC细胞活力和侵袭当中性粒细胞释放NETs时,它们会释放一系列的细胞因子,包括TNF-α和IL-8。与健康对照组相比,CRC组患者外周血中NETs相关因子TNF-α和IL-8的水平上调(t=9.79、10.15,均P<0.001)(图1A)。与对照组相比,PMA组中性粒细胞MPO和Cit-H3蛋白表达上调(q=19.09、22.49,均P<0.001);与PMA组相比,使用PMA+DNase Ⅰ处理后,MPO和Cit-H3蛋白表达降低(q=11.34、16.25,均P<0.001),表明PMA成功诱导NETs形成,而DNase Ⅰ抑制了NETs水平(图3B)。将分离的NETs用于处理SW480细胞并检测细胞活力与侵袭,与对照组相比,NETs处理组细胞活力和侵袭增加(t=7.69、6.72,均P<0.01)(图3C、D)。
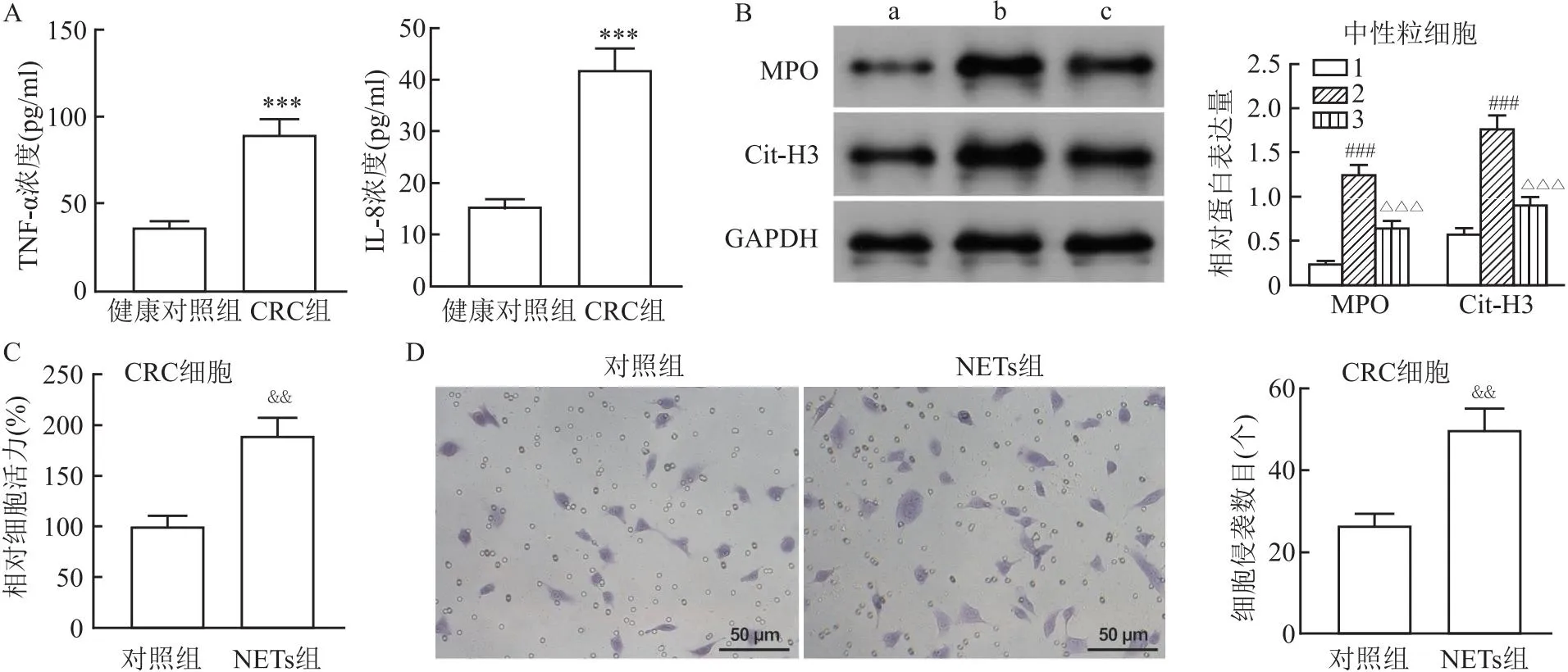
图1 NETs分离及其对CRC细胞活力和侵袭的影响
2.2 OTUB2在CRC组织和细胞中高表达并与中性粒细胞呈正相关UALCAN数据库分析显示OTUB2在CRC组织中的表达高于癌旁组织(图2A);与癌旁组织相比,CRC患者癌组织中OTUB2的mRNA表达上调(t=8.51,P=0.001)(图2B),并且OTUB2 mRNA和蛋白在CRC细胞中的表达均高于NCM460细胞(q=8.11、12.89、10.70、7.59、16.48、9.99,均P<0.01)(图2C、D)。TIMER数据库预测结果显示,在CRC中OTUB2的表达与中性粒细胞的相对浸润水平呈正相关(r=0.16,P=0.001)(图2E)。
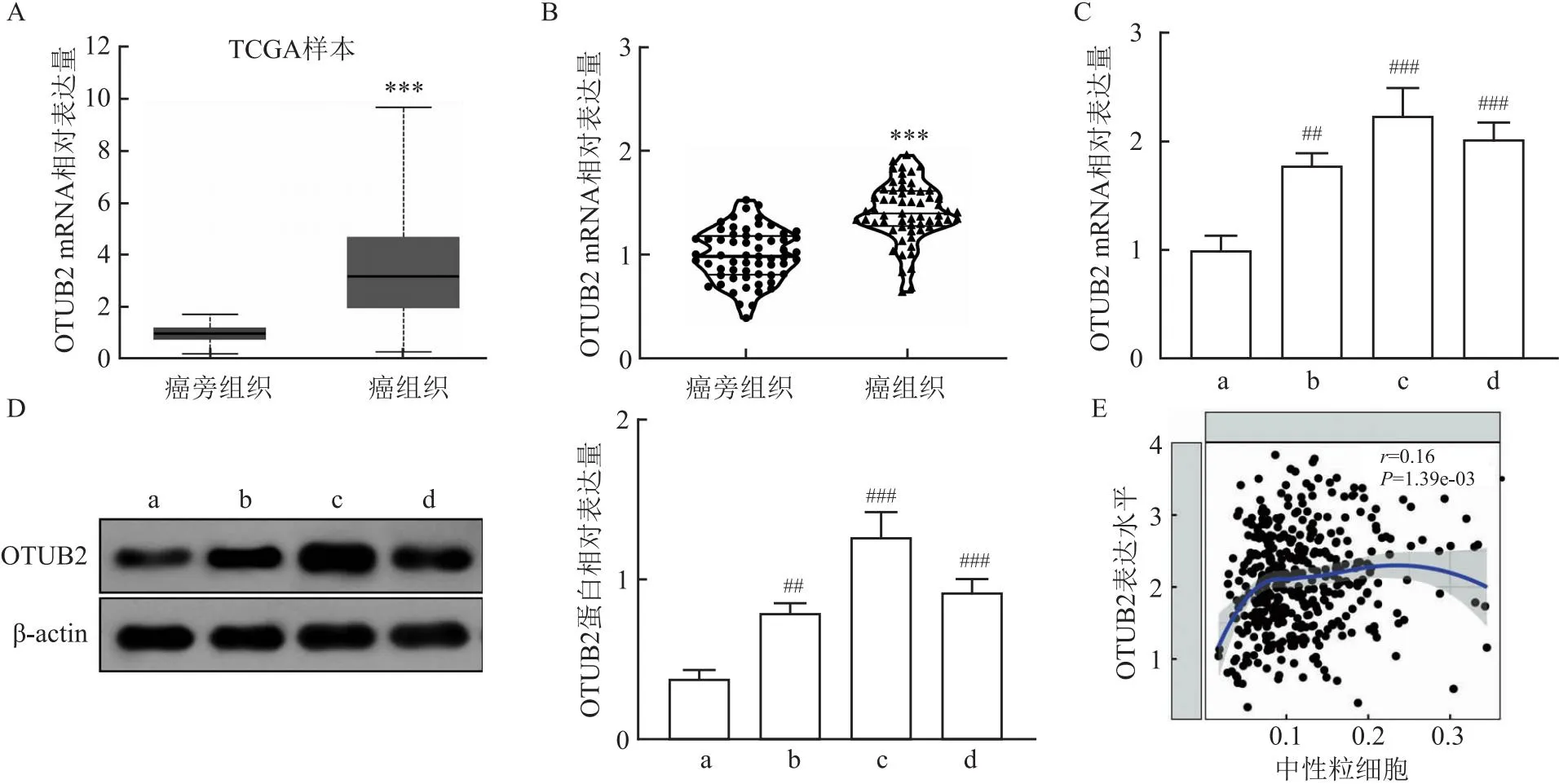
图2 OTUB2在CRC组织和细胞中的mRNA和蛋白表达以及OTUB2与中性粒细胞的相关性分析
2.3 过表达OTUB2增加NETs的形成并促进CRC细胞活力和侵袭qRT-PCR检测结果显示,过表达OTUB2后OTUB2的mRNA水平高于vector组(t=9.47,P<0.001)(图3A)。ELISA检测结果显示,与vector组相比,OTUB2组MPO-DNA复合物相对表达量和Cit-H3的浓度上调(q=19.29、12.92,均P<0.001)、细胞活力和侵袭能力提高(q=11.11、18.32,均P<0.001);与OTUB2组相比,OTUB2+DNase Ⅰ组MPO-DNA复合物相对表达量和Cit-H3的浓度降低(q=13.33、8.88,均P<0.001)、细胞活力和侵袭能力被抑制(q=7.90、11.20,均P<0.01)(图3B-D)。提示过表达OTUB2能够促进NETs的形成并促进CRC细胞的活力和侵袭。
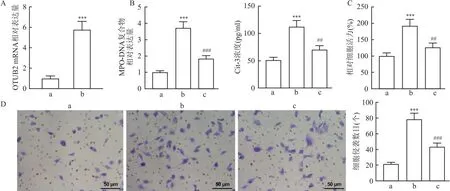
图3 共培养系统中NETs形成以及各组CRC细胞活力和侵袭的检测结果
2.4 敲低OTUB2逆转NETs诱导的CRC细胞活力和侵袭qRT-PCR检测结果显示相对于对照组,si-OTUB2组细胞的OTUB2 mRNA表达降低、细胞活力和侵袭能力也降低(t=4.04,q=7.28、8.56,均P<0.01)(图4A),NETs组细胞活力和侵袭增加(q=14.51、11.61,均P<0.001)。而与NETs组相比,敲低OTUB2后NETs+si-OTUB2组细胞活力和侵袭被抑制(q=11.25、12.38,均P<0.01)(图4B、C)。提示敲减OTUB2能够抑制NETs诱导的CRC细胞的活力和侵袭能力。
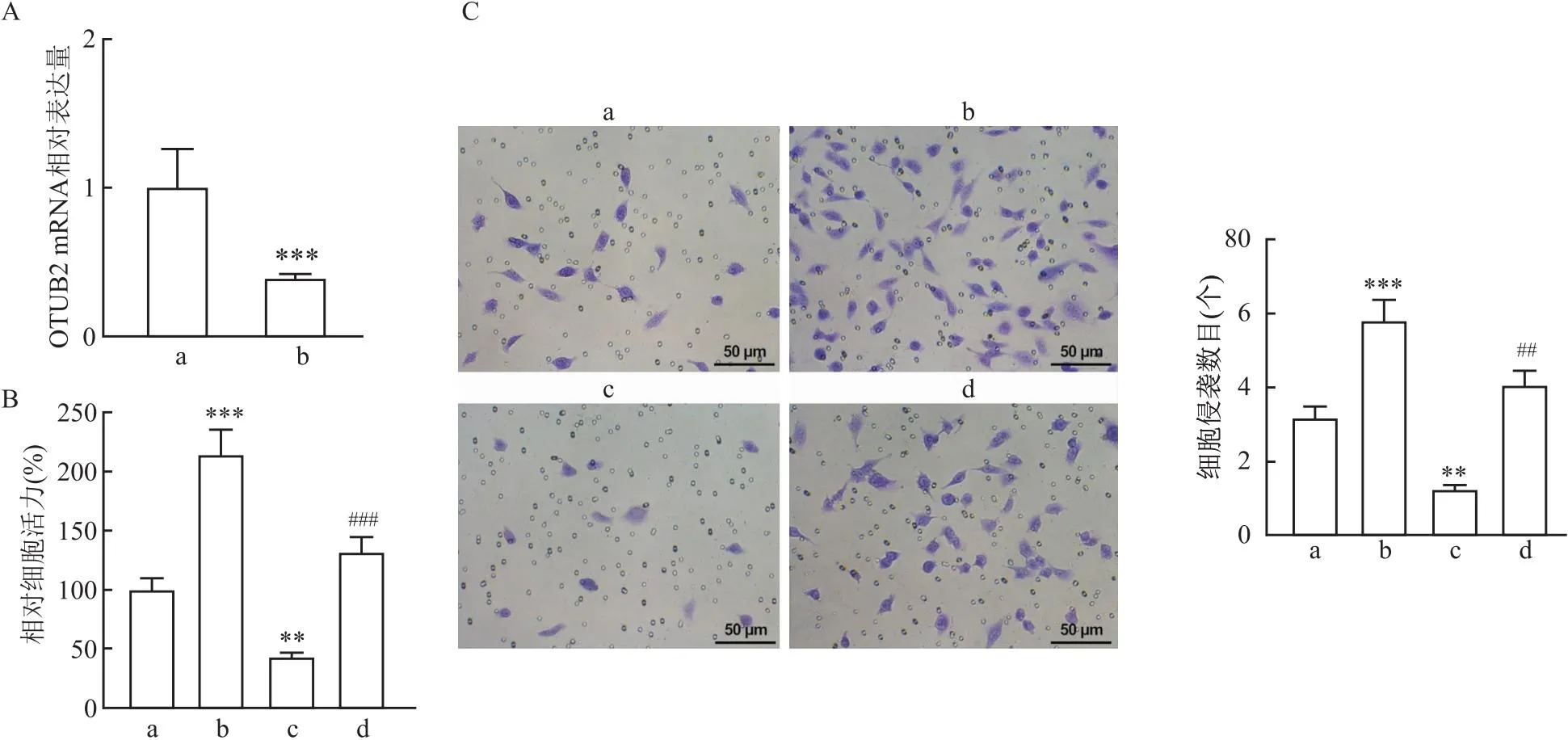
图4 各组细胞活力和侵袭检测结果
2.5 OTUB2直接调控DDX54的表达为了研究OTUB2在CRC中作用的机制,本研究在CRC细胞中敲低OTUB2并做RNA测序(图5A)。将测序差异显著的前100个基因和StarBase中预测的OTUB2的结合蛋白取交集,发现共3个交集分子:DDX54(差异倍数=-1.37013298)、IGF2BP1(差异倍数=1.7614246)、ABHD2(差异倍数=0.9325771)(图5B)。UALCAN数据库预测显示DDX54在CRC癌组织中高表达(P=1.624-12)(图5C),qRT-PCR检测结果显示DDX54在本研究纳入的CRC患者癌组
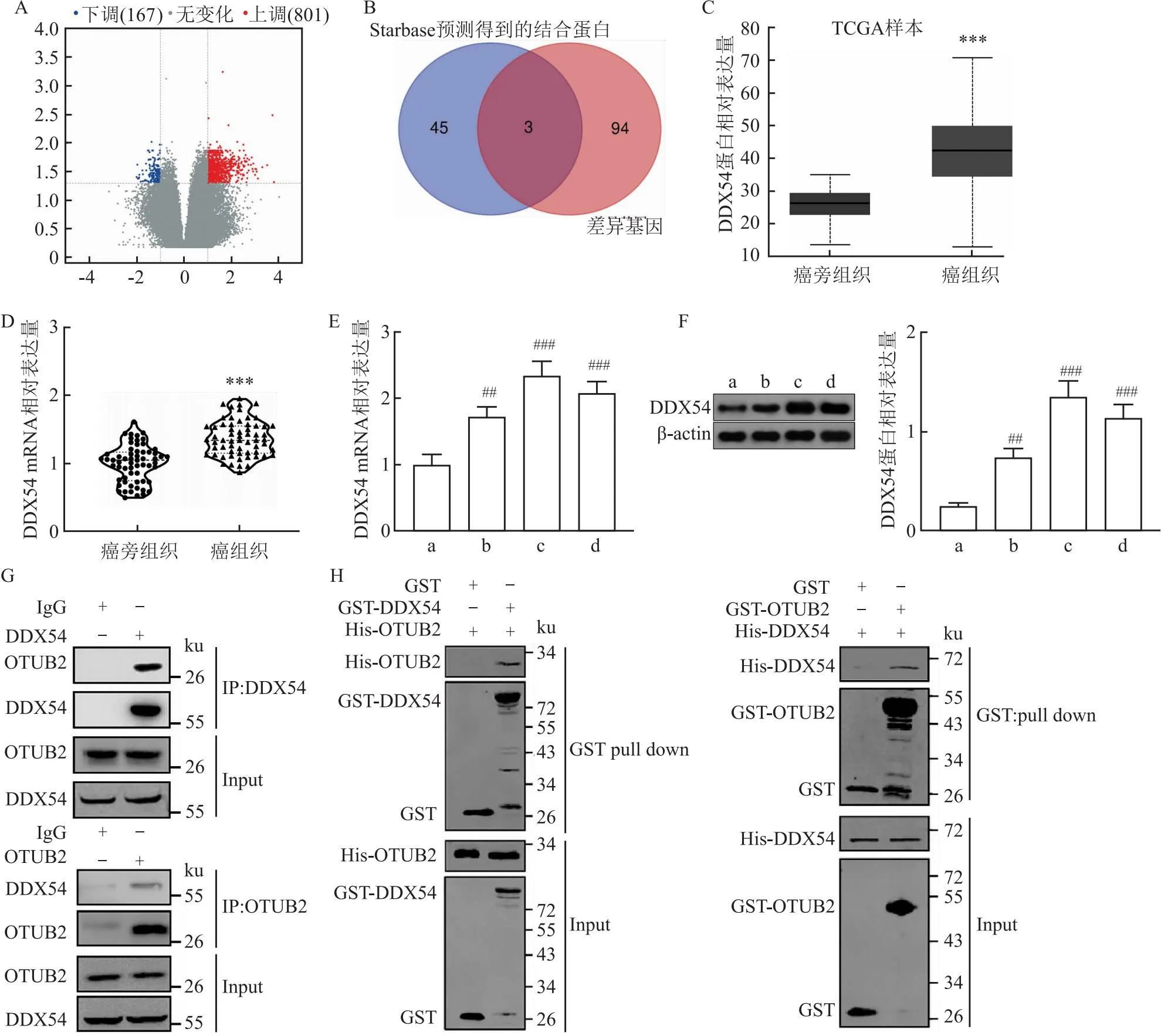
图5 OTUB2和DDX54的结合验证
织中表达上调(t=7.72,P<0.001)(图5D)。与NCM460细胞相比,DDX54 mRNA和蛋白在CRC细胞系中均高表达(q=7.13、13.27、10.70、7.48、16.79、13.59,均P<0.01)(图5E、F)。co-IP实验结果显示,在DDX54抗体免疫沉淀的蛋白质中可检测到OTUB2蛋白,在OTUB2抗体免疫沉淀的蛋白质中可检测到DDX54蛋白,表明二者发生了共沉淀(图5G)。GST-pull-down实验进一步表明,在GST-DDX54融合蛋白中可检测到OTUB2蛋白,在GST-OTUB2融合蛋白中可检测到DDX54蛋白。(图5H)。提示 OTUB2能够与DDX54结合,OTUB2可能是DDX54的去泛素化酶。
2.6 OTUB2抑制DDX54的泛素化对OTUB2和DDX54的泛素化修饰情况进行His pull-down实验检测,结果显示,相对于加入了DDX54和His-Ubi抗体的SW480细胞,加入了DDX54、His-Ubi以及OTUB2抗体后SW480细胞中DDX54的泛素化水平被抑制(图6A)。Co-IP实验检测结果显示,在SW480细胞中敲除OTUB2后,DDX54的泛素化增加,而进一步加入OTUB2抗体后,DDX54的泛素化被抑制(图6B)。这些结果表明OTUB2抑制DDX54的泛素化。

图6 OTUB2影响DDX54的泛素化的检测结果
2.7 敲低DDX54减弱过表达OTUB2诱导的NETs的形成、CRC细胞活力和侵袭图7A检测结果显示,相对于vector组,OTUB2组的OTUB2 mRNA表达增强(t=10.46,P<0.001)。ELISA检测结果显示,与OTUB2+si-NC组相比,敲低DDX54后共培养系统中MPO-DNA复合物相对表达量和Cit-H3的浓度降低(q=12.23、8.00,均P<0.001)(图7B),细胞活力和侵袭被抑制(q=7.22、10.29,均P=<0.01)(图7C、D)。提示敲低DDX54能够抑制OTUB2诱导的NETs形成和降低CRC细胞的活力和侵袭能力。
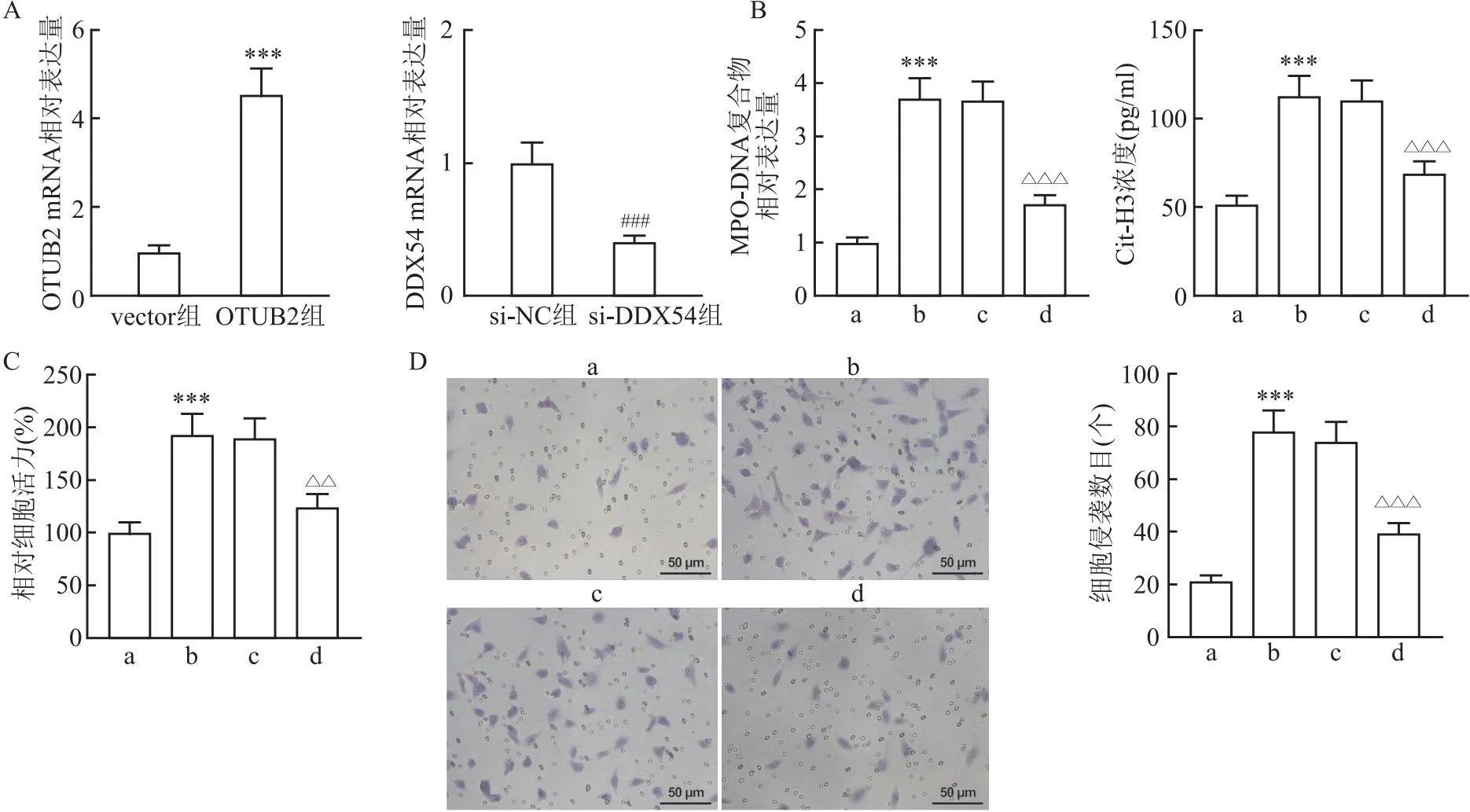
图7 敲低DDX54减弱过表达OTUB2诱导的NETs的形成和CRC细胞增殖和侵袭
3 讨论
本研究结果显示,去泛素化酶OTUB2在CRC中表达增强,OTUB2能够增加NETs的形成并促进CRC细胞的恶性生物学行为,该作用的实现可能与增强DDX54的活性有关。这些发现为进一步研究OTUB2和DDX54之间的相互作用以及它们在CRC治疗中的潜在价值提供了重要依据。
中性粒细胞是数量最多的免疫细胞,与肿瘤细胞协同促进肿瘤的恶性进展[6]。研究[7]表明,高水平的肿瘤浸润性中性粒细胞与CRC的较差预后有关。NETs是中性粒细胞独特的产物,可以保护肿瘤细胞免受宿主免疫系统的攻击从而促进肿瘤的侵袭和转移[8]。此外,还有研究[9]表明靶向抑制肿瘤中NETs的形成或活性是癌症治疗的潜力策略。本研究通过生物信息学在线预测网站显示,OTUB2在CRC中与中性粒细胞呈正相关,体外实验显示,过表达OTUB2促进NETs的形成以及CRC细胞的增殖和侵袭,而敲低OTUB2减弱NETs介导的CRC细胞增殖和侵袭。
泛素-蛋白酶体系统是蛋白质翻译后修饰的主要机制,泛素酶E1、E2、E3通过催化靶蛋白的的泛素化使其降解,而泛素特异性蛋白酶(deubiquitinating enzyme,DUB)通过去除靶蛋白中的泛素链抑制其泛素化从而增强靶基因的稳定性[10]。OTUB2是卵巢肿瘤结构域(ovarian tumor domain,OTU)家族成员之一。研究[11]表明,OTUB2一方面通过促进DNA损伤修复诱导肿瘤免疫逃逸促进肿瘤进展;另一方面通过调控多种信号通路促进肿瘤转移,如OTUB2可以介导Hippo通路的下游分子YAP/TAZ去泛素化。OTUB2去泛素化酶活性在肿瘤中的致癌作用已被广泛报道,且研究[4]显示,敲低OTUB2可以抑制CRC细胞增殖、迁移并促进细胞凋亡,抑制小鼠肿瘤生长。本研究通过生物信息学分析和高通量测序发现DDX54是OTUB2的潜在靶点,qRT-PCR结果表明DDX54在CRC组织和细胞中高表达,co-IP和GST-pull-down实验显示OTUB2可以直接与DDX54结合,His-tag pull down和免疫沉淀分析表明OTUB2通过去泛素化增强DDX54的活性。据报道[12],无论DNA是否存在损伤DDX54均可促进细胞存活,且DDX54 在9种实体瘤中表达上调,可以作为一种新的肿瘤标记物。此外,研究[5,13]表明DDX54在包括CRC在内的多种癌症中表达上调,促进肿瘤的增殖、迁移和侵袭。在本研究中,敲低DDX54能够抑制过表达OTUB2介导的促癌作用。
综上所述,本研究通过实验证明NETs在CRC患者中高表达,并促进促进CRC细胞活力和侵袭;OTUB2通过抑制DDX54的泛素化从而调节NETs的生成和CRC细胞的活力和侵袭。上述研究结果揭示了OTUB2在CRC发生和发展中的关键作用,使其成为CRC的潜在的诊断和治疗靶点。

