SPARCL1在动脉粥样硬化斑块形成中的作用研究
程 煦,陈心严,陈婷婷,程筱雯,朱华庆,葛圣林
动脉粥样硬化(atherosclerosis,AS)及其引起的一系列并发症是目前心血管疾病的主要致病因素,持续威胁人类健康[1]。AS被认为是一种慢性炎症状态,是由于血管平滑肌细胞、内皮细胞、巨噬细胞和其他细胞的不受控增殖所引起的[2-3]。目前,内皮细胞的功能障碍被认为是AS的启动和加重的重要因素[4]。
富含半胱氨酸的酸性分泌蛋白类似蛋白1(secreted protein acidic and rich in cysteines like 1,SPARCL1)也被称作Hevin、SC1以及ECM2,隶属于SPARC家族(参与细胞黏附、迁移和增殖调节的细胞基质蛋白家族)[5]。SPARCL1广泛表达于人体的各个组织中,但在如前列腺癌、非小细胞癌、卵巢癌以及结肠癌中表达下调[6],提示SPARCL1基因可能是一种潜在的肿瘤抑制基因。通过对人类主动脉硬化病变的外周血白细胞转录组的分析[7],以及对人AS斑块的单细胞转录组的研究[8],SPARCL1已被视为与AS有关的新的候选基因,并且确定了SPARCL1在AS组织中的表达。并且发现,SPARCL1在AS斑块中的表达增高[9]。然而SPARCL1参与AS的具体过程和作用尚不清楚。该研究旨在探讨SPARCL1在AS斑块形成中的作用,以期为深入探寻AS发生发展的分子机制以及有效的早期诊疗分子标志物提供新的实验依据。
1 材料与方法
1.1 材料
1.1.1病例资料 研究对象来自于安徽医科大学第一附属医院2022年3月—2023年2月收治的394例已经过临床确诊为AS的患者。对照组来自于同时期年龄、性别匹配的394例健康对照人群,已排除心脑血管疾病,且无其他显著疾病。免疫组织化学的组织切片来自于安徽医科大学第一附属医院病理中心的临床动脉组织标本。本研究所选取的样本均来自安徽省。
1.1.2主要材料 人SPARCL1酶联免疫分析试剂盒(上海江莱生物科技有限公司,货号:0-001493);DNA提取试剂盒、蛋白裂解液、RNA提取试剂盒、逆转录试剂盒、荧光定量PCR试剂盒(山东思科捷生物技术有限公司,货号:AA0902-A、EA0003、AC0202-A、AG0401、AH0301);DAB显色液、通用型二抗、枸橼酸抗原修复粉末(北京中杉金桥生物技术有限公司,货号:PV-6002、SAP9100、ZLI-9066);苏木精(上海碧云天生物技术有限公司,货号:C0105S);3%过氧化氢(H2O2)(福州迈新生物技术开发有限公司,货号:BLK-0001);多克隆抗 SPARCL1抗体(武汉三鹰技术有限公司,货号:13517-1-AP);人外周血单核细胞分离液、人外周血中性粒细胞分离液(北京索莱宝科技有限公司,货号:P8680、P9040);高糖DMEM、小鼠单核巨噬细胞J774A.1(武汉普诺赛生物科技有限公司,货号:PM150210、CL-0370);胎牛血清(南京维森特生物技术有限公司,货号:085-150);BCA定量试剂盒(美国Thermofisher Scientific 公司,货号:23225);ECL反应液(成都正能生物技术有限责任公司,货号:17064);PMSF(北京金克隆生物技术有限公司,货号:CS3215);蛋白Marker(上海生工生物工程有限公司,货号:C600526);过表达质粒:pENTR-CMV-MCS-EF1a-copGFP质粒(货号:LM1479,上海联迈生物工程有限公司);shRNA质粒:pENTR-U6-CMV-EGFP质粒(货号:NTCC510825,上海西图生物科技有限公司)
1.1.3实验仪器 酶标仪(型号:A51119700DPC);恒温细胞培养箱(型号:51023126);NanoDrop one 微量核酸蛋白浓度测定仪(型号:ND-LITE-PR)(美国Thermofisher Scientific 公司);大容量台式高速离心机(美国BECKMAN公司,型号:369003);正置显微镜(德国Leica公司,型号:DM2700-M);荧光定量PCR仪(瑞士Roche公司,型号:Roche LightCycler96)
1.2 方法
1.2.1ELISA测定血清SPARCL1表达水平 所有实验操作均按照SPARCL1酶联免疫分析试剂盒提供的说明书进行。酶标板设置标准孔、样品孔(3个复孔)和空白孔,经加样、加酶、温育、洗涤等步骤后,在酶标仪中读取吸光度值并计算各样品浓度。
1.2.2人外周血中性粒细胞及单核细胞分离 采集AS患者及正常对照人群的新鲜抗凝全血,严格按照人外周血中性粒细胞及单核细胞分离试剂盒说明书进行操作,分离出AS患者及正常对照人群的外周血中性粒细胞及单核细胞。
1.2.3Western blot检测SPARCL1蛋白表达情况 采集细胞后对细胞进行裂解、离心,得到细胞蛋白液。随后使用BCA法对得到的蛋白液进行定量,计算出各样品的蛋白浓度,将各样品浓度调整相同,经过制胶、电泳、转膜、封闭以及4 ℃孵育一抗(多克隆抗SPARCL1抗体,1∶200)12 h和室温孵育二抗(通用型二抗,1∶5 000)2 h,最后经过显影得到SPARCL1的蛋白条带并拍照记录。
1.2.4免疫组织化学实验(immunohistonchemistry,IHC)评估SPARCL1蛋白在AS斑块区的表达水平 将AS斑块区组织石蜡切片分别置于二甲苯溶液、70%乙醇、85%乙醇、95%乙醇、无水乙醇、纯水中进行脱蜡。随后在枸橼酸钠缓冲液中修复抗原。加入适量内源性过氧化物酶阻断剂室温孵育10 min。孵育结束后用PBS轻微冲洗3次,每次2 min。滴加适量多克隆抗SPARCL1抗体(1∶200)覆盖全部组织,37 ℃孵育60 min,PBS冲洗3次,滴加通用型二抗,室温孵育20 min,加入新鲜配置DAB显色液,室温孵育6 min,自来水冲洗后苏木精复染20 s。封片、观察。
1.2.5SPARCL1重组腺病毒包装及验证 合成SPARCL1 短发夹RNA(short hairpin RNA,shRNA)反向互补引物以及SPARCL1 编码序列(coding sequence,CDS)构建目的基因质粒,随后将目的基因序列重组至腺病毒载体,获得过表达和抑制表达重组腺病毒质粒,对重组质粒进行酶切,随后进行转染,转染操作严格按照转染说明书进行,对获得的初级病毒液进行扩增、纯化,得到SPARCL1过表达及抑制表达的重组腺病毒。在6孔板中培养小鼠巨噬细胞(J774A.1),待细胞长至60%时将病毒注射入6孔板内(每孔5 μl),板内设置空白对照,继续培养,分别在24、48 h时荧光下拍照,观察转染效率。在60 h时收集细胞,提取细胞蛋白测量SPARCL1蛋白表达量并进行对比验证。
1.2.6细胞划痕实验检测SPARCL1对细胞增殖和迁移的影响 在细胞培养皿中培养小鼠巨噬细胞(J774A.1),待细胞铺满培养皿后均匀转入细胞6孔板,待细胞长至60%每孔时分别于不同孔注入SPARCL1干扰病毒、SPARCL1过表达病毒。待细胞均匀铺满6孔板后(约48 h),使用200 μl枪头垂直于板面在6孔板中划出直径约1 mm的直线,PBS清洗6孔板以洗去游离细胞,加入细胞专用无血清培养基培养,在划痕后的0、12、24 h分别在显微镜下拍照记录每孔划痕直径。
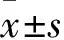
2 结果
2.1 研究对象的一般特征及SPARCL1在血清中的表达情况患者组与对照组男女所占比例均分别为54.8%及45.2%,平均年龄均为50.02岁。两组研究对象的性别、年龄差异无统计学相关性,组间具有可比性。ELISA检测结果显示,患者组与对照组的血清SPARCL1浓度差异有统计学意义(P<0.01),即AS患者血清SPARCL1表达明显低于正常对照。见表1。
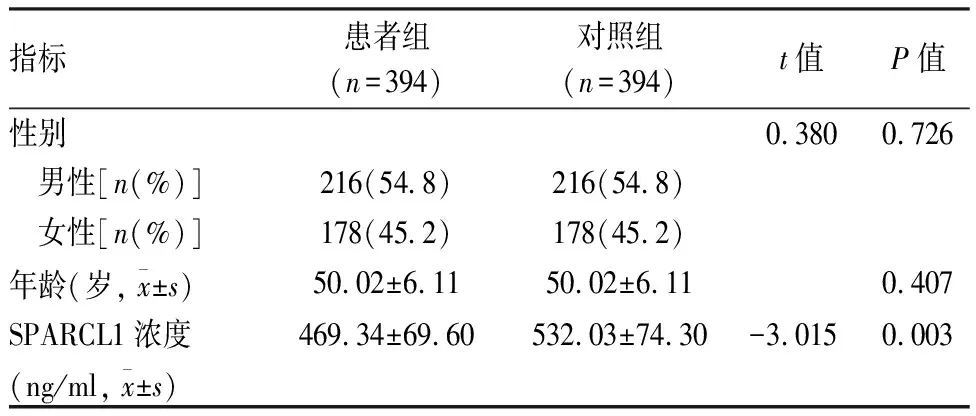
表1 研究对象一般特征及SPARCL1血清浓度的比较
2.2 SPARCL1在AS斑块中的表达情况对AS斑块病变动脉组织免疫组织化学染色(SPARCL1呈棕黄色),AS患者的粥样硬化斑块部位的SPARCL1的表达量高于邻近正常动脉组织,且主要表达在泡沫细胞胞质(图1)。通过对比正常动脉和病变动脉的免疫组织化学染色发现,相比于正常对照人群,AS患者血清中SPARCL1表达量下降(t=2.97,P<0.05)。
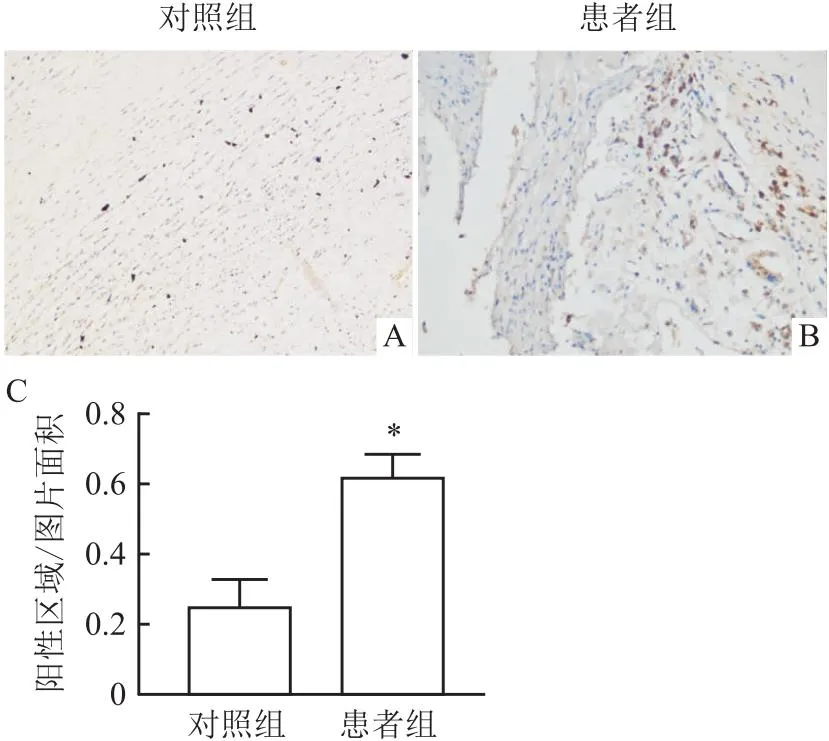
图1 SPARCL1在AS病变部位(B)以及正常动脉组织(A)中表达的IHC染色图×200以及免疫组化SPARCL1表达量对比统计图(C)
2.3 AS患者外周血中性粒细胞及单核细胞SPARCL1蛋白表达情况AS斑块部位的成分细胞主要源于血液中的单核细胞和中性粒细胞的募集,Western blot 检测结果显示,两组外周血中性粒细胞及单核细胞均有SPARCL1表达,并且AS患者的SPARCL1蛋白表达量均低于对照组(t=3.05、2.83,均P<0.01)(图2)。
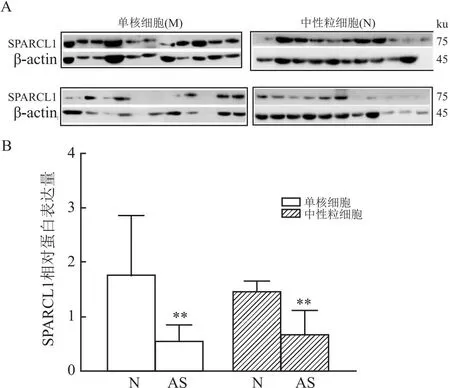
图2 两组细胞SPARCL1蛋白表达量的比较
2.4 SPARCL1过表达及抑制表达重组腺病毒的包装效果验证靶细胞感染24、48 h后,分别置于荧光显微镜下观察并拍照,可见细胞中有荧光显示,且48 h荧光数量>24 h。说明SPARCL1过表达及抑制表达重组腺病毒感染成功(图3)。随后培养至60 h提取细胞蛋白进行Western blot实验检测SPARCL1蛋白表达量,结果显示,用SPARCL1过表达重组腺病毒感染的J774A.1细胞可观察到SPARCL1蛋白表达水平上升(t=-2.19,P<0.05),用
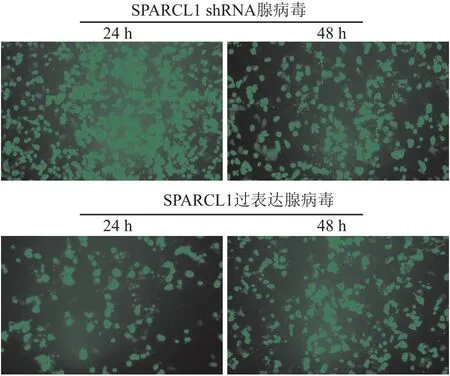
图3 腺病毒感染后荧光显微镜下拍照 ×20
SPARCL1重组腺病毒感染J774A.1细胞可观察到SPARCL1蛋白表达水平降低(t=2.64,P<0.01),表明SPARCL1过表达和抑制表达重组腺病毒包装成功(图4)。
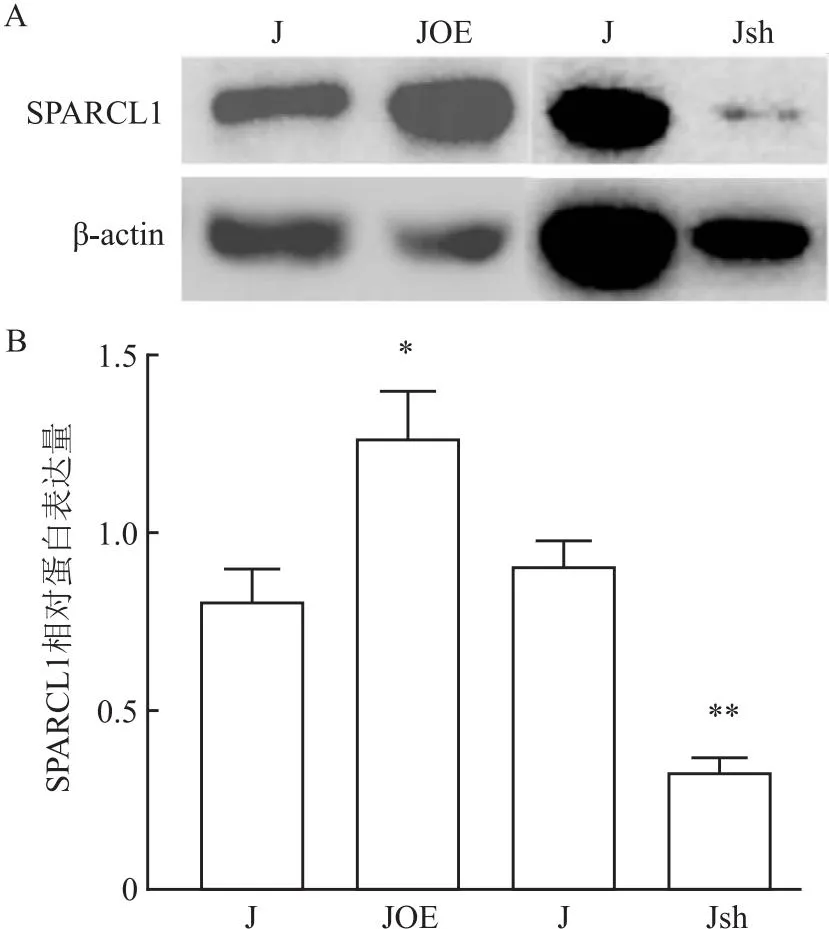
图4 两组细胞感染SPARCL1重组腺病毒后SPARCL1蛋白表达量的比较
2.5 SPARCL1对巨噬细胞迁移的影响细胞划痕实验结果显示,SPARCL1抑制表达组的迁移距离低于对照组(t=3.12、-2.58,均P<0.05)。这表明SPARCL1参与到了巨噬细胞的迁移过程(图5)。
3 讨论
SPARCL1在1990年首次在大鼠中枢神经系统发现,并命名为SC1[5]。随后又从非小细胞肺癌的内皮细胞和人扁桃体淋巴组织的高内皮小静脉中克隆了Hevin的基因[10-11]。SPARCL1定位于染色体4q22-25,横跨约47 kb的基因组。SPARCL1由N端酸性结构域、卵泡抑制剂样结构域以及细胞外钙离子结合域[9]组成。
目前关于SPARCL1的研究主要在其与癌症的关系,其与AS之间关系的研究尚少。在以往研究[12]显示,SPARCL1与血管壁稳定的维持有关。而AS发生的重要环节之一是血管内皮功能的障碍,因此SPARCL1可能参与AS发生过程。并且既往有学者[13-15]认为AS是一种血管壁的癌症,它们在一些病理过程中较为相似,如:① AS和癌症都有不受控制的细胞增殖[15];② 两种疾病都有细胞粘附分子的变化,分别与动脉粥样斑块的形成和肿瘤细胞的迁移和侵袭有关[14];③ 都有相应的炎症表现[13];④ 都与氧化应激密切相关[13];⑤ 有血管生成和细胞凋亡。提示SPARCL1有可能作为一种血管保护因素参与抑制AS的发生发展。
在2009年的一个通过对人类主动脉硬化病变的外周血白细胞转录组的研究[7]中,SPARCL1就被视为与AS有关的新的候选基因。最近,在对人类AS斑块的单细胞转录组的研究[8]中显示,SPARCL1在AS组织中表达。本研究也显示SPARCL1在AS斑块中表达升高,且 AS患者的血清SPARCL1水平明显低于正常人,提示SPARCL1很可能参与AS的发生发展过程。
此外,本研究显示AS患者及正常对照的外周血中性粒细胞及单核细胞均有SPARCL1表达,并且AS患者的表达量低于健康对照,免疫组织化学染色发现SPARCL1主要表达于AS斑块中的泡沫细胞,这表明AS斑块中高表达SPARCL1可能是由于在AS的炎症过程中,将血液中的单核细胞和中性粒细胞募集至斑块部位并随后演变为泡沫细胞。
SPARCL1具有调节细胞的黏附、迁移和增殖的作用[5]。巨噬细胞在AS发生中的作用不可忽视,而SPARCL1是否参与了巨噬细胞在斑块中的增殖或迁移过程,对斑块形成的影响还需要进一步证明。本研究结果显示,抑制SPARCL1表达的巨噬细胞迁移率降低,该结果为SPARCL1参与AS的具体过程提供了研究方向。
综上所述,本研究证明AS病变部位泡沫细胞高表达的SPARCL1有可能来自于外周血单核细胞和中性粒细胞的代偿性募集,SPARCL1可能作为血管保护因子参与抑制AS斑块的发生发展。后续将通过继续完善细胞表型实验,建立SPARCL1基因敲除小鼠模型以明确SPARCL1影响AS斑块形成的具体机制,探讨SPARCL1成为AS诊疗新靶点的可能性。

