鱼用降肝脂益生菌的筛选及鉴定
刘洪瑞,王 涛,孙家塍,张晓月,孙金生,左志晗
(1.天津师范大学生命科学学院,天津 300387;2.天津师范大学天津市动植物抗性重点实验室,天津 300387)
近年来,由于高密度水产养殖的迅速发展,片面追求高生长速度而过度投饵或大量使用高能量高蛋白饵料,加剧了养殖鱼类如草鱼、鲫鱼、鲤鱼等脂肪肝病的发生.为了防治这一疾病,急需找到安全有效的解决办法,目前通常是采用调节饮食的方式改善肝脏脂代谢异常.益生菌因其安全有效的特点广泛应用于水产养殖中,益生菌可以增强水产动物抗病能力,促进生长发育,改善水产养殖环境,提高养殖的产量和质量[1],但采用益生菌调节水产养殖动物的脂代谢、防治脂肪肝方面的研究及应用目前尚不足.现已有少量关于乳酸菌降低动物肝脏脂肪沉积、改善肝脏脂质代谢的研究报道.如丁淑娟[2]通过测定体外清除胆固醇能力、产胆盐水解酶活性以及胃肠液耐受能力对34株供试菌进行筛选,最终得到了2 株降脂乳酸菌,它们可显著降低高脂血症大鼠的体质量、肝脏质量、血脂以及粪便脂质含量.Hou 等[3]研究发现,乳杆菌Lactobacillus delbrueckii 具有良好的肠道存活和定植能力,在猪日粮中添加该菌可以降低猪血清中的胆固醇、低密度脂蛋白和甘油三酯.田佳鑫[4]用干酪乳杆菌(L.casei)、植物乳杆菌(L.plantaraum)、鼠李糖乳杆菌(L.rhamnosus)包被高脂饲料并将其饲喂给乌鳢,能够缓解由高脂饲料导致的乌鳢脂肪肝.
益生菌因其高效、成本低、环境友好等特点被水产养殖行业广泛应用,但非鱼源性益生菌很难在水产养殖中高效发挥作用,因此理想的益生菌应该来自于鱼类肠道[5].Bäckhed[6]第一次提出了“肠道菌群可作为一种环境因子来调节机体脂肪的储存”的观点.本研究以从半滑舌鳎(Cynoglossus semilaevis Gunther)肠道中分离出来的13 株益生菌为实验菌株,通过对其体外产胆盐水解酶(bile salt hydrolase,BSH)能力和体外降胆固醇能力的测定与比较,初步筛选出具有降脂作用的益生菌,进一步通过高脂斑马鱼的饲喂实验,验证其在水产动物体内的降脂作用效果.研究旨在为缓解鱼类肝脏脂肪堆积筛选有效的益生菌菌株,进而为解决水产养殖过程中鱼类脂肪肝的问题提供参考.
1 材料与方法
1.1 实验菌株
本研究所用的13 株菌均为实验室前期从半滑舌鳎肠道中分离获得,菌株编号分别为SC-01、SC-02、SC-03、SC-04、YZ-01、YZ-02、YZ-03、ND-1、U2、U3、SH-1、M4、YA6.
1.2 培养基及溶液的配制
BSH 筛选培养基:MRS 液体培养基中添加2%琼脂、0.3%牛胆盐、0.2%巯基乙酸钠、0.37 g/L 氯化钙.MRSTHIO-OX-CHOL 培养基:MRS 液体培养基中添加0.3%牛胆盐、0.2%巯基乙酸钠、0.1 mg/mL 胆固醇溶液.
胆固醇溶液:取胆固醇粉末0.5 g,用无水乙醇加热溶解并定容至50 mL,获得10.0 mg/mL 的胆固醇溶液,用0.45 μm 的微孔滤膜除菌,按1%的量加入到无菌MRS 液体培养基中,获得0.1 mg/mL 的胆固醇溶液.邻苯二甲醛工作液:称取邻苯二甲醛50 mg,用无水乙醇定容到50 mL,获得1 mg/mL 的邻苯二甲醛工作液,冷藏备用.混合酸∶冰乙酸与浓硫酸按照体积比为1 ∶1 的比例混匀.
1.3 高产胆盐水解酶菌株的筛选
将灭菌的BSH 筛选培养基倒入无菌平板中,待培养基凝固后将直径4 mm 的无菌滤纸片均匀放置在培养基上.将活化好的待测菌液10 μL 缓慢加在无菌滤纸片上,待菌液完全吸收后,37 ℃厌氧培养72 h,观察滤纸片周围是否出现白色沉淀物,有白色沉淀即可初步判定该菌株产生了BSH.
1.4 用邻苯二甲醛法分析菌株体外降胆固醇的能力
绘制标准曲线:取5 支试管按照1—5 编号,按顺序分别加入0、0.1、0.2、0.3、0.4 mL 的胆固醇溶液,再按照顺序分别加入冰醋酸0.5、0.4、0.3、0.2、0.1 mL,每支试管再分别加入邻苯二甲醛试剂,振荡混匀.静置10 min 后分别加入混合酸4.0 mL,混合均匀,在室温下静置10 min.将反应液置入96 孔板中,以胆固醇的质量浓度为横坐标,OD550值为纵坐标绘制标准曲线.
样品OD 值的测定:将菌株的菌悬液按照3%的接种量添加到10 mL 的MRS-THIO-OX-CHOL 培养基中,37°C 培养24 h.将刚接种菌的培养基在9 000 r/min条件下离心10 min,取上清液0.25 mL,加入邻苯二甲醛工作液0.1 mL,充分振荡后静置10 min.加入混合酸溶液2.0 mL,室温下静置10 min,将反应液置入96 孔板中,测定其OD550.分别于6、12 和24 h 时取样,按照上述邻苯二甲醛法测定发酵液OD 值.根据胆固醇标准曲线的拟合方程确定发酵液中胆固醇的含量,胆固醇脱除率的计算公式为
式中:A 为菌株发酵后上清液中的胆固醇含量;B 为菌株发酵前上清液中的胆固醇含量.
1.5 菌株对斑马鱼的降脂作用
1.5.1 斑马鱼高脂饲料的制备
100 g 基础饲料中包含:酪蛋白40 g、明胶10 g、糊精35 g、豆油6 g、赖氨酸0.33 g、VC 磷酸酯0.1 g、多维0.2 g、多矿0.2 g、磷酸二氢钙2 g、氯化胆碱0.2 g、海藻酸钠2 g、微晶纤维素3.97 g.粗蛋白总量为42.19 g,粗脂肪总量为6.09 g,每克饲料能量为18.55 kJ.
100 g 高脂饲料中包含:酪蛋白40 g、明胶10 g、糊精25g、猪油8g、豆油8g、赖氨酸0.33g、VC 磷酸酯0.1 g、多维0.2 g、多矿0.2 g、磷酸二氢钙2 g、氯化胆碱0.2 g、海藻酸钠2 g、微晶纤维素3.97 g.粗蛋白总量为42.19 g,粗脂肪总量为15.77 g,每克饲料能量为20.85 kJ.
1.5.2 斑马鱼养殖及分组
将斑马鱼分成15 组(每组设置3 个平行),每组150 条,分别设置空白组(control)、高脂组(HF)和实验组.实验组饲喂高脂加菌饲料(进行13 株候选菌的饲喂及浸浴,浓度为3×105cfu/mL),空白组饲喂基础饲料且不浸浴益生菌,高脂组饲喂高脂饲料且不浸浴益生菌.从早上九点和晚上九点进行饲喂,周期为30 d.由于养殖系统的水会自动持续更新流出,所以实验组每隔2 h 向水中补充1 次益生菌.
浸浴菌泥的制备:将13 株菌分别活化至1×105cuf/mL,取10 mL 活化菌液于15 mL 离心管中,5 000 r/min、4 ℃下离心10 min,弃去上清,放置于4 ℃冰箱中备用,时间不超过48 h.
饲喂饲料的制备:将13 株菌分别活化添加到饲料中,使饲料中的菌含量达到1×107cfu/g,静置使饲料表面干燥松散后喷入10%的海藻酸钠溶液,充分搅拌,使海藻酸钠包裹在饲料表面,防止饲料在水中快速溶解.配制好的饲料置于4 ℃冰箱备用,放置时间不能超过48 h,最好现配现用.
斑马鱼饲喂养殖30 d 后,对各组斑马鱼肝脏样品进行采集,过程如下:用无菌解剖刀,在无菌状态下取出整个肝脏,装入2.0 mL 无酶冻存管中,放置于冰上.将取下的肝组织放入加入了4%多聚甲醛的无酶15 mL离心管中固定,将分装好的样品立即放入-80 ℃低温保存,使用多聚甲醛固定的肝组织常温保存,委托武汉塞维尔公司制做油红O 染色石蜡包埋冷冻切片.
1.6 菌种鉴定
DNA 模板的制备:将待测菌株在固体培养基上多次划线纯化后,接种于相应的液体培养基中,置于摇床上180 r/min 培养24 h.在超净工作台中取培养后的1 mL 菌液于灭菌离心管中,8 000 r/min 离心3 min;在超净工作台中倒去上清,加入0.1 mL 无菌水,振荡摇匀后,100 ℃水浴10 min;于12 000 r/min 离心10 min,上清液即为DNA 模板,-20 ℃保存.
用细菌鉴定通用引物进行PCR 扩增待鉴定菌株的16S rDNA 片段,引物27F 的序列为5′-AGAGTTTGATCCTGGCTCAG-3′,1492R 的序列为5′-GGTTACCTTGTTACGACTT-3′.
选择50 μL 反应体系,包含25 μL 的2×Taq Mix、19 μL 的ddH2O、2 μL 的27F、2 μL 的1492R、2 μL 的DNA.PCR 反应程序:以提取的DNA 为模板,按照PCR 反应体系将试剂依次添加至200 μL 的PCR 管中,涡旋仪振荡混匀.PCR 反应条件:预变性94 ℃,4 min;变性94 ℃,30s;退火55 ℃,1 min;延伸72 ℃,90 s;延伸72 ℃,10 min.变性、退火、延伸设置为35个循环.
配制1%的琼脂糖电泳凝胶进行PCR 产物检测.于100 mL 锥形瓶中加入600 μL 的50×TAE、30 mL 蒸馏水和0.3 g 琼脂糖,微波炉加热完全溶解,降至室温后,加入1 μL 的EB 混匀,将胶小心倒入事先插好梳子的制胶板中,避免起泡,室温静置,待其凝固,拔出梳子,将胶移入电泳槽缓冲液内.第一个胶孔加5 μL的Marker,后面分别加5 μL 的PCR 产物,连接电源,设置电压95 V,时间30~40 min.电泳结束后,将胶取出置于紫外凝胶成像仪下观察.
序列测定比对:将扩增成功的PCR 产物委托北京金唯智公司进行双向测序,引物为27F 和1492R.测得序列在GenBank(www.ncbi.nlm.nih.gov)中进行blast序列比对分析,确定菌株所在菌属,并用MEGA 7 构建菌种进化树.
2 结果与分析
2.1 体外具有降脂作用菌株的筛选
2.1.1 菌株产胆盐水解酶的能力
胆盐水解酶可以水解胆盐,在益生菌降胆固醇机制中发挥重要作用[7].将菌株点种在含胆盐及无水氯化钙的培养基上,根据产生白色沉淀圈的大小可以初步判断益生菌产BSH 能力,结果如图1 所示.由图1可以看出,13 株菌中,菌株ND-1 和U3 产BSH 能力最强,沉淀圈大小为1.3 cm;其次是菌株SC-03,沉淀圈大小为1.1 cm,YZ-01 沉淀圈大小为0.9 cm.
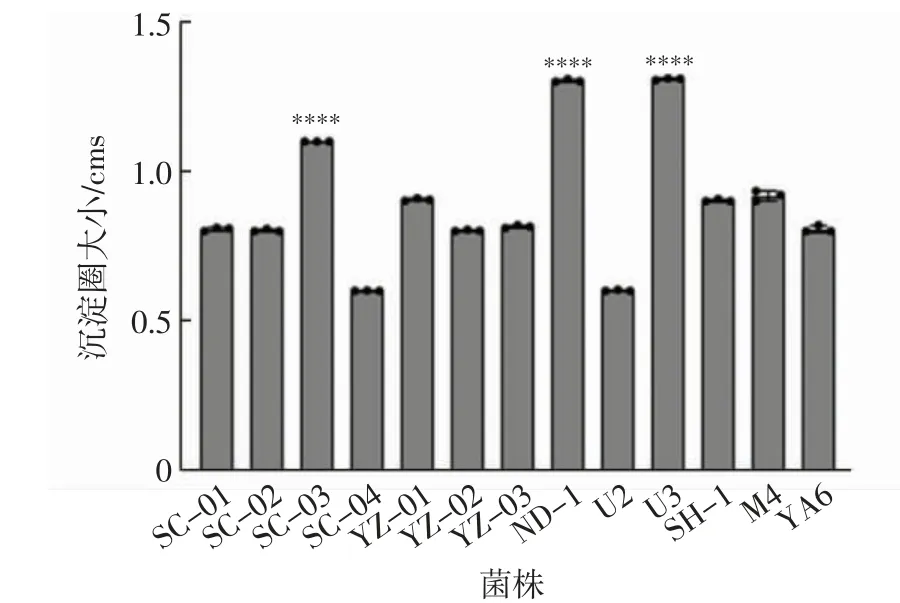
图1 13 个菌株的产胆盐水解酶能力Fig.1 Production capacity of BSH of the 13 strains
2.1.2 菌株降解胆固醇的能力
对13 株菌降解胆固醇的能力进行测定,各菌株在不同时间的胆固醇去除率如图2 所示.由图2 可以看出,菌株YA6 在6 h 的降脂效果最显著,其胆固醇去除率为91.43%;其次为菌株ND-1,24 h 的胆固醇去除率为89.76%;菌株M4 在6 h 的胆固醇去除率为80.77%,菌株U3 在24 h 的胆固醇去除率为76.67%.
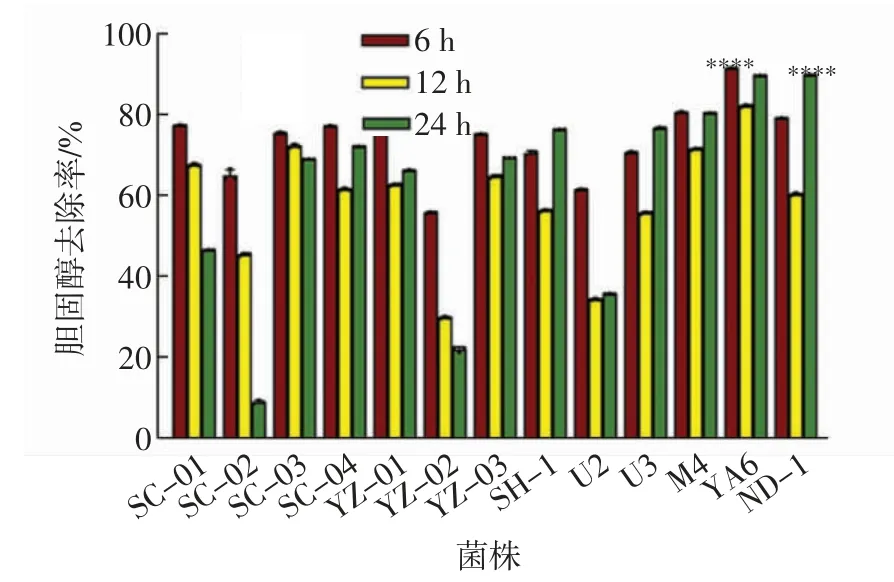
图2 菌株体外胆固醇去除率Fig.2 In vitro cholesterol removal rate of the 13 strains
2.2 菌株体内的降脂作用
2.2.1 菌株对斑马鱼体质量的影响
为了探究13 株菌的体内降脂能力,建立高脂饮食斑马鱼模型,分析13 株菌对斑马鱼脂代谢水平的影响,结果如图3 所示.由图3 可以看出,用不同菌株干预30 d 后,与高脂组相比,添加了菌株U2、SC-04、YZ-02、ND-1 的实验组中斑马鱼的体质量均显著降低(P <0.000 1);其次是菌株U3 的降体质量效果也较显著.U2 组的体质量降低率最高,为48.18%;SC-04 组、ND-1 组和YZ-02 组的体质量降低率分别为32.97%、31.05%和21.63%.以上结果初步说明这4 株菌对斑马鱼机体的脂代谢存在影响.
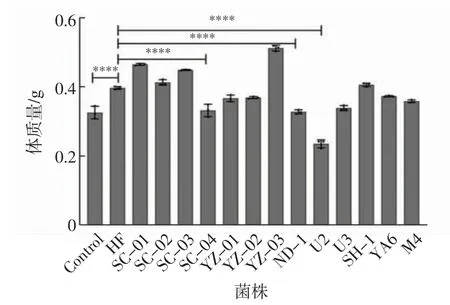
图3 斑马鱼体质量Fig.3 Body mass of zebrafish
2.2.2 菌株对斑马鱼肝脏甘油三酯含量的影响
肝脏是脂质稳态调控的重要组织器官,基于益生菌对正常饮食和高脂饮食斑马鱼体质量的影响,对斑马鱼肝脏中甘油三酯的浓度进行评估,结果如图4 所示.由图4 可以看出,与高脂组相比,添加了菌株SC-01、YZ-02、U3 和SH-1 的实验组中斑马鱼肝脏的甘油三酯浓度显著降低.YZ-02 组降低效果最明显,甘油三酯同高脂组相比降低了81.25%;SH-1 组、U3 组、SC-01 组、ND-1 组分别降低了53.68%、49.33%、47.56%、41.88%(P<0.000 1).
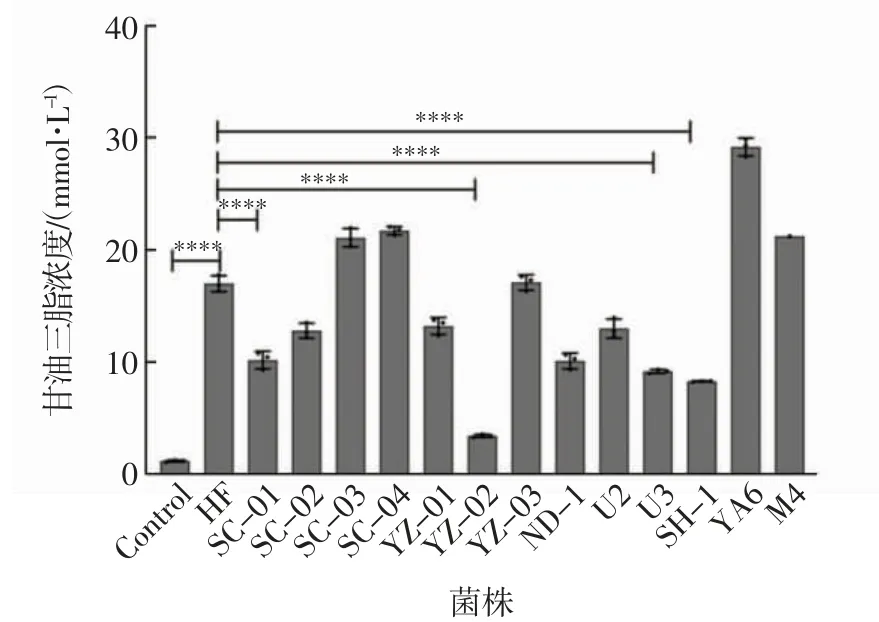
图4 斑马鱼肝脏甘油三酯含量Fig.4 Liver triglyceride content of zebrafish
2.2.3 斑马鱼肝脏油红O 染色切片
为了进一步检测13 株菌改善斑马鱼肝脏脂滴沉积作用的效果,取斑马鱼肝脏组织进行油红O 染色、石蜡固定和冰冻切片,镜下观察结果如图5 所示.

图5 斑马鱼肝脏油红O 染色切片Fig.5 Oil red O-stained sections of zebrafish liver
由图5 可以看出,添加菌株YZ-01、ND-1、U3 的3个实验组中,肝脏脂滴数量及大小明显低于高脂组的数值,说明菌株YZ-01、ND-1、U3 可以有效缓解脂肪在肝脏中的沉积.
2.3 菌株鉴定
针对降脂效果明显的菌株U3 和ND-1,使用试剂盒提取基因组DNA 片段,以其为模板扩增16S rDNA基因序列,将扩增产物滴加于1%的琼脂糖凝胶样品孔中进行电泳检测,获得了大约1 500 bp、较为均一的片段.将PCR 扩增产物进行送测,所得测序结构在NCBI 数据库进行同源性序列比对,根据比对结果可知,菌株U3 与鼠李糖乳酸杆菌(Lacticaseibacillus rhamnosus strain 5681,MT463591)的相似度为98%,菌株ND-1 与马胃葡萄球菌(Staphylococcus equorum strain Y15,JX134628)的相似度为100%.
对菌株U3 和ND-1 进行系统发育学分析,以16S rDNA 基因序列为遗传标记构建系统发育进化树,结果如图6 所示.由图6 可以看出,菌株U3 与鼠李糖乳酸杆菌聚为一支,置信度为98%;菌株ND-1 与马胃葡萄球菌聚为一支,置信度为100%.
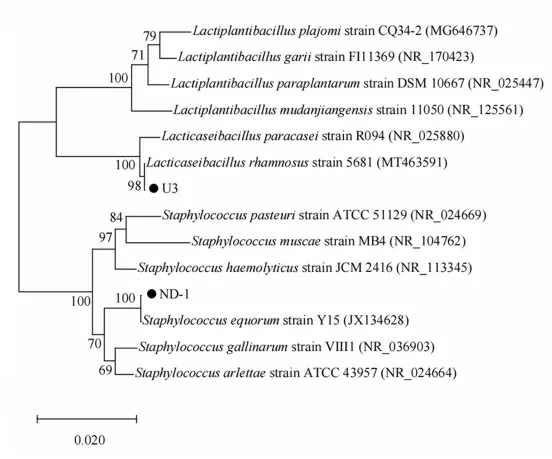
图6 菌株进化树Fig.6 Strain evolutionary tree
3 讨论与结论
鱼类脂肪肝疾病是水产养殖中最常见的营养性疾病,肝脏脂肪沉积是诱导脂肪肝发病的主要原因[8].本研究对前期从半滑舌鳎中分离获得的水生动物肠道菌株进行筛选,初步获得了安全有效的具有降脂作用的益生菌菌株.首先考察候选菌株的体外产胆盐水解酶的能力,胆盐水解酶属于N 端亲水水解酶超家族,在N 端半胱氨酸残基催化核心部位具有αββα 结构[9],能够降解胆汁酸,对胆固醇的消化吸收及体内的胆固醇消耗具有一定的作用,已被认定是潜在的肥胖治疗靶点[10].因此,本研究以菌株高产胆盐水解酶作为体外筛选具有降脂作用菌株的首要指标对菌株进行测试,结果显示菌株ND-1 和U3 产胆盐水解酶的能力最强,证明这2 株菌可能通过产生胆盐水解酶这个靶点降低鱼体的胆固醇沉积.Michael 等[11]研究发现,植物乳杆菌Lab4 和CUL66 具有产胆盐水解酶的能力,将其饲喂给小鼠后小鼠的粪便中胆汁酸的含量增加,由此推测2 株菌通过在宿主肠道中产生的胆盐水解酶介导了胆汁酸的净化,从而增加胆汁酸从头合成,最终使胆汁酸含量增加.刘煜珺[8]研究发现,将具有产胆盐水解酶能力的植物乳杆菌Y44 饲喂给高脂膳食小鼠能够显著降低小鼠血清胆固醇、甘油三酯及低密度脂蛋白,并可以缓解小鼠肝脏脂肪空泡的产生.Ma 等[12]研究发现,高产胆盐水解酶的乳酸菌可以通过加强宿主消化系统结合态胆汁酸的分解,抑制胆固醇转运蛋白的表达,降低宿主饮食中胆固醇等脂类物质的吸收,与本实验结果较为相似.
目前,有多项研究证实了益生菌对非酒精性脂肪肝(NAFLD)具有积极作用[13].如曹少锋等[14]研究发现,在高脂饮食诱导的NAFLD 模型中,与对照组(给予生理盐水灌胃)相比,实验组小鼠(给予鼠李糖乳杆菌DM9054 联合植物乳杆菌86066 灌胃)的体质量减轻,血清TG、TC、LDL-C 水平降低,肝脏脂肪变性和炎性细胞浸润的现象显著减少.水产养殖领域中对于益生菌缓解鱼类脂肪肝有少量研究报道,如张震[15]研究发现,将经典益生菌(鼠李糖乳杆菌LGG 和干酪乳杆菌BL23)添加进饲料,益生菌可以通过维护肠道菌群结构的稳定来缓解高脂饮食诱导的鱼类脂肪肝.本研究从半滑舌鳎肠道中分离得到的13 株益生菌中,菌株YZ-02、U2、SC-04 和ND-1 可以减轻斑马鱼的体质量,菌株SC-01、YZ-02、U3 和SH-1 可以降低斑马鱼肝脏中的甘油三酯含量,菌株YZ-01、ND-1 和U3 可有效缓解斑马鱼中脂滴的沉积.综合来看,菌株U3 和ND-1 对斑马鱼肝脏脂肪肝的降脂效果最好,16S rDNA 测序比对以及构建系统发育树结果显示,菌株U3 与鼠李糖乳酸杆菌聚为一支,菌株ND-1 与马胃葡萄球菌聚为一支.上述研究表明,采用益生菌缓解动物体内尤其是肝脏中脂肪的积累具有明显效果.

