基于线粒体Cytb序列的广东地区大刺鳅群体遗传多样性分析?
? 詹华伟 叶树政 陈锭娴 王凯丰 刘兰苑 龚剑 韩崇 李强
摘要:為了解广东地区大刺鳅遗传多样性特征,采集广东地区6个水系(西江、北江、东江、鉴江、漠阳江、韩江)193尾大刺鳅样本,测定其线粒体Cytb序列,并利用MEGA 6.0软件碱基组特点和遗传距离、DNAsp 5.0软件分析各群体的多样性水平和Network 5软件绘制单倍型网络关系图。结果表明:大刺鳅Cytb序列长度1 138 bp,在193尾大刺鳅的Cytb序列中,A、C、T、G占比分别为25.9%、32.7%、27.7%和13.6%,遗传距离为0.000 2~0.013 1,遗传分化指数为0.035~0.866。6个大刺鳅群体共存在38个核苷酸变异位点,定义了20个单倍型,单倍型多样性为0.782,核苷酸多样性约为0.007 2。基于线粒体Cytb序列构建的NJ树显示,广东地区的大刺鳅种群分为Ⅰ和Ⅱ两支。其中,支系Ⅰ包含了西江、北江、鉴江和漠阳江群体的部分样本以及东江和韩江群体的全部样本;支系Ⅱ包含了西江、北江、鉴江和漠阳江群体的部分样本。单倍型网络分析显示,西江水系的群体与东江、韩江以及漠阳江群体的亲缘关系较近,而北江群体与东江、西江群体间遗传分化较大。AMOVA分析表明,77.09%的变异来自于组群内群体间,37.92%的变异来自于群体内。核苷酸错配分析及中性检验结果显示,广东大刺鳅整体及各个群体在历史上均没有发生过明显的扩张。广东各水系的大刺鳅群体遗传多样性水平较低,野生种群的遗传多样性总体呈现下降趋势。
关键词:大刺鳅;遗传多样性;线粒体Cytb序列;亲缘地理
中图分类号:S937; S966.4文献标识码:A文章编号:1006-060X(2024)03-0001-06
Population Genetic Diversity of Mastacembelus armatus in Guangdong Based
on the Mitochondrial Cytb Sequence
ZHAN Hua-wei1,YE Shu-zheng1,CHEN Ding-xian1,WANG Kai-feng1,LIU Lan-yuan1,
GONG Jian2,HAN Chong1,LI Qiang1
(1. School of Life Sciences, Guangzhou University, Guangzhou 510006, PRC; 2. School of Environmental Science and Engineering, Guangzhou University, Guangzhou 510006, PRC)
Abstract: To understand the genetic diversity of Mastacembelus armatus in Guangdong, we sequenced the mitochondrial Cytb genes of 193 individuals of M. armatus from six rivers (Xijiang River, Beijiang River, Dongjiang River, Jianjiang River, Moyang River, and Hanjiang River) in Guangdong. The base composition and genetic distance were analyzed by MEGA 6.0. The diversity of each population was analyzed by DNAsp 5.0 and the haplotype network was established in Network 5. The results showed that the Cytb sequence of M. armatus was 1 138 bp in length. The Cytb sequences of 193 individuals showed the A, C, T and G content of 25.9%, 32.7%, 27.7%, and 13.6%, respectively. The genetic distance was 0.000 2–0.013 1, and the genetic differentiation coefficient was 0.035–0.866. A total of 38 nucleotide variation sites and 20 haplotypes were identified in the six populations of M. armatus, with the nucleotide diversity of 0.007 2 and the haplotype diversity of 0.782. The neighbor-joining tree established based on mitochondrial Cytb sequence showed that the populations of M. armatus in Guangdong were clustered into two clades: I and II. Clade I contained some individuals from Xijiang River, Beijiang River, Jianjiang River, and Moyang River and all the individuals from Dongjiang River and Hanjiang River. Clade II contained some individuals from Xijiang River, Beijiang River, Jianjiang River, and Moyang River. The haplotype network showed that the population in Xijiang River was closely related to those in Dongjiang River, Hanjiang River, and Moyang River, while the population in Beijiang River was distant from those in Dongjiang River and Xijiang River. The AMOVA results showed that 77.09% and 37.92% of the variations occurred between and within populations, respectively. The results of nucleotide mismatch analysis and neutrality test showed that there was no significant expansion of M. armatus populations in Guangdong. The M. armatus populations in Guangdong demonstrated low genetic diversity. Moreover, the genetic diversity of wild populations showed a decreasing trend.
Key words:Mastacembelus armatus; genetic diversity; mitoch-
ondrial Cytb sequence; phylogeography
大刺鳅(Mastacembelus armatus)隶属于合鳃目(Synbgranchiformes)刺鳅科(Mastacembelidae)刺鳅属(Mastacembelus),俗称锯齿泥鳅、带刀鱼、石锥、刀鳅等。大刺鳅分布于中国的广东、广西、福建、云南、湖南和海南等省以及东南亚的印度、越南和马来西亚等国家[1]。大刺鳅喜欢栖息于石砾底质溪流中,匿藏于石缝或洞穴中,主要摄食水体中小型无脊椎动物,是产区内的名优经济鱼类[2]。近年来,受栖息地萎缩和过度捕捞等众多不良因素影响,我国大刺鳅野生资源量急剧下降,个体规格趋于小型化。为了保护和可持续利用大刺鳅种质资源,国家农业部已经建立了汀江大刺鳅国家级水产种质资源保护区、增江光倒刺鲃大刺鳅国家级水产种质资源保护区和浙水资兴段大刺鳅条纹二须鲃国家级水产种质资源保护区;福建省也将大刺鳅列入省级重点保护水生野生动物名录[3]。因此,基于我国大刺鳅种质资源调查实况,分析其遗传多样性和遗传结构,对于大刺鳅种质资源的保护和可持续利用具有重要的意义。
鱼类线粒体DNA是一种环状的双链DNA分子,具有结构简单、可溯源、进化速度较快等特点,是研究动物群体遗传学和系统发育的理想分子标记[4]。其中,Cytb基因进化速度适中,更是被广泛应用于类种群遗传多样性和遗传结构的研究[5-6]。基于Cytb基因对西江流域广西境内卷口鱼(Ptychidio jordani)遗传多样性分析表明,部分群体遗传多样性较低,各群体间具有较大分化[7];而基于Cytb基因对南海北部金钱鱼(Scatophagus argus)遗传多样性分析表明,各群体间分化较小,存在频繁的基因交流[5]。线粒体分子标记也可以对选育群体进行遗传分析,对团头鲂“浦江1号”(F0)及3个选育群体进行COII基因标记比较分析发现,选育群体与F0群体间具有明显的遗传分化[8];而对吉富品系尼罗罗非鱼(Oreochromis niloticus)多个选育时代群体进行分析发现,较短时间内的人为选择可以造成与长期地理隔离效应相当的群体遗传分化[9]。
目前针对大刺鳅遗传背景的研究较少,相关研究主要集中在形态学[10]、生殖发育[11]、基因克隆[12]等方面。因此,基于线粒体Cytb序列分析广东地区大刺鳅的种群遗传变异特征,了解其遗传多样性、遗传结构、种群历史动态,可为其种质资源的管理、保护和可持续开发利用提供科学依据。
1材料与方法
1.1 样品的采集
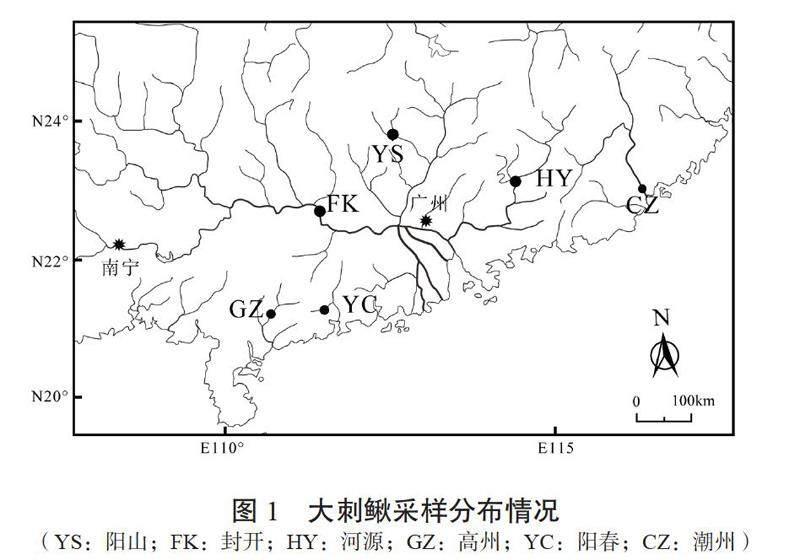
大刺鳅样品于2021—2022年采自广东省潮州市、河源市、韶关市、肇庆市封开县、阳春市、高州市,共计6个群体,每个群体包含30尾以上的样本。具体采样点见图1,各群体及采样点样品信息见表1。
1.2 DNA提取及测序
大刺鳅基因组DNA的提取参考的试剂盒(上海生工生物公司)方法进行。PCR扩增采用自行设计的引物,其序列如下。
F:5AGGAGAGGGATTAGACGCAA-3';R:5'-GGGAGTTAGGGGCGGAAG-3'。PCR
反应体系约25 μL(包含PCR Master Mix 12.5 μL、正反引物(10 mmol/L)各1 μL、模板DNA 3 μL及ddH2O 7.5 μL),用ddH2O代替模板DNA做陰性对照。PCR扩增反应参数设置为:95℃预变性5 min;95℃变性30 s,55℃退火30 s,72℃延伸1.5 min,共35个循环;72℃延伸10 min。PCR产物用0.8%琼脂糖电泳检验后,由上海生工生物公司进行纯化并测序。
1.3 数据分析
使用ClustalX 1.81软件对测序所得序列进行比对分析,利用MEGA 6.0软件计算序列碱基组特点和遗传距离,并以红纹刺鳅和网纹刺鳅为外类群构建单倍型邻接树。通过DNAsp 5.0软件统计各群体的核苷酸多样性(π)、单倍型多样性(Hd) 和遗传分化系数(Fst)。基因流(Nm)的计算公式为Nm=0.5(1/Fst-1)。并使用Network 5软件构建各单倍型之间的网络关系图。
2 结果与分析
2.1 序列特征
研究得到6个群体193尾大刺鳅的Cytb序列长度都是1 138 bp,其中A、C、T、G平均含量分别为25.9%、32.7%、27.7%和13.6%,G的含量明显低于其他3种碱基含量,G+C(46.3%)含量略小于A+T(53.7%)含量,表现出显著的反G偏倚和AT偏向性,与其他脊椎动物线粒体基因的核苷酸组成特性一致[13]。
2.2 单倍型多样性和核苷酸多样性
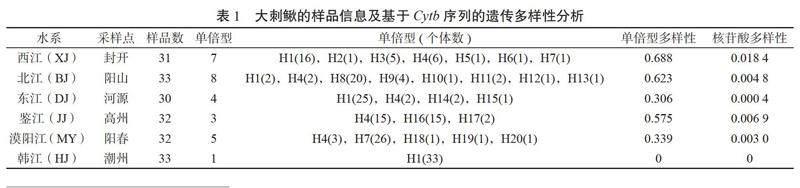
在193尾样本中,共定义了20个单倍型,其中3个单倍型为两个或两个以上群体共享的单倍型,7个单倍型为单个群体内多个个体共享,其余10个单倍型仅存在于单个个体中。遗传多样性分析表明,193尾样品的平均单倍型多样性为0.785,核苷酸多样性为0.007 2。其中,西江群体单倍型多样性(Hd=0.688)和核苷酸多样性(π=0.018 4)均最高;韩江群体33个个体中只存在一个单倍型,其单倍型多样性和核苷酸多样性均为零。
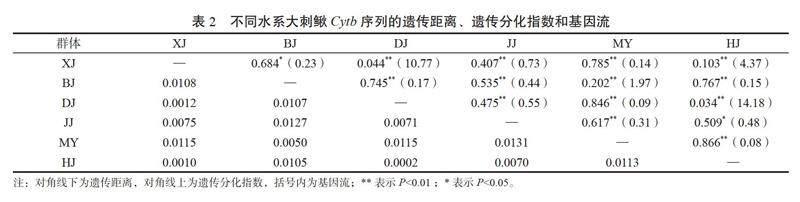
2.3 群体间遗传距离及遗传分化基于Cytb基因序列分析不同水系大刺鳅群体间的遗传距离和遗传分化结果,由表2可见,6个大刺鳅群体间的遗传距离为0.000 2~0.013 1,漠阳江(MY)群体与鉴江(JJ)群体间遗传距离最大(0.013 1),北江(BJ)群体与鉴江(JJ)群体间遗传距离(0.012 7)次之,韩江(HJ)群体与东江(DJ)的群体间遗传距离最小(0.000 2)。大刺鳅群体的遗传分化指数为0.035~0.866,东江(DJ)与西江(XJ)、东江(DJ)与韩江(HJ)群体间分化程度较小(Fst<0.05),北江(BJ)与漠阳江(MY)、西江(XJ)与韩江(HJ)群体间存在中度分化(0.05
2.4 系统发育分析
为更好地了解广东地区大刺鳅各群体之间的亲缘关系,利用邻接法(NJ)对19个单倍型进行系统发育分析,构建了分子系统发育树。从图2可见,广东地区的大刺鳅样本分为Ⅰ和Ⅱ两支。其中,支系Ⅰ包含了东江群体和韩江群体的全部个体、西江群体的绝大部分个体、鉴江群体部分个体以及北江群体和漠阳江群体的少数个体;支系Ⅱ包含了北江群体和漠阳江群体的大部分个体、鉴江群体部分个体以及西江群体少数个体。
2.5 单倍型网络分析
建立大刺鳅线粒体Cytb基因单倍型的进化网络关系图,由图3可见,其单倍型间彼此相连,大多数单倍型之间相差1~2步的突变距离。单倍型H1(珠江水系群体与韩江水系群体的共享单倍型)位于网络图的中心位置,为较原始的单倍型。鉴江群体的高频数特有单倍型H16与单倍型H8(珠江水系群体和鉴江水系群体共享单倍型)之间变异达14步,表明两个水系群体之间具有一定程度的遗传分化;珠江水系群体部分单倍型之间的变异超过10步,表明珠江水系群体部分个体间存在一定的遗传差异。
2.6 种群动态分析
通过对广东地区6个群体大刺鳅群的线粒体Cytb序列进行Tajimas D和Fus Fs中性检验。结果表3显示,东江群体的Tajimas D和Fus Fs均为负值,但差异性检验均不显著(P>0.05),表明东江群体未显著偏离种群扩张模型;其余5个群体中,除了西江群体Tajimas D检验达极显著(P<0.01)外,其他群体的Tajimas D和Fus Fs检验均不显著,表明这5个群体历史上也未发生种群扩张。所有群体的错配分布曲线呈多峰型,进一步表明广东地区大刺鳅在历史上群体大小相对稳定,未发生过明显的扩张。
3 小结与讨论
3.1 小结
基于线粒体Cytb序列构建的NJ树显示,广东地区的大刺鳅种群分为Ⅰ和Ⅱ两支。其中,支系Ⅰ包含了西江、北江、鉴江和漠阳江群体的部分样本以及东江和韩江群体的全部样本;支系Ⅱ包含了西江、北江、鉴江和漠阳江群体的部分样本。单倍型网络分析显示,西江水系的群体与东江、韩江以及漠阳江群体的亲缘关系较近,而北江群体与东江、西江群体间遗传分化较大。AMOVA分析表明,77.09%的变异来自于组群内群体间,37.92%的变异来自于群体内。核苷酸错配分析及中性检验结果显示,广东大刺鳅整体及各个群体在历史上均没有发生过明显的扩张。因此,推断广东地区的大刺鳅以珠江水系为扩散中心,通过两条途径向其他独立水系扩散。其中,一条扩散途径是沿西江向南往漠阳江、鉴江扩散;另一条途径是沿东江向东往韩江水系扩散。其中西江和鉴江水系多样性性水平较高。广东各水系的大刺鳅群体遗传多样性水平较低,野生种群的遗传多样性总体呈现下降趋势,应加强野生种质资源保护和可持续开发利用,一方面,可将西江和鉴江水系作为优先保护单元,另一方面,可着力解决大刺鳅在人工养殖环境的难题,缓解野生大刺鳅过度捕捞的压力。此外,大多数水系的大刺鳅种群间分化程度较高,大刺鳅群体间基因交流受江水域阻隔的限制,可尝试通过不同地理群体间个体的杂交来选育出具有优良性状的品种。
3.2 讨论
3.2.1 大刺鳅的遗传多样性 物种遗传多样性是评价物种对环境适应能力和进化潜力的重要依据,越丰富的种群遗传多样性,对环境的适应能力越强,而遗传多样性的贫乏或缺失会威胁到种群的生存[15]。单倍型多样性和核苷酸多样性是衡量物种多样性的重要指标。其中,核苷酸多样性更能精确地揭示种群的mtDNA多态程度[16]。此研究结果显示,在191尾大刺鳅样本中共检测出线粒体单倍型20个,平均单倍型多样性为0.785,核苷酸多样性为0.007 2,显示出较高的单倍型多样性和较低的核苷酸多样性。多样性水平较低,明显低于邻近水域的宽鳍鱲(Zacco platypus)[17]和光倒刺鲃(Spinibarbus hollandi)[18]等鱼类。比较近年来关于广东地区大刺鳅资源的调查发现,广东地区大刺鳅的野生种群遗传多样性总体呈现下降趋势[19-20]。其中东江群体、韩江群体和漠阳江群体的单倍型多样性和核苷酸多样性均较低,可能是发生过近期的瓶颈效应或奠基者效应[21];西江群体的单倍型多样性和核苷酸多样性均较高,推测西江群体与其他群体发生了二次接触。
造成大刺鳅群体遗传多样性较低的原因可能是人类活动对大刺鳅生活环境的不良影响导致。一方面,渔民的过度或非法捕捞易导致大刺鳅野生种群数量不断下降,使其遗传多样性降低;另一方面,大量的水利工程等,使大刺鳅栖息地呈现破碎化分布,群体间基因交流形成了隔离,导致大刺鳅遗传多样性降低。
3.2.2 大刺鳅群体遗传分化 遗传分化指数是群体间遗传分化的重要指标,此研究中漠阳江种群与大多数种群间遗传分化指数较大,可能是由于云雾山和天露山的阻隔导致了漠阳江群体与其他水系群体间基因交流受到阻碍[17],从而产生了一定的遗传分化。东江与韩江群体间分化程度较小,这可能与两个水系的地理位置较近以及种群隔离分化时间较短有关。
基因流是影响群体内部和群体之间遗传分化程度的重要因素,自然群体的遗传分化是基因流和选择作用相互运动的结果[22]。此研究中,东江群体与西江群体之间的基因流为10.77,差异极显著,表明东江群体与西江群体之间存在较频繁的基因交流,遗传分化程度较小。这与东江和西江水系的斑鱯(Hemibagrus guttatus][23]、寬鳍鱲(Zacco platypus][17]等鱼类的群体间遗传分化一致。造成东江与西江大刺鳅群体间遗传分化程度较小的原因可能是两者的大刺鳅群体在冰期海平面大幅度下降的时候发生了汇聚[24],群体间基因交流频繁。
3.2.3 亲缘地理模式 大刺鳅是典型的初级淡水鱼类,其分布受江河湖泊水系的限制。长期的隔离以及环境条件的差异,使大刺鳅的不同地理群体间逐渐产生变异。通过对不同水系的大刺鳅群体进行亲缘关系的分析,可以了解其过去种群动态[25]。
此研究中,系統发育分析显示,支系Ⅰ和Ⅱ均包含了珠江水系、鉴江水系以及漠阳江水系的大刺鳅群体的部分个体;单倍型网络图也显示,3个水系之间的群体均存在共享单倍型,同时鉴江水系和漠阳江水系的部分个体经过15步以上的变异分别演化出了若干个特有单倍型。这表明3个水系群体之间存在一定的亲缘关系。可以推测,云开大山和云雾大山隆起前,珠江水系的部分个体通过连通的河道扩散到鉴江水系和漠阳江水系。云开大山以及云雾大山隆起后,阻断了3个水系之间的联系,成为该地区淡水鱼类的地理障壁[26],使各群体间产生了较大分化。鉴江水系可能由于受到珠江水系的袭夺,其群体与珠江水系群体发生了二次接触,类似的由于不同演化系群二次接触导致遗传多样性水平升高的例子已在多种鱼类中被发现[27-29]。
由系统发育树可知,韩江水系与珠江干流东江的全部个体存在一个共同祖先;单倍型网络图显示,韩江水系群体仅与珠江水系群体存在共享单倍型,而与漠阳江、韩江两条独立入海水系不存在共享单倍型。这说明两者之间存在较近的亲缘关系。蓝昭军等[30]通过对华南地区唇?和间?的亲缘关系研究认为,韩江与其他水系群体产生分化的主要原因是韩江被莲花山、武夷山、玳瑁山包围,与其他水系产生了隔离。此研究发现,韩江水系的特殊地理位置导致其与其他群体间产生了遗传分化,而韩江径流量在1951—2011年内曾经历了多次丰枯变化[31],其间可能通过邻近的东江与珠江水系的群体进行了短暂的交流,从而形成现在的亲缘地理格局。
参考文献:
[1] FROESE R,PAULY D. FishBase[EB/OL]. https://fishbase.mnhn.fr/search.php.
[2] 广西壮族自治区水产研究所,中国科学院动物研究所. 广西淡水鱼类志(2版)[M]. 南宁:广西人民出版社,2006.
[3] 张春光,赵亚辉. 中国内陆鱼类物种与分布[M]. 北京:科学出版社,2016
[4] ZHU S L,CHEN W T,WU Z,et al. Mitochondrial diversity and genetic structure of common carp (Cyprinus carpio) in Pearl River and Nandujiang River[J]. Journal of Fish Biology,2023,102(5):1109-1120.
[5] 彭敏,肖珊,陈晓汉,等. 基于线粒体Cyt b基因的南海北部金钱鱼种群遗传结构分析[J]. 南方农业学报,2021,52(10):2851-2860.
[6] PHAN G H,LAM T T H,DINH Q M,et al. Phylogenics of the genus Glossogobius in the Mekong Delta based on the mitochondrial cytochrome b (cytb) gene[J]. Heliyon,2023,9(5):e16106.
[7] 彭敏,韩耀全,王大鹏,等. 基于线粒体Cytb基因序列的西江流域广西境内卷口鱼遗传多样性分析[J]. 南方水产科学,2020,16(5):10-18.
[8] 唐首杰,毕详,张飞明,等. 基于线粒体DNA COII基因序列团头鲂3个选育群体的遗传变异分析[J]. 水产科技情报,2019,46(2):61-68.
[9] 颉晓勇,李思发,蔡完其. 基于D-Loop序列的罗非鱼选育群体遗传变异分析[J]. 上海海洋大学学报,2011,20(3):336-341.
[10] 舒琥,江小璐,杨华强,等. 华南地区7个大刺鳅野生群体的形态差异分析[J]. 广州大学学报(自然科学版),2017,16(3):8-14.
[11] ALI M R,RAHMAN M M,SARDER M,et al. Histological study of the developing gonads of endangered freshwater spiny eel, Mastacembelus armatus during the reproductive cycle[J]. Journal of the Bangladesh Agricultural University,2017,14(2):261-269.
[12] HAN C,LI Q,ZHANG Z P,et al. Characterization, expression, and evolutionary analysis of new TLR3 and TLR5M genes cloned from the spiny eel Mastacembelus armatus[J]. Developmental & Comparative Immunology,2017,77:174-187.
[13] SCHNEIDER S,EXCOFFIER L. Estimation of past demographic parameters from the distribution of pairwise differences when the mutation rates vary among sites: application to human mitochondrial DNA[J]. Genetics,1999,152(3):1079-1089.
[14] WRIGHT S. The interpretation of population structure by f‐statistics with special regard to systems of mating[J]. Evolution,1965,19(3):395-420.
[15] 沈浩,刘登义. 遗传多样性概述[J]. 生物学杂志,2001,18(3):5-7,4.
[16] 肖明松,崔峰,康健,等. 长吻养殖群体与野生群体遗传多样性分析[J]. 水生生物学报,2013,37(1):90-99.
[17] 梁晓旭,庆宁,杨柯林,等. 广东地区宽鳍鱲种群遗传变异和亲缘地理[J]. 水生生物学报,2010,34(4):806-814.
[18] 蓝昭军,李强,舒琥,等. 基于线粒体细胞色素b基因的光倒刺鲃遗传多样性与遗传结构研究[J]. 海洋与湖沼,2016,47(6):1158-1165.
[19] 江小璐. 华南及邻近地区不同群体大刺鳅的遗传多样性及亲缘地理研究[D]. 广州:广州大学,2018.
[20] 杨华强,李强,侯丽萍,等. 华南及邻近地区大刺鳅遗传多样性分析[A]. 中国水产学会. 2014年中国水产学会学术年会农业科技专辑[C]. 长沙:中国水产学会,2014. 52.
[21] GRANT W,BOWEN B. Shallow population histories in deep evolutionary lineages of marine fishes: insights from sardines and anchovies and lessons for conservation[J]. Journal of Heredity,1998,89(5):415-426.
[22] 向井輝美(日). 隋文彬译. 群体遗传学[M]. 长春:吉林科学技术出版社,1984.
[23] YANG L,HE S. Phylogeography of the freshwater catfish Hemibagrus guttatus (Siluriformes, Bagridae):implications for South China biogeography and influence of sea-level changes[J]. Molecular Phylogenetics and Evolution,2008,49(1):393-398.
[24] WANG L,SARNTHEIN M,ERLENKEUSER H,et al. East Asian monsoon climate during the Late Pleistocene: high-resolution sediment records from the South China Sea[J]. Marine Geology,1999,156(1/2/3/4):245-284.
[25] BERMINGHAM E,MARTIN A P. Comparative mtDNA phylogeography of neotropical freshwater fishes: testing shared history to infer the evolutionary landscape of lower Central America[J]. Molecular Ecology,1998,7(4):499-517.
[26] CHIANG T Y,LIN H D,ZHAO J,et al. Diverse processes shape deep phylogeographical divergence in Cobitis sinensis (Teleostei: Cobitidae) in East Asia[J]. Journal of Zoological Systematics and Evolutionary Research,2013,51(4):316-326.
[27] HUA X,WANG W,YIN W,et al. Phylogeographical analysis of an estuarine fish, Salanx ariakensis (Osmeridae: Salanginae) in the north-western Pacific[J]. Journal of Fish Biology,2009,75(2):354-367.
[28] LIN C J,LIN H D,WANG J P,et al. Phylogeography of Hemibarbus labeo (Cyprinidae):secondary contact of ancient lineages of mtDNA[J]. Zoologica Scripta,2010,39(1):23-35.
[29] 苏丽维. 中国南部两种同域分布的鲤科鱼类比较亲缘地理研究[D]. 上海:上海海洋大学,2014.
[30] 蓝昭军,范明君,黄小林,等. 基于线粒体Cyt b基因的中国南方唇(Hermibarbus labeo)和间(Hermibarbus medius)种群分化及亲缘地理研究[J]. 生态学报,2016,36(19):6091-6102.
[31] 李俊伟. 基于小波变换的韩江年径流多时间尺度演变特征分析[J]. 广东水利水电,2014(4):5-7,10.
(责任编辑:张焕裕)

