eNOS与蛛网膜下腔出血后脑血管痉挛的关系
王灯亮, 康德智, 张元隆, 林章雅, 林元相, 余良宏
蛛网膜下腔出血(subarachnoid hemorrhage,SAH)主要是颅内动脉瘤破裂出血引起,并出现不同程度的脑血管痉挛(cerebral vasospasm CVS),是引起高致残率、致死率的主要原因之一。虽然对SAH后血管痉挛的机制研究较多,有学者报道称多因子机制参与了脑血管痉挛的发生[1],但目前其具体发生机制仍不十分清楚。
NO是一氧化氮合成酶(nitric oxide synthase,NOS)的催化产物,作为一种气体,NO不容易直接测量,因此,常通过对NOS的研究来间接反应NO生物学作用。根据组织来源可将NOS分为内皮型(eNOS)、神经元型(nNOS)和诱导型(iNOS)。近来有研究显示eNOS功能紊乱可能参与脑血管痉挛的发展[2]。
本实验通过兔枕大池二次注血法建立SAH后CVS的模型,运用Western blotting观察在SAH后不同时间点eNOS表达的变化,旨在探讨eNOS与SAH后脑血管痉挛的关系,从而进一步有助于临床上的诊断和治疗。
1 材料与方法
1.1 实验动物与试剂 研究对象为72只新西兰大白兔由上海生旺实验动物养殖有限公司提供许可证号 SCXK(沪)2007-0007,雌雄不限,体重为2.0~2.8kg,自由进食,昼夜节律喂养。主要实验试剂为eNOS多克隆抗体(武汉伊艾博科技有限公司提供)等。
1.2 实验方法
1.2.1 实验动物分组 成年新西兰大白兔72只,随机分成以下两组:(1)对照组(12只),枕大池注入生理盐水;(2)SAH组(60只),按时间随机分为术后 1d、3d、5d、7d、10d 5 个亚组,每组 12 只,经手术于枕大池注入兔自体耳中央动脉血。
1.2.2 兔SAH模型的制作 采用枕大池二次注血方法建立稳定的蛛网膜下腔出血模型。以盐酸氯氨酮30mg/kg和氯丙嗪7.5mg/kg肌肉注射进行麻醉。枕部剃毛,俯卧位固定,消毒后于枕部中线作一直切口,长2.5cm,钝性分离直达寰枕筋膜,2ml注射器针头经皮穿刺枕大池,此时可见清亮脑脊液流出,按照0.4ml/kg放出脑脊液后,立即从兔耳中央动脉抽取等量非抗凝动脉血缓慢注入枕大池中。首次注血0.4ml/kg,48h后重复上述操作,注入动脉血0.2ml/kg。二次注血24h后为SAH后第1天,依次类推。对照组在放完脑脊液后注入等量生理盐水,余操作同实验组。
1.2.3 活体灌注 予盐酸氯氨酮30mg/kg和氯丙嗪7.5mg/kg肌肉注射对兔进行麻醉。打开胸腔,剥开心包膜,将下腔静脉和腹主动脉用动脉夹夹闭,剪开右心耳放出血液,再剪开左心室将灌注头插入主动脉然后用动脉夹固定。行HE染色检查的兔子先输入500ml生理盐水将血管内的血冲洗净,再注入500ml的多聚甲醛固定液固定。行石蜡包埋后备做检查。行 Western blotting检测的兔子灌入500ml 4℃预冷生理盐水,灌注后取出脑组织和基底动脉,之后将基底动脉分离出来,置于冻存管中,放入液氮灌中速冻后转入-80℃长期保存。
1.2.4 标本制作及组织学评价 经甲醛固定的脑及血管组织石蜡包埋,在每个基底动脉的近、中、远段的中点取材,每点连续取1个切片,层厚4μm,切片经苏木素-伊红染色后,采用 Leica DM2500显微镜以及Image-Pro Plus(Version 5.1)图像分析软件测定每个切片中血管标本的横截面积,计算3张切片平均横截面积,作为该兔的基底动脉管腔面积。
1.2.5 Western blotting检测eNOS表达 收集对照组、各实验组基底动脉标本,使用哺乳动物蛋白抽提试剂(RIPA)进行细胞总蛋白提取,应用BCA法测定蛋白含量。每个样品槽内10μl样本进行SDS-PAGE电泳,通过电转印法将蛋白从聚丙烯酰胺凝胶上转移NC膜上,转印后的NC膜用5%脱脂奶粉室温轻摇30min后加入一抗(浓度1∶500),室温轻摇30min后放于4℃过夜,TBS洗膜后加入浓度为1∶2000的二抗(羊抗兔),室温轻摇40min,TBS洗膜,ECL显色液显色,拍照。
2 结果
2.1 大体标本观察 对照组脑干腹侧基底动脉周围无血凝块,实验组在1d、3d、5d、7d标本基底动脉周围可见明显的凝血块,随时间的推移,凝血块的范围、大小和颜色呈现减退,至第10天,基底动脉周围凝血块已经基本消失(见图1、图2)。
2.2 各组基底动脉横截面积比较 基底动脉行HE染色后,测定每个切片中血管标本的横截面积,取得各个实验组和对照组的基底动脉横截面积。对照组基底动脉横截面积为584971.4±80780.1 μm2,SAH 第 1 天为 329441.5 ±15907.5μm2;SAH第3天为 404492.3±73172.1μm2;SAH 第 5 天为300619.6 ±26176.2μm2;SAH 第7 天为242604.7 ±45977.1μm2;SAH 第 10 天为 362157.4 ±38480.7。经统计学处理后发现实验组基底动脉横截面积总体小于对照组,与对照组比较有差异(P<0.05),SAH第3天、第7天和第10天相比,P<0.05。
2.3 基底动脉组织学变化 在光镜下,对照组的血管壁无增厚,内皮细胞结构完整,内弹力膜清晰可见,结构完整。SAH模型组可见血管壁增厚,管腔狭窄,内皮细胞变性、肿胀,染色质不均,空泡形成;内弹力膜迂曲皱褶或断裂,厚薄不均,平滑肌细胞排列紊乱。这些改变在SAH后第1天开始出现,第3天逐渐明显,第5天和第7天表现最为明显,第10天上述改变明显减轻,内弹力膜皱缩基本消失,内皮细胞排列渐趋平整,内皮细胞稍有肿胀,管径基本恢复正常(见图3、图4)。
2.4 各组兔基底动脉eNOS表达情况 Western blotting观察到eNOS在对照组大量表达,对照组为1.957322 ±0.028485,SAH 第 1 天为 1.833437 ±0.036424;SAH 第 3 天为 1.389229 ±0.072982;SAH第5天为 1.161714±0.030655;SAH 第 7 天为1.239918±0.027786;SAH 第 10 天为 1.434776 ±0.067526。结果显示实验组第1天表达开始减少,第5天表达水平明显减弱,之后表达逐渐增加,与对照组相比均有统计学意义(P<0.05)(见图5、图6)。

图1 对照组脑干周围未见蛛网膜下腔出血

图2 SAH组第5天脑干周围大量蛛网膜下腔出血

图3 对照组内皮细胞结构完整,内弹力膜清晰可见,结构完整

图4 SAH组注血后第5天内皮细胞变性、肿胀,染色质不均空泡形成;内弹力膜迂曲皱褶或断裂
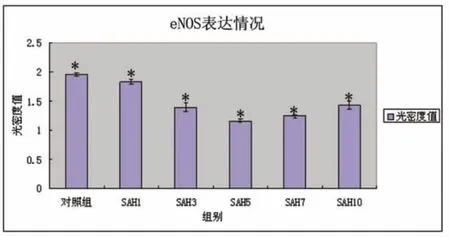
图5 各组eNOS表达情况 注:与对照组比较*P<0.05
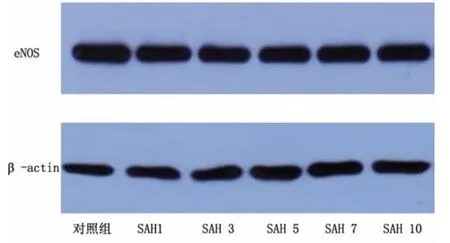
图6 各组eNOS检测结果
3 讨论
蛛网膜下腔出血后约30%~50%患者会出现脑血管痉挛,可导致脑缺血、引起神经功能障碍、甚至死亡[3]。脑血管痉挛呈双相性,一种为早发性,多见于SAH后0.5h~3d,常于4h内缓解,也称急性脑血管痉挛;另一种为迟发性脑血管痉挛(DCVS),发生于出血后4~15d,7~10d为高峰期,2~4w逐渐减少。迟发性脑血管痉挛不同于急性期脑血管痉挛,其一旦发生,难于逆转,后果往往较严重[4]。然而,关于脑血管痉挛的发病机制比较复杂,至今尚未完全阐明。目前普遍认为SAH后CVS是由多因素所致,如高分子溶血产物氧合血红蛋白(OxyHb)的增多、扩血管物质如NO减少、细胞凋亡、血液高凝状态、免疫炎症反应[5]等因素。
本实验研究结果表明蛛网膜下腔出血后第1天eNOS表达开始减少,第5天减少最严重,之后开始慢慢恢复。HE染色提示SAH后第1天开始出现血管壁增厚,管腔狭窄,内皮细胞变性、肿胀,染色质不均,空泡形成;内弹力膜迂曲皱褶或断裂,厚薄不均,平滑肌细胞排列紊乱;第3天逐渐明显;第5天和第7天表现最为明显;第10天上述改变明显减轻。eNOS的表达与血管壁的病理改变相符。我们认为eNOS与脑血管痉挛可能存在一定的关系,其表达减少可能参与蛛网膜下腔出血后脑血管痉挛的发展。
eNOS是NO/cGMP信号途径的关键酶,通过与内皮细胞钙离子和钙调蛋白相偶联而激活,具有调节血管紧张度和保持内皮细胞功能的作用,可能还有神经保护和抗炎症作用。血管内皮细胞内eNOS催化产生NO释放后,能迅速进入邻近的平滑肌细胞,激活可溶性鸟苷酸环化酶(GC),GC催化产生环鸟苷酸(cGMP),cGMP激活细胞内肌质网上钙泵,使细胞内游离钙泵入肌质网内,细胞内游离钙减少,使血管平滑肌处于舒张状态[6]。同时cGMP可通过抑制蛋白激酶活性,使血管平滑肌舒张。蛛网膜下腔出血后,NO水平下降,则GC活性降低,cGMP生成不足,从而舒张平滑肌能力减弱。eNOS可能通过解偶联作用导致SAH后继发脑血管痉挛、微血栓形成,甚至导致神经元细胞的死亡[7]。
eNOS合成的NO作为血管调节因子的同时,还具有维持血管壁几何形态的作用,对血管性疾病起到预防作用。研究表明,在eNOS基因敲除的大鼠模型中,由于eNOS缺乏可以导致血管壁囊性膨出,提示eNOS合成的NO作为血管舒张因子的同时,还可以起到维持血管壁结构的作用[8]。SAH时由于血管内皮细胞在毒性作用下结构发生破坏,使eNOS活性降低,NO的合成减少,NO含量下降,可造成血管痉挛。有学者指出,eNOS基因多态性可以预测动脉瘤性蛛网膜下腔出血和脑血管痉挛的易感性[9,10]。Pyne-Geithman 等学者研究发现 eNOS 是预测蛛网膜下腔出血后脑血管痉挛的有用指标[11]。许多药物可能通过调节eNOS的表达而发挥减轻脑血管痉挛的作用:雌二醇可能通过保持eNOS的表达水平而发挥减轻脑血管痉挛的作用[12];川芎嗪毛冬青(毛披树)可能通过上调eNOS的表达水平增加NO表达水平从而减轻脑血管痉挛[13];辛伐他汀通过上调eNOS的磷酸化水平而发挥减轻脑血管痉挛作用[14]。
综上所述,eNOS是合成NO的关键酶,SAH后痉挛的脑血管壁中eNOS减少,从而进一步证明了NO减少在血管痉挛的发展过程中发挥了重要作用。继续加深对eNOS的研究可能有利于指导临床脑血管痉挛的防治。
[1] Guresir E,Raabe A,Jaiimsin A,et al.Histological evidence of delayed ischemic brain tissue damage in the rat double-hemorrhage model[J].JNeurol Sci,2010,293(1 ~2):18 - 22.
[2] Osuka K,Watanabe Y,Usuda N,et al.Modification of endothelial nitric oxide synthase through AMPK after experimental subarachnoid hemorrhage[J].JNeurotrauma,2009,26(7):1157 -1165.
[3] Pyne-Geithman GJ,Caudell DN,Cooper M,et al.Dopamine D2-receptor-mediated increase in vascular and endothelial NOS activity ameliorates cerebral vasospasm after subarachnoid hemorrhage in vitro[J].Neurocrit Care,2009,10(2):225 - 231.
[4] 陈新军,袁先厚,江普查,等.蛛网膜下腔出血血浆一氧化氮、一氧化氮合酶含量及其临床意义[J].中华医学杂志,2006,30(6):497-498.
[5] 张 健,王 中,周 岱,等.NF-κB、ICAM-1在实验性SAH后基底动脉壁上的表达变化[J].中风与神经疾病杂志,2009,26(6):684-688.
[6] Murad F.Nitric oxide and cyclic GMP in cell signaling and drug development[J].N Engl JMed,2006,355(9):2003 -2011.
[7] Sabri M,Ai J,Knight B,et al.Uncoupling of endothelial nitric oxide synthase after experimental subarachnoid hemorrhage[J].J Cereb Blood Flow Metab,2011,31(1):190 -199.
[8] Ozum U,Bolat N,Gul E,et al.Endothelial nitric oxide synthase gene[G894T]polymorphism as a possible risk factor in aneurysmal subarachnoid hemorrhage[J].Acta Neurochir(Wien),2008,150(1):57-62.
[9] Khurana VG,Sohni YR,Mangrum WI,et al.Endothelial nitric oxide synthase gene polymorphisms predict susceptibility to aneurysmal subarachnoid hemorrhage and cerebral vasospasm[J].J Cereb Blood Flow Metab,2004,24(3):291 -297.
[10] Starke RM,Kim GH,Komotar RJ,et al.Endothelial nitric oxide synthase gene single-nucleotide polymorphism predicts cerebral vasospasm after aneurysmal subarachnoid hemorrhage[J].JCereb Blood Flow Metab,2008,28(6):1204 -1211.
[11] Pyne-Geithman GJ,Caudell DN,Prakash P,et al.Glutathione peroxidase and subarachnoid hemorrhage:implications for the role of oxidative stress in cerebral vasospasm [J].Neurol Res,2009,31:195-199.
[12] Lin CL,Shih HC,Dumont AS,et al.The effect of 17beta-estradiol in attenuating experimental subarachnoid hemorrhage-induced cerebral vasospasm[J].Neurosurg,2006,104(2):298 -304.
[13] Shao Z,Li J,Zhao Z,et al.Effects of tetramethylpyrazine on nitric oxide/cGMP signaling after cerebral vasospasm in rabbits[J].Brain Res,2010,1361:67 -75.
[14] Sugawara T,Ayer R,Jadhav V,et al.Simvastatin attenuation of cerebral vasospasm after subarachnoid hemorrhage in rats via increased phosphorylation of Akt and endothelial nitric oxide synthase[J].J Neurosci Res,2008,86(16):3635 -3643.

