黏附因子在大肠埃希菌尿路感染中的作用
秦晓华, 王明贵
复旦大学附属华山医院抗生素研究所,上海 200040
尿路感染(urinary tract infection, UTI)是最常见的感染性疾病之一,包括肾盂肾炎、膀胱炎和无症状性菌尿。由于泌尿道解剖结构等方面的原因,女性尿路感染发病率显著高于男性。临床上,某些尿路感染不易治愈,即使泌尿道解剖和功能正常的患者尿路感染亦可反复发作。据统计[1],60%女性一生至少发生1次尿路感染,而25%患者急性膀胱炎可反复发作,年轻女性急性膀胱炎的发作频率为平均每年0.5~0.7次/人。因尿路感染反复发作,患者反复就医,长期交替服用各类抗菌药物,不但造成巨大身心和经济压力,给社会带来沉重医疗负担,而且易导致二重感染,诱导临床耐药菌株的产生和传播。
大肠埃希菌(Escherichiacoli,E.coli)是尿路感染最常见的病原菌, 70%~95%社区获得性尿路感染和50%医院获得性尿路感染由尿路致病性大肠埃希菌(uropathogenicE.coli, UPEC)引起[1]。黏附因子被认为是UPEC的最重要毒力因子[2]。一方面,它可使UPEC黏附于宿主泌尿道上皮细胞,避免受尿液冲刷而被清除;另一方面,黏附因子可直接参与UPEC信号转导,介导细菌产物对宿主细胞的作用[2];更重要的是,在黏附因子介导下,UPEC可入侵宿主细胞,并大量繁殖,形成细胞内菌落群(intracellular bacterial community, IBC),从而逃避宿主细胞释放的炎症因子及免疫效应细胞的攻击。UPEC成为胞内寄生菌后,不仅对抗菌药物敏感性下降,同时免疫原性也大大降低,成为尿路感染再燃或复发的潜在细菌贮存库[3]。
黏附因子各亚基在细菌表面聚集并装配成单体、寡聚体或超分子纤维结构——菌毛,介导UPEC的黏附过程。UPEC主要黏附因子包括1型、P型、S型和F1C型菌毛及Afa/Dr黏附因子家族[2,4](表1)。本文综述了上述黏附因子的表达及其在尿路感染中发挥的作用。
1 1型菌毛
1型菌毛由fim基因簇编码。多个重复的FimA亚单位形成螺旋杆状,构成1型菌毛底部;顶部纤毛状结构则由黏附因子FimH与调配蛋白(adaptor protein)FimF和FimG形成。顶部蛋白FimH含一口袋状结构域,可识别宿主细胞表面含有甘露糖的糖蛋白受体,引起甘露糖敏感的红细胞凝集反应(mannose-sensitive hemagglutination, MSHA)。FimH直接介导UPEC与宿主细胞的黏附及入侵泌尿道上皮细胞的过程,同时参与胞内生物膜样菌落形成[5]。
敲除fimH基因的E.coli菌株感染人或小鼠后,细菌在人和小鼠泌尿道的定植力大幅下降[6,7]。不同表型的FimH均可识别宿主细胞膜含三甘露糖(trimannose)的糖蛋白受体,但与其他糖蛋白受体或非糖蛋白受体(如单甘露糖受体、Ⅰ或Ⅳ型胶原等)的结合力有较大差异[2]。80%从粪便中分离的共生E.coli所编码的FimH只与三甘露糖蛋白受体结合,而70%的UPEC存在FimH表型突变,使其与三甘露糖蛋白受体的亲和力下降,而与单甘露糖蛋白受体的亲和力增加[8]。尿路上皮细胞表面以单甘露糖蛋白受体为主,因而存在FimH变异的UPEC更易在泌尿道定植。尿血小板溶素(uroplakin)广泛分布于膀胱内表面,具有加强和稳定膀胱上皮细胞的作用,但尿血小板溶素1a (uroplakin 1a,UP1a)是FimH的主要受体,后两者结合后启动UPEC入侵细胞的过程[9]。
1型菌毛不仅介导UPEC与宿主泌尿道上皮细胞的黏附与内侵过程,更重要的是可直接参与IBC形成。细菌在侵入膀胱上皮细胞时,呈结构松散的棒状;而当IBC形成后,则呈致密球状[10]。IBC完全形成后不久,在某些信号诱导下进入细菌播散阶段,UPEC变成细丝状,从IBC中流出,并进入邻近上皮细胞,开始新一轮的胞内繁殖和IBC形成过程,从而使UPEC在膀胱上皮细胞中播散,造成急性膀胱炎持续发作。周而复始的IBC形成过程会逐渐减慢并最终停止,形成细胞内细菌贮存库,逃避宿主免疫系统和抗菌药物的攻击[11]。当受侵袭的膀胱上皮细胞剥落时,细菌贮存库被激活,侵入新的上皮细胞,再次开始IBC形成过程,造成宿主膀胱炎复发[11]。
Wright等[5]用菌株UT189-tetR/Ptet与对照菌株UT189-tetR经尿道感染小鼠,并使其在四环素环境中生长,可观察到前期两者在膀胱的定植水平和侵入膀胱上皮细胞的能力基本相同。但侵入上皮细胞后,在缺乏四环素环境中UT189-tetR/Ptet不能表达1型菌毛,膀胱内总菌落数保持在0~102CFU/ml的低水平,且胞内细菌松散分布,不能形成致密球状的典型IBC;而对照株UT189-tetR表达1型菌毛,膀胱内总菌落数保持在105CFU/ml左右,胞内形成致密球状的IBC,同时表达1型菌毛的区域与IBC区域完全一致,说明1型菌毛参与IBC形成,对维持宿主体内细菌贮存库起重要作用,并与尿路感染复发密切相关。
有研究显示,UPEC菌株fimH基因的阳性率很高,达91%(72/79)[12]。但也有研究发现,健康人粪便标本中分离的E.colifimH基因携带率也较高(81%,74/91)[13]。因此,fimH基因是UPEC菌株重要致病因子之一的观点受到质疑。
1型菌毛的FimH与膀胱上皮细胞结合可启动细胞凋亡过程。小鼠泌尿道接种表达1型菌毛的UPEC,在接种后6 h内观察到大量膀胱上皮细胞脱落[7]。FimH可通过下调核因子κB(nuclear factor κB,NF-κB)表达和丝裂原活化蛋白激酶(mitogen-activated protein kinase,MAPK)通路信号转导[14],独立介导UPEC与膀胱上皮细胞的相互作用。膀胱上皮大量脱落有助于清除大量病原菌,但使底层相对不成熟的细胞暴露于充满UPEC的环境,更易受感染[2]。
2 P型菌毛
急性肾盂肾炎多为泌尿道定植菌逆行至肾脏引起的感染,其中80%病原菌为UPEC,而UPEC P型菌毛的表达与急性肾盂肾炎密切相关[15]。P型菌毛由肾盂肾炎相关菌毛(pyelonephritis-associated pili,pap)基因簇编码,菌株536和UT189基因组中各有1套pap基因操纵子编码P型菌毛,而菌株CFT073基因组中有2套编码P型菌毛的pap基因操纵子,分别位于不同的致病岛(pathogenicity island, PAI)[3]。P型菌毛结构与1型菌毛相似,顶部蛋白PapG为主要黏附相关因子,可识别P血型红细胞和尿路上皮细胞膜表面含α-Gal(1-4)- β-Gal组分的糖苷脂[15],引导UPEC与上述细胞黏附。这种黏附不为外源性甘露糖阻断,P型菌毛能介导甘露糖抵抗的红细胞凝集(mannose-resistant hemagglutination, MRHA)。
PapG有3种类型:PapGⅠ、PapGⅡ和PapGⅢ,与不同的同功受体(isoreceptor)结合。宿主各组织细胞所分布的PapG同功受体类型不同,决定不同类型PapG的不同组织向性。PapGⅠ主要与含神经酰胺己三糖的糖脂受体GbO3结合,该受体在人尿路上皮细胞中表达丰富;PapGⅡ主要与红细胞糖苷脂GbO4结合,该受体在人尿路上皮中也表达丰富;PapGⅢ则与Fosrssman抗原(豚鼠组织抗原)GbO5结合,该受体在犬尿路上皮中表达丰富,而在人尿路上皮中表达不多。临床上,PapGⅡ与人急性肾盂肾炎和菌血症相关;PapGⅢ则与人膀胱炎和猫犬生殖泌尿道感染相关;PapGⅠ很少见,临床特性不甚了解[16]。
基因检测发现,80%肾盂肾炎、60%膀胱炎和无症状菌尿及20%正常人粪便和尿液标本中分离的E.coli携带pap基因[17],而从25例肾盂肾炎合并败血症患者血培养标本中分离的E.coli100%含pap基因[18]。55例反复尿路感染患儿粪便中分离的E.coli均携带pap基因,其中53例(96%)中段尿分离的E.coli含pap基因[17]。另一研究显示,年龄为5个月以上的儿童中,急性肾盂肾炎UPEC菌株papGII基因检出率(42/46,91%)高于非急性肾盂肾炎UPEC菌株papGII基因检出率(5/11,45%)[19]。
对pap基因在尿路感染过程中所起的具体作用,至今颇有争议。用基因重组技术构造表达或不表达pap的E.coli感染小鼠模型后发现,表达pap的菌株在肾脏中停留时间更长,说明P型菌毛可帮助UPEC更好地在泌尿道特别是肾脏中定植[20]。但另一项研究则发现,pap野生型和pap等位基因缺失突变型E.coli菌株分别感染小鼠后,小鼠尿液、膀胱及肾脏中2种菌的菌落计数无显著差异[21]。
3 S型和F1C型菌毛
UPEC表达的S型和F1C型菌毛基因具有同源性。S型菌毛可引起MRHA,F1C型菌毛却不能引起MRHA。S型菌毛结构与1型及P型菌毛基本相似,顶端SfaS亚基是主要黏附因子。与SfaS结合的受体主要存在于肾脏上皮细胞和血管内皮细胞[22]。S型菌毛可介导细菌在组织间播散,并可透过正常血-脑屏障,与E.coli引起的败血症、脑膜炎有关[23]。另有研究发现,膀胱表面上皮细胞存在该菌毛受体,S型菌毛可能在膀胱炎发生中起一定作用。原位杂交技术也发现,S型菌毛可黏附于人膀胱和肾脏上皮[24]。F1C型菌毛(foc)与S型菌毛(sfa)基因同源,但识别受体不同,主要结合远端肾小管和集合管上皮细胞膜糖脂上的β-GalNAc-(1-4)-β-Gal残基。
临床上,25%~30%的UPEC分离株有sfa基因表达[25]。用PCR技术检测急性膀胱炎、急性肾盂肾炎患者尿液中分离的UPEC及正常人粪便中分离的E.coli黏附因子基因,发现sfa与foc两者只存其一,UPEC中含sfa或foc比例(35%)显著高于正常粪便标本中的E.coli(11%),而急性膀胱炎(33%)与急性肾盂肾炎(42%)尿液标本中UPEC含sfa或foc比例无显著差异[26]。从54份尿路感染犬的尿液和粪便标本中分离E.coli,发现仅从粪便分离的E.coli含sfa基因比例为6%,尿液或尿液、粪便同时培养的E.coli含sfa基因比例为54%[16]。也有研究发现,引起肾盂肾炎UPEC菌株的sfa基因阳性率(35%)高于引起膀胱炎的菌株(7%)[27]。虽然这些研究提示S型菌毛与尿路感染有一定联系,但具体机制尚不清楚。
4 Afa/Dr黏附因子家族
引起人类腹泻的E.coli中有一型因具有弥散黏附特性而被命名为弥散黏附型E.coli(diffusely adheringE.coli, DAEC),表达Afa/Dr黏附因子的DAEC又常与尿路感染(包括肾盂肾炎、膀胱炎和无症状菌尿)相关[28,29]。Afa/Dr黏附因子家族成员按结构特点分3类:菌毛型(fimbrial),包括Dr、F1845;无菌毛型(afimbrial),有AfaE-Ⅰ、AfaE-Ⅱ、AfaE-Ⅲ、AfaE-Ⅴ、AfaE-Ⅶ和AfaE-Ⅷ;非菌毛型(nonfimbrial),包括Dr-Ⅱ、Nfa-Ⅰ。编码Afa/Dr黏附因子家族的基因在结构和排列上均相似,A~D基因主要编码辅助亚基,不同成员的该基因基本相同,而E基因编码具有黏附特性的分子,因而存在一定差异[29]。其中C亚基对整个黏附结构的组装起重要作用[30]。Afa/Dr黏附因子有3种受体:Ⅳ型胶原、衰变加速因子(decay accelerating factor, DAF)及癌胚抗原相关细胞黏附分子家族(carcinoembryonic antigen-related cellular adhesion molecule, CEACAM)。不同黏附分子与3种受体的亲和力各不相同。3种受体均在Afa/Dr DAEC致病机制中发挥重要作用[29]。
流行病学研究表明,表达Dr黏附因子的E.coli引起尿路感染再次发作的可能性要比无Dr黏附因子表达的E.coli高2倍,提示Dr黏附因子可能与尿路感染复发或慢性尿路感染相关[31]。draE等位基因突变后,Dr黏附因子不能完整表达,从而不能与Ⅳ型胶原结合。用上述draE突变型E.coli反复感染小鼠,建立慢性肾盂肾炎模型,发现细菌可被清除[32],说明Dr黏附因子与Ⅳ型胶原结合帮助细菌在肾脏定植。同时,Dr黏附因子参与小鼠慢性肾盂肾炎时,不仅要与Ⅳ型胶原黏附,还需其他来源于宿主或细菌的因子参与对肾脏组织的破坏[33]。在相同小鼠模型中发现,90%感染Dr黏附因子阳性E.coli的孕鼠早产,而感染Dr黏附因子阴性E.coli的孕鼠仅10%早产,原因可能与孕鼠DAF表达上升导致对Dr黏附因子阳性E.coli的敏感性提高有关[34]。但临床UPEC菌株afa基因携带率并不很高(6%, 12/204)[35]。
DraE和AfaD黏附因子参与Afa/Dr DAEC侵入上皮细胞的过程。纯化Dr菌毛并包被聚苯乙烯珠子,可观察到肌动蛋白在有Dr菌毛黏附处聚集,形成胞膜内陷,最终将珠子吞入细胞[36]。draB、draC、draD和draE基因发生突变后,Dr黏附因子阳性E.coli不能进入细胞,突变恢复后,可重获内侵能力[37]。Dr黏附因子阳性E.coli通过DAF引起α5β1整合素在细菌黏附处聚集,介导细菌入侵,该过程可被nocodazole阻断,说明该过程有微管蛋白参与[38]。AfaEⅢ和AfaD也可介导细菌侵入细胞。
除上述主要黏附因子外,还有研究发现少数UPEC有其他黏附因子表达,但作用不甚清楚。总的说来,UPEC黏附因子主要帮助细菌在泌尿道上皮定植,侵入细胞内以逃避清除,形成尿路感染反复发作的细菌贮存库;另外,介导宿主细胞的免疫反应,参与炎症过程。然而,除1型菌毛在尿路感染中的作用机制研究较清楚外,其他黏附因子的作用过程仍有很多不甚了解之处。对UPEC黏附因子作用的研究,有助于了解尿路感染反复发作的机制、研究清除病原菌的措施和开发尿路感染疫苗。
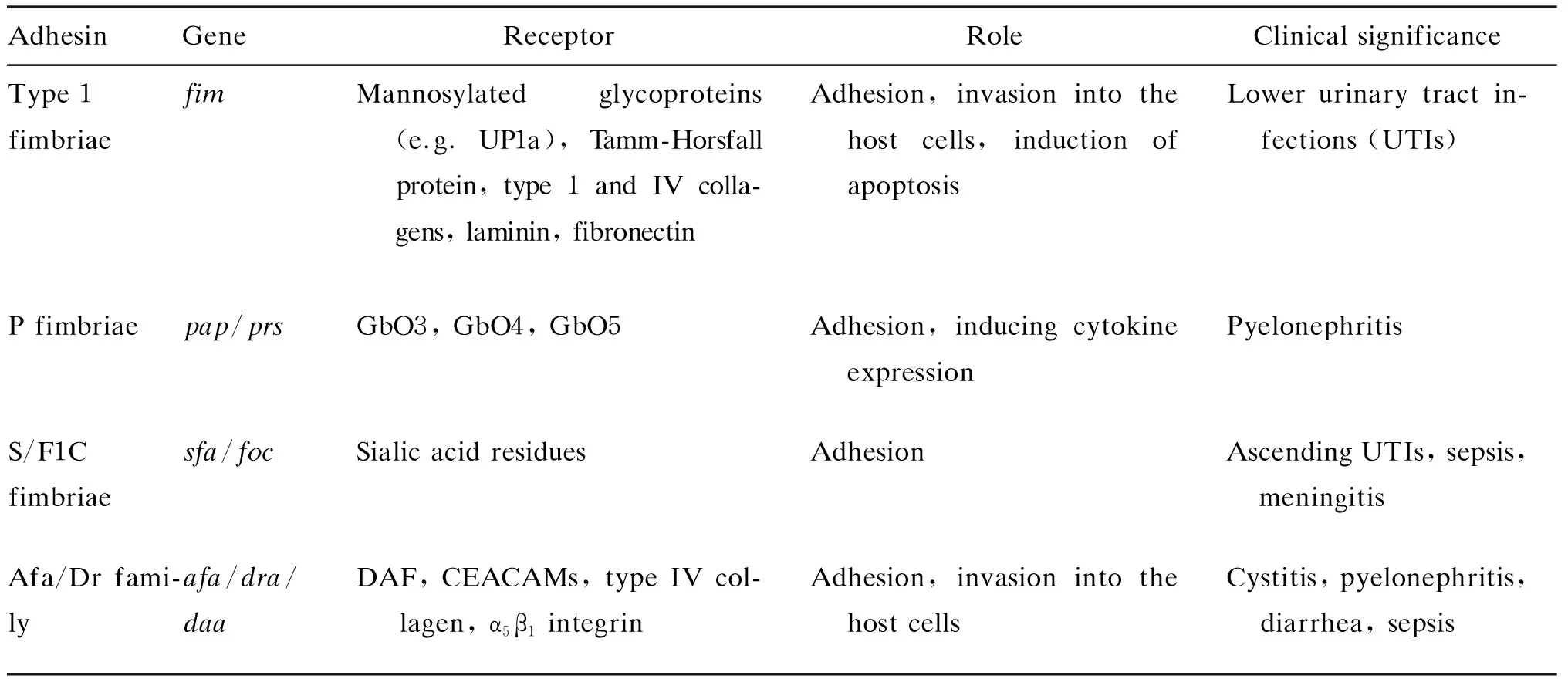
表1 UPEC 主要相关黏附因子Tab. 1 The major adhesins in uropathogenic Escherichia coli isolates
[1] Foxman B. Recurring urinary tract infection:incidence and risk factors [J]. Am J Public Health, 1990, 80(3): 331-333.
[2] Mulvey MA. Adhesion and entry of uropathogenic Escherichia coli [J]. Cell Microbiol, 2002, 4(5): 257-271.
[3] Wiles TJ, Kulesus RR, Mulvey MA. Origins and virulence mechanisms of uropathogenic Escherichia coli [J]. Exp Mol Pathol, 2008, 85(1): 11-19.
[4] Wright KJ, Hultgren SJ. Sticky fibers and uropathogenesis: bacterial adhesins in the urinary tract [J]. Future Microbiol, 2006, 1(1): 75-87.
[5] Wright KJ, Seed PC, Hultgren SJ. Development of intracellular bacterial communities of uropathogenic Escherichia coli depends on type 1 pili [J]. Cell Microbiol, 2007, 9(9): 2230-2241.
[6] Bahrani-Mougeot FK, Buckles EL, Lockatell CV, Hebel JR, Johnson DE, Tang CM, Donnenberg MS. Type 1 fimbriae and extracellular polysaccharides are preeminent uropathogenic Escherichia coli virulence determinants in the murine urinary tract [J]. Mol Microbiol, 2002, 45(4): 1079-1093.
[7] Mulvey MA, Lopez-Boado YS, Wilson CL, Roth R, Parks WC, Heuser J, Hultgren SJ. Induction and evasion of host defenses by type 1-piliated uropathogenic Escherichia coli [J]. Science, 1998, 282(5393): 1494-1497.
[8] Sokurenko EV, Courtney HS, Maslow J, Siitonen A, Hasty DL. Quantitative differences in adhesiveness of type-1 fimbriated Escherichia coli due to structural differences in fimH genes [J]. J Bacteriol, 1995, 177(13): 3680-3686.
[9] Eto DS, Jones TA, Sundsbak JL, Mulvey MA. Integrin-mediated host cell invasion by type 1-piliated uropathogenic Escherichia coli [J]. PLoS Pathog, 2007, 3(7): e100.
[10] Justice SS, Hung C, Theriot JA, Fletcher DA, Anderson GG, Footer MJ, Hultgren SJ. Differentiation and developmental pathways of uropathogenic Escherichia coli in urinary tract pathogenesis [J]. Proc Natl Acad Sci USA, 2004, 101(5): 1333-1338.
[11] Mysorekar IU, Hultgren SJ. Mechanisms of uropathogenic Escherichia coli persistence and eradication from the urinary tract [J]. Proc Natl Acad Sci USA, 2006, 103(38): 14170-14175.
[12] Wang MC, Tseng CC, Wu AB, Huang JJ, Sheu BS, Wu JJ. Different roles of host and bacterial factors in Escherichia coli extra-intestinal infections [J]. Clin Microbiol Infect, 2009, 15(4): 372-379.
[13] Schlager TA, Whittam TS, Hendley JO, Bhang JL, Wobbe CL, Stapleton A. Variation in frequency of the virulence factor gene in Escherichia coli clones colonizing the stools and urinary tracts of healthy prepubertal girls [J]. J Infect Dis, 2003, 188(7): 1059-1064.
[14] Klumpp DJ, Rycyk MT, Chen MC, Thumbikat PS. Sengupta S, Schaeffer AJ. Uropathogenic Escherichia coli induces extrinsic and intrinsic cascades to initiate urothelial apoptosis [J]. Infect Immun, 2006, 74(9): 5106-5113.
[15] Lane MC, Mobley HL. Role of P-fimbrial-mediated adherence in pyelonephritis and persistence of uropathogenic Escherichia coli (UPEC) in the mammalian kidney [J]. Kidney Int, 2007, 72(1): 19-25.
[16] Johnson JR, Kaster N, Kuskowski MA, Ling GV. Identification of urovirulence traits in Escherichia coli by comparison of urinary and rectal E.coli isolates from dogs with urinary tract infection [J]. J Clin Microbiol, 2003, 41(1): 337-345.
[17] Plos K, Connell H, Jodal U, Marklund BI, Marild S, Wettergren B, Svanborg C. Intestinal carriage of P fimbriated Escherichia coli and the susceptibility to urinary tract infection in young children [J]. J Infect Dis, 1995, 171(3): 625-631.
[18] Otto G, Sandberg T, Marklund BI, Ulleryd P, Svanborg C. Virulence factors and pap genotype in Escherichia coli isolates from women with acute pyelonephritis, with or without bacteremia [J]. Clin Infect Dis, 1993, 17(3): 448-456.
[19] Chiou YY, Chen MJ, Chiu NT, Lin CY, Tseng CC. Bacterial virulence factors are associated with occurrence of acute pyelonephritis but not renal scarring [J]. J Urol, 2010, 184(5): 2098-2102.
[20] Kisielius PV, Schwan WR, Amundsen SK, Duncan JL, Schaeffer AJ. In vivo expression and variation of Escherichia coli type 1 and P pili in the urine of adults with acute urinary tract infections [J]. Infect Immun, 1989, 57(6): 1656-1662.
[21] Mobley HL, Jarvis KG, Elwood JP, Whittle DI, Lockatell CV, Russell RG, Johnson DE, Donnenberg MS, Warren JW. Isogenic P-fimbrial deletion mutants of pyelonephritogenic Escherichia coli: the role of alpha-Gal(1-4)beta-Gal binding in virulence of a wild-type strain [J]. Mol Microbiol, 1993, 10(1): 143-155.
[22] Hanisch FG, Hacker J, Schroten H. Specificity of S fimbriae on recombinant Escherichia coli: preferential binding to gangliosides expressing NeuGc-alpha(2-3)Gal and NeuAc alpha(2-8)NeuAc [J]. Infect Immun, 1993, 61(5): 2108-2115.
[23] Wang Y, Wen ZG, Kim KS. Role of S fimbriae in Escherichia coli K1 binding to brain microvascular endothelial cells in vitro and penetration into the central nervous system in vivo [J]. Microb Pathog, 2004, 37(6): 287-293.
[24] Sakarya S, Ertem GT, Oncu S, Kocak I, Erol N, Oncu S. Escherichia coli bind to urinary bladder epithelium through nonspecific sialic acid mediated adherence [J]. FEMS Immunol Med Microbiol, 2003, 39(1): 45-50.
[25] Morin MD, Hopkins WJ. Identification of virulence genes in uropathogenic Escherichia coli by multiplex polymerase chain reaction and their association with infectivity in mice [J]. Urology, 2002, 60(3): 537-541.
[26] Mitsumori K, Terai A, Yamamoto S, Yoshida O. Identification of S, F1C and three PapG fimbrial adhesins in uropathogenic Escherichia coli by polymerase chain reaction [J]. FEMS Immunol Med Microbiol,1998, 21(4): 261-268.
[27] Eamghoraishi F, Farshad S, Kalani M. Relationship between O serotype and virulent genes in Escherichia coli causing urinary tract infections [J]. Iran J Kidney Dis, 2011, 5(4): 234-237.
[28] Daigle F, Harel J, Fairbrother JM, Lebel P. Expression and detection of pap-, sfa-, and afa-encoded fimbrial adhesin systems among uropathogenic Escherichia coli [J]. Can J Microbiol, 1994, 40(4): 286-291.
[29] Nowicki B, Selvarangan R, Nowicki S. Family of Escherichia coli Dr adhesins: decay-accelerating factor receptor recognition and invasiveness [J]. J Infect Dis, 2001, 183(Suppl 1):S24-S27.
[30] Zalewska-Piatek B, Kur M, Wilkanowicz S, Piatek R, Kur J. The DraC usher in Dr fimbriae biogenesis of uropathogenic E. coli Dr(+) strains [J]. Arch Microbiol, 2010, 192(5): 351-363.
[31] Foxman B, Zhang LX, Tallman P, Palin K, Rode C, Bloch C, Gillespie B, Marrs CF. Virulence characteristics of Escherichia coli causing first urinary tract infection predict risk of second infection [J]. J Infect Dis, 1995, 172(6): 1536-1541.
[32] Selvarangan R, Goluszko P, Singhal J, Carnoy C, Moseley S, Hudson B, Nowicki S, Nowicki B. Interaction of Dr adhesin with collagen type IV is a critical step in Escherichia coli renal persistence [J]. Infect Immun, 2004, 72(8): 4827-4835.
[33] Miettinen A, Westerlund B, Tarkkanen AM, Törnroth T, Ljungberg P, Renkonen OV, Korhonen TK. Binding of bacterial adhesins to rat glomerular mesangium in vivo [J]. Kidney Int, 1993, 43(3): 592-600.
[34] Kaul AK, Khan S, MMartens MG, Crosson JT, Lupo VR, Kaul R. Experimental gestational pyelonephritis induces preterm births and low birth weights in C3H/HeJ mice [J]. Infect Immun, 1999, 67(11): 5958-5966.
[35] Oliveira FA, Paludo KS, Arend LN, Farah SM, Pedrosa FO, Souza EM, Surek M, Picheth G, Fadel-Picheth CM. Virulence characteristics and antimicrobial susceptibility of uropathogenic Escherichia coli strains [J]. Genet Mol Res, 2011, 10(4): 4114-4125.
[36] Goluszko P, Selvarangan R, Popov V, Pham T, Wen JW, Singhal J. Decay-accelerating factor and cytoskeleton redistribution pattern in HeLa cells infected with recombinant Escherichia coli strains expressing Dr family of adhesins [J]. Infect Immun, 1999, 67(8): 3989-3997.
[37] Goluszko P, Niesel D, Nowicki B, Selvarangan R, Nowicki S, Hart A, Pawelczyk E, Das M, Urvil P, Hasan R. Dr operon-associated invasiveness of Escherichia coli from pregnant patients with pyelonephritis [J]. Infect Immun, 2001, 69(7): 4678-4680.
[38] Kansau I, Berger C, Hospital M, Amsellem R, Nicolas V, Servin AL, Bernet-Camard MF. Zipper-like internalization of Dr-positive Escherichia coli by epithelial cells is preceded by an adhesin-induced mobilization of raft-associated molecules in the initial step of adhesion [J]. Infect Immun, 2004, 72(7): 3733-3742.

