前列地尔注射液联合吡格列酮治疗早期糖尿病肾病的临床观察
康俏玲
(金华广福医院 内分泌科,浙江 金华 321000)
糖尿病肾病(diabetic nephropathy,DN)是由糖尿病微血管病变致使肾小球硬化的较为常见并发症[1],若在早期未行有效的干预措施,随着大量蛋白尿的发展,最终将引起终末期肾病,而目前对终末期肾病尚无有效的治疗方案[2]。延缓DN进展,越来越受到医学界的关注和重视。微量白蛋白尿是早期DN的标志,常伴凝血纤溶异常,表现为高凝、低纤溶和高血液黏度,导致肾硬化[3]。因此本研究采用前列地尔注射液联合吡格列酮治疗早期DN,并对其疗效进行了观察,现报告如下。
1 资料和方法
1.1 诊断标准与排除标准 诊断标准:采用1999年世界卫生组织(WHO)糖尿病诊断标准[4],DN参考Mogensen DN分型标准[5],纳入早期DN:糖尿病病史数年(6~10年),持续性微量白蛋白尿(20~200 μg/min或30~300 mg/24 h)。排除标准:1型糖尿病患者;有糖尿病酮症、酮症酸中毒等严重急性并发症者;合并有各系统严重原发疾病或严重器质性疾病和精神病患者;生命体征不稳定及严重肝肾功能不全者;凡有因素影响疗效和安全性判定者;妊娠或哺乳期妇女;过敏体质者。
1.2 一般资料 按照本试验病例诊断和排除标准,收集我院2011年3月-2012年6月确诊早期DN的患者共180例。以随机分层方法、单盲法将纳入患者分为前列地尔组、吡格列酮组和联合组(前列地尔联合吡格列酮)各60例。其中前列地尔组男32例,女28例,平均年龄(56.2±14.9)岁;吡格列酮组男31例,女29例,平均年龄(57.4±13.8)岁;联合组男33例,女27例,平均年龄(57.4±13.8)岁。三组患者具有可比性,其性别、年龄、病史和血压、血糖水平差异均无统计学意义(P>0.05)。
1.3 治疗方案 三组患者均采用教育、饮食、运动和服用降糖药物等糖尿病的基础治疗。除上述基础治疗外,前列地尔组患者还给予前列地尔注射液10μg(哈药集团生物工程有限公司出品)配于0.9%氯化钠溶液10 mL,静脉注射,每天1次;吡格列酮组服用盐酸吡格列酮片(艾可拓,武田药品有限公司)15 mg,口服,每天1次,监测血糖,适当减少原降糖药物以防止发生低血糖;联合用药组同时给予前列地尔注射液每日10μg和盐酸吡格列酮片每日15 mg口服。三组用药均4周为1疗程,治疗1疗程。
1.4 观察项目及疗效标准 检查患者治疗前后肾功能及尿蛋白的变化指标,包括血尿素氮(BUN)、血肌酐(Scr)、24 h尿蛋白量(Upr)、尿微量清蛋白(UAER)、血清同型半胱氨酸(Hcy)和β2-微球蛋白(β2-MG);检查血脂包括血清总胆固醇(TC)、甘油三脂(TG)、高密度脂蛋白胆固醇(HDL-C)、低密度脂蛋白胆固醇(LDL-C)指标。各项检查指标均采用罗氏P800全自动生化分析仪进行检测。
1.5 统计学处理方法 采用SPSS16.0统计软件。数据资料以±s表示,治疗前后数据采用配对t检验,各组间比较用方差分析。P<0.05为差异有统计学意义。
2 结果
2.1 治疗前后肾功能及尿蛋白指标的比较 治疗前三组患者的BUN、Scr、24 h Upr、UAER、Hcy和β2-MG差异无统计学意义(P>0.05)。与三组治疗前指标相比,前列地尔组、吡格列酮组和联合组患者治疗后BUN、Scr、Upr、UAER、Hcy和尿β2-MG均下降,差异有统计学意义(P<0.05)。联合组治疗后BUN、Scr、Upr、UAER、Hcy和尿β2-MG水平均下降,与其他两组治疗后指标相比差异有统计学意义(P<0.05)。见表1。
2.2 治疗前后血脂指标的比较 治疗前三组患者的TC、TG、HDL-C和LDL-C差异无统计学意义(P>0.05)。与三组治疗前指标相比,前列地尔组、吡格列酮组和联合组患者治疗后TC、TG、HDL-C和LDLC均显著下降,差异有统计学意义(P<0.01)。联合组治疗后TC、TG、HDL-C和LDL-C水平均下降,与其他两组治疗后指标相比差异有统计学意义(P<0.05)。见表2。
表1 三组患者治疗前后肾功能及尿蛋白指标的比较(n=60,±s)
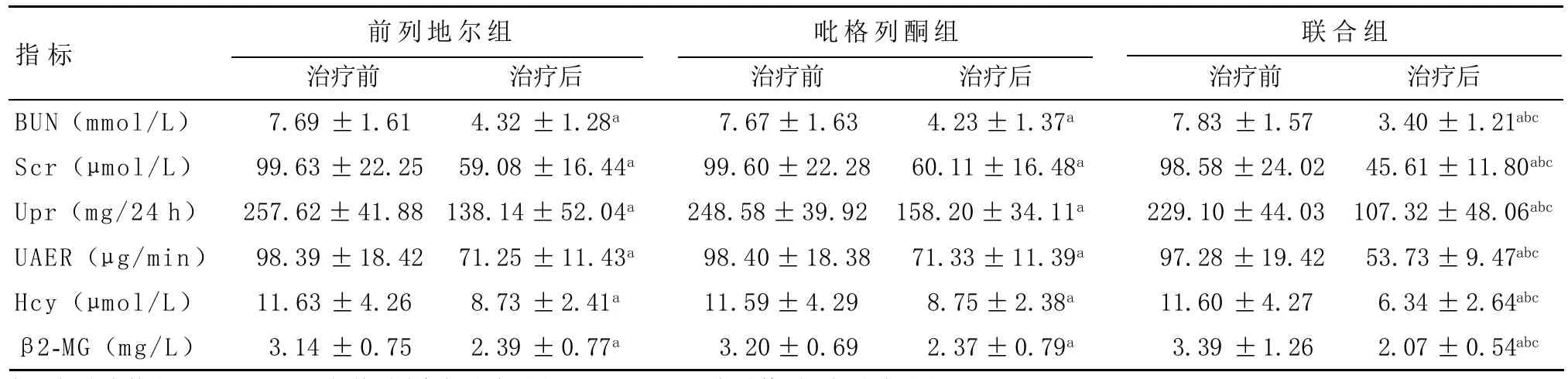
表1 三组患者治疗前后肾功能及尿蛋白指标的比较(n=60,±s)
与同组治疗前比:aP<0.05;与前列地尔组治疗后比:bP<0.05;与吡格列酮组治疗后比:cP<0.05
指标BUN(mmol/L)Scr(μmol/L)Upr(mg/24h)UAER(μg/min)Hcy(μmol/L)β2-MG(mg/L)前列地尔组 吡格列酮组 联合组治疗前7.69±1.61 99.63±22.25 257.62±41.88 98.39±18.42 11.63±4.26 3.14±0.75治疗后4.32±1.28a 59.08±16.44a 138.14±52.04a 71.25±11.43a 8.73±2.41a 2.39±0.77a治疗前7.67±1.63 99.60±22.28 248.58±39.92 98.40±18.38 11.59±4.29 3.20±0.69治疗后4.23±1.37a 60.11±16.48a 158.20±34.11a 71.33±11.39a 8.75±2.38a 2.37±0.79a治疗前7.83±1.57 98.58±24.02 229.10±44.03 97.28±19.42 11.60±4.27 3.39±1.26治疗后3.40±1.21abc 45.61±11.80abc 107.32±48.06abc 53.73±9.47abc 6.34±2.64abc 2.07±0.54abc
表2 三组患者治疗前后血脂变化(n=60,±s)

表2 三组患者治疗前后血脂变化(n=60,±s)
与同组治疗前比:aP<0.01;与前列地尔组治疗后比:bP<0.05;与吡格列酮组治疗后比:cP<0.05
指标TC(mmol/L)TG(mmol/L)LDL-C(mmol/L)HDL-C(mmol/L)前列地尔组 吡格列酮组 联合组治疗前6.38±1.18 3.30±1.02 3.68±1.57 0.80±0.27治疗后4.86±1.13a 1.64±0.69a 2.57±1.25a 1.50±0.42a治疗前6.41±1.20 3.29±1.14 4.70±1.61 0.79±0.28治疗后4.87±1.11a 1.88±0.54a 2.72±1.05a 1.53±0.40a治疗前6.35±1.18 3.31±1.01 4.63±1.56 0.82±0.28治疗后3.26±1.03abc 1.58±0.59abc 2.17±1.02abc 1.74±0.52abc
3 讨论
DN是糖尿病较为常见的并发症之一,为严重的慢性全身微血管病变,其微血管病变会导致微炎症状态,凝血纤溶功能异常,同时因高血糖、高血脂等原因使血小板合成增多,导致微血管障碍,血液黏稠度增加,加重肾脏缺血低氧[6]。此外也导致肾小球高灌注和高滤过以及肾小球基底膜通透性增加,产生大量的尿蛋白,又加重了肾小球上皮细胞损伤,导致肾脏病变很难逆转,影响DN的进展。患者在DN早期进行合理治疗,尚可使病情改善,若出现持续性蛋白尿,DN进入终末期肾病,肾功能迅速恶化[7]。因此,糖尿病患者定期行尿微量蛋白检查,在DN早期时就给予针对性的防治,对控制其进展有着重要的意义。
前列地尔为前列腺素E1脂微球载体制剂,具有强烈扩血管、抗血小板凝聚作用[8]。通过调节肾小球入球及出球小动脉,直接作用于痉挛的肾小球动脉,平滑肌细胞和系膜细胞,增加肾血流量,降低肾血管阻力及肾小球毛细血管压力[9]。因此可改善肾血流变,控制尿蛋白。前列地尔还能通过抗血小板聚集,保护细胞膜和溶酶体膜,抑制血栓素A2合成等作用降低DN的尿总蛋白和微量白蛋白,改善肾功能[10]。吡格列酮为噻唑烷二酮类增敏剂,通过激活细胞内过氧化物酶增殖激活受体-γ,改善胰岛素抵抗及相关代谢异常,使内源性胰岛素的敏感性增加[11];还可通过清除氧自由基改善内皮细胞功能[12];促进肾小球基底膜中滤过屏障负电荷增加,减少蛋白滤过,并抑制系膜细胞和基质增生[13]。
尿微量白蛋白的出现是DN早期的重要标志,是诊断DN病变时期的关键指标[14]。联合检测尿系列微蛋白不仅有助于早期诊断而且还可确切判断肾脏病变部位及损伤程度[15]。24 h尿白蛋白和β2-MG升高是反映肾小球和肾小管结构功能异常的敏感指标[16]。血Scr和BUN的水平取决于肾脏的排泄能力,是临床上判定肾功能异常最客观的指标[17]。肾脏是血浆Hcy的排泄器官,当DN肾功能下降时,将引起Hcy代谢和排泄障碍,导致高Hcy血症[18]。因此本研究结果显示前列地尔组、吡格列酮组和联合组患者治疗后BUN、Scr、Upr、UAER、Hcy和尿β2-MG均下降,且联合组治疗后BUN、Scr、Upr、UAER、Hcy和尿β2-MG水平均优于前列地尔组及吡格列酮组。同时本研究结果还显示前列地尔组、吡格列酮组和联合组患者治疗后TC、TG、HDL-C和LDL-C均显著下降,且联合组优于前列地尔组及吡格列酮组,但该研究方案对血脂的影响尚需进一步研究和探讨。
综上所述,前列地尔联合吡格列酮治疗DN早期临床效果较好,改善了肾功能和尿蛋白指标,同时对血脂有较好的调节作用,是治疗早期DN的理想药物组合,具有较高的临床推广价值。
[1] Kikkawa R, Koya D, H aneda M. Progression of diabetic nephropathy[J]. Am J Kidney Dis, 2003, 41(3 Suppl1): S19-S21.
[2] Barit D, Cooper ME. Diabetic patientsand kidney protection:an attainable target[J]. J Hypertens, 2008, 26(Suppl2): S3-S7.
[3] Balakumar P, Arora MK, Reddy J, et al. Pathophysiology of diabetic nephropathy: involvement of multifaceted signalling mechanism[J]. J Cardiovasc Pharmacol, 2009, 54(2):129-138.
[4] Reportofa WHO consultation. Definition, diagnose and classification of diabetes mellitus and its complication[S].Geneva: World Health Organization, 1999: 53-56.
[5] 陈以平. 肾病的辨证与辨病治疗[M]. 北京: 人民卫生出版社, 2003: 143-144.
[6] Esaki J, Sakaguchi H, Marui A, et al. Local sustained release of prostaglandin E1 induces neovascularization in murine hindlimb ischemia[J]. Circ J, 2009, 73(7): 1330-1336.
[7] Jerums G, Auen TJ, Canmpell DJ, et al. Long-term compari son between perimdopril and nifedipine in normotensive patients with type1 diabetes and microalbuminutia[J]. Am J Kidney Dis, 2010, 37(5): 890-899.
[8] 刘少俊, 沈守荣, 王晓艳, 等. 前列腺素E1对实验性肝纤维化大鼠TIMP-1表达的影响[J]. 中南大学学报: 医学版, 2006,31(3): 383-387.
[9] Jacobsen P, Andersen S, Jensen BR, et al. Additive effectof ACE inhibition and angiotensin II receptorblockade in type I diabetic patientswith diabetic nephropathy[J]. J Am Soc Nephro, 2003, 14(4): 992-999.
[10] Andersen S, Jacobsen P, Tarnow L, et al. Time course of the antiproteinuric and antihypertensive effect of losartan in diabetic nephropathy[J]. Nephrol Dial Transplant, 2003,18(2): 293-297.
[11] Buter H, Navis G, Dullaart RP, et al. Time course of the antiproteinuric and renal haemodynamic responses to losartan in microproteinuric IDDM[J]. Nephrol Dial Transplant, 2001, 16(4): 771-775.
[12]Aso Y, Yoshida N, Okumura K, et al. Coagulation and inflammation in overt diabetic nephropathy: association with hyperhomocysteinemia[J]. Clin Chim Acta, 2004, 348(1-2):139-145.
[13] 金菊英. 噻唑烷二酮类药物对2型糖尿病大血管病变的影响及机制[J]. 中国糖尿病杂志, 2003, 11(4): 285-287.
[14]Katharina-Susanne S, Barbara K, Eberhard R, et al. Serum creatinine, cystatin C, and beta-trace protein in diagnostic staging and predicting progression of primary nondiabetic chronic kidney disease[J]. Clin Chem, 2010, 56(5):740-749.
[15] 余玉慧. 尿系列微蛋白对糖尿病肾病的早期诊断意义[J]. 温州医学院学报, 2000, 30(2): 153-154
[16]Miller WG, Bruns DE, Hortin GL, et al. Current issues inmeasurement and reporting of urinary albumin excretion[J]. Ann Biol Clin (Paris), 2010, 68(1): 9-25.
[17]Shepherd J, Kastelein JJ, Bittner V, et al. Effect of intensive lipid lowering with atorvastatin on renal function in patients with coronary heart disease: the Treating to New Targets (TNT) study[J]. Clin J Am Soc Nephrol, 2007, 2(6):1131-1139.
[18]Mann JF, Schmieder RE, Mcqueen M, et al. Renal outcomes with telmisartan, ramipril, or both, in People at high vascular risk (the ONTARGET study): amulticentre, randomised,double-blind, controlled trial[J]. The Lancet, 2008, 372(9638): 547-553.

