甲型H1N1(2009)流感病毒实时荧光RT-PCR检测方法的建立与评价
秦智锋,张彩虹,孙 洁,刘建利,卢体康,阮周曦,林庆燕,吕建强,曹琛福,曾少灵,陈书琨,廖立珊,花群义
(1.深圳出入境检验检疫局,广东深圳518001;2.深圳市检验检疫科学研究院,广东深圳518001;3.深圳市外来有害生物质检测技术研发重点实验室,广东深圳518045)
在甲型流感病毒H1N1(2009)暴发流行期间,许多国家均有人源病毒感染猪的报道[1]。甲型H1N1(2009)病毒在猪体内可以发生变异和重组,进而产生具有潜在危害的新毒株。加强猪群中猪流感病毒(Sw ine influenza virus,SIV)、尤 其是 甲 型 H1N1(2009)流感病毒(Pandemic H1N12009)的检测和监测显得非常迫切。WHO、OIE和FAO联合要求对猪群中甲型H1N1(2009)流感病毒进行监测,并能够与其他病毒株进行鉴别,以评估甲型H1N1(2009)病毒株与其他病毒株重组的风险[1]。
WHO连续推出多个流感参考实验室的常规RT-PCR检测方法和实时荧光RT-PCR检测方法等系列SIV的分子生物学检测标准[2],包括美国疾病控制中心(CDC)推荐的A型流感病毒、SIV、H1亚型SIV的实时荧光RT-PCR(Real time RT-PCR,rRT-PCR)检测方法。尽管猪流感不是OIE必须呈报的重大动物疫病,OIE也在2009年专门重新制订了SIV检测标准[3],但其中缺少详细的快速分子生物学检测技术。美国农业部(USDA)也推荐了一种甲型H1N1(2009)[pH1N1(2009)]流感病毒实时荧RT-PCR检测方法[4]。
实际应用表明,美国CDC推荐的rRT-PCR方法存在特异性低的问题。USDA推荐的检测方法具有较高的特异性,但灵敏度较低。因此,本研究在USDA推荐的引物和探针基础上,重新设计了探针和其他改进,建立特异性快速检测甲型H1N1(2009)流感病毒的rRT-PCR方法[rRT-PCR for Pandem ic H1N1(2009),pH1N1(2009)-rRT-PCR],并在大量田间样本中进行验证实验。
1 材料和方法
1.1 病毒株 甲型H1N1流感裂解疫苗A/California/7/2009NYMC X-179A购自北京科兴生物制品有限公司;A/Human/shenzhen/0716/2009(H1N1)、A/Human/shenzhen/0804/2009(H1N1)由疾病控制中心惠赠;A/Human/shenzhen/02/2009(H1N1)和 A/Human/shenzhen/03/2009(H1N1)均由深圳儿童医院分离、鉴定;A/Sw ine/huanan/szciq-1/2006(H1N1)和 A/Sw ine/huanan/szciq-2/2006(H3N2)均由深圳出入境检验检疫局实验室分离、鉴定;A/Chicken/HK/HI/1997(H5N1)(禽流感病毒(AIV)H5亚型HI检测抗原)由香港实验室惠赠;AIV H5、H7和H9亚型标准抗原均购自哈尔滨兽医研究所。
1.2 主要试验试剂及仪器 一步法rRT-PCR试剂盒(AgPath-IDTMOne-Step RT-PCR Kit)购自ABI公司;病毒核酸抽提试剂盒(Qiagen Viral RNA Mini Kit)购自Qiagen公司;USDA推荐的甲型H1N1(2009)(pH1N1-2009)流感病毒实时荧光RT-PCR检测引物探针[5]均由上海基康公司合成。
1.3 引物与探针的设计 引物与探针的设计参考USDA推荐的甲型H1N1(2009)(pH1N1(2009))流感病毒rRT-PCR检测的引物和探针。参照Bao等流感序列分析方法[5],对甲型H1N1(2009)流感病毒序列与GenBank中登录的经典型H1N1SIV、人季节性流感H1N1病毒不同年代、不同国家地区、不同宿主的NA基因进行序列比对分析。以Clustal方式进行比对,以NA基因中最保守的20个寡核苷酸序列作为探针,在探针两侧保守区域设计特异性的上下游引物,并在反转录引物处设计了简并引物,以避免漏检。上游引物FP:5'-CAACACCAACTTTGCTGC-3',反转录引物RP:5'-GGAACCGATTCTTA(C/T)ACT GTTGTC-3', 探 针 Pb: 5'-FAM-CAGTCAGTGGTTT CCGTGAAATTAGC-BHQ-3'。
1.4 实时荧光RT-PCR检测方法(rRT-PCR)的建立 参照QIAamp Viral RNA M ini Kit操作说明书,于全自动核酸抽提工作站中抽提A/California/7/2009NYMC X-179A、A/Human/shenzhen/0716/2009(H1N1)、A/Human/shenzhen/0804/2009(H1N1)、 A/Human/shenzhen/02/2009(H1N1)、A/Human/shenzhen/03/2009(H1N1)、 A/Sw ine/huanan/szciq-1/2006(H1N1)、A/Sw ine/huanan/szciq-2/2006(H3N2)、A/Chicken/HK/HI/1997(H5N1)和AIV H5、H7和H9亚型标准HI检测抗原等11株流感病毒的与阴性对照鸡胚尿囊液中的核酸。
参照AgPath-IDTMOne-Step RT-PCR Kit操作说明书配制荧光RT-PCR反应体系:2×RT-PCR 12.5μL、酶混合物1μL、10μM 的pH1N1(2009)-FP 1μL和pH1N1(2009)-RP各 1μL、5μM pH1N1(2009)-Pb 1μL、无核酸酶的水2.5μL、RNA模板5μL。
PCR反应程序为:45℃30m in;95℃10m in;95℃ 10s、60℃ 30s,40个循环;设置60℃ 时收集荧光信号。
1.55 种实时荧光RT-PCR检测方法灵敏度比较选取A/California/7/2009NYMC X-179A裂解疫苗株作为灵敏度的研究对象,该病毒株的HA滴度为1∶640,鸡胚半数致死量为108.5EID50/m L。以无核酸酶的水10倍系列稀释成1×10-1~1×10-10,采用EZ1抽提核酸。按照WHO推荐美国CDC建立的检测方法和美国农业部推荐的检测方法,与本研究建立的pH1N1(2009)-rRT-PCR方法进行灵敏度检测比较,确定所建立方法的灵敏度。
1.65 种实时荧光RT-PCR检测方法特异性比较采用建立pH1N1(2009)-rRT-PCR方法对11株流感病毒株进行检测,确定本研究建立的检测方法与经典型SIV H1N1及其他亚型之间的交叉反应。采用本研究建立的方法对实验室保存的鸡肉正常组织、鸡血清、火鸡肌肉组织、鸽组织、猪肉组织、猪血清、正常鸡胚尿囊液、其他家禽病毒和细菌共16份非流感毒株样品进行检测,进一步确定所建立方法的特异性。
采用抽提的核酸,同时评估WHO推荐的美国CDC建立的 CDC-InfA-rRT-PCR、CDC-SW-InfA-rRT-PCR、CDC-SW-H1-rRT-PCR和 USDA-pH1N1(2009)-rRT-PCR检测方法的特异性。
1.7 pH1N1(2009)-rRT-PCR重复性试验 将建立的pH1N1(2009)-rRT-PCR方法组装成试剂盒,测定其稳定性。对A/California/7/2009NYMC X-179A裂解疫苗株原液进行10-4、10-5和10-6稀释后,分别抽提核酸,进行3次重复检测,确定所建立方法的组内差异。将3个梯度抽提的核酸,分别用保存1周、1个月和3个月的试剂盒进行检测,确定组间差异。
1.8 深港实验室之间的比对 为了进一步确证所建立pH1N1(2009)-rRT-PCR检测方法的准确性和可靠性,将A/Human/shenzhen/0716/2009(H1N1)、A/Sw ine/huanan/szciq-1/2006(H1N1)、A/Sw ine/huanan/szciq-2/2006(H3N2)株和本研究建立方法的相关试剂,在香港与兽医化验所进行检测方法比较。其中香港提供了3株病毒(2株为经典型猪流感H1N1、1株为香港分离的甲型H1N1流感病毒株)。
1.9 田间试验 自2009年5月份开始,从大型猪场和养禽场采集样品进行甲型H1N1流感病毒的监测。按照CDC-InfA-rRT-PCR方法进行流感病毒的筛选检测,如果检出阳性样品,再按CDC-SW-H1-rRT-PCR和pH1N1(2009)-rRT-PCR方法进行检测。
2 结果
2.1 rRT-PCR的建立 以设定的反应条件,于荧光PCR仪上进行pH1N1(2009)-rRT-PCR检测。在阴性对照成立的情况下,5株甲型H1N1(2009)流感病毒株出现特异性实时扩增,AIV和SIV均没出现特异性扩增,相互之间无相关交叉反应(图1)。

2.25 种实时荧光RT-PCR检测方法灵敏度试验结果 将10倍系列稀释的A/California/7/2009NYMCX-179A的RNA同时进行CDC-InfA-rRT-PCR、CDC-SW-InfA-rRT-PCR、CDC-SW-H1-rRT-PCR、USDA-pH1N1(2009)-rRT-PCR和pH1N1(2009)-rRT-PCR灵敏度测定。结果显示,所建立的pH1N1(2009)-rRT-PCR检测方法的灵敏度为 10-6,即4.51EID50(图 2)。 CDC-InfA-rRT-PCR(图 3)、 CDC-SW-InfA-rRT-PCR(图略)和 CDC-SW-H1-rRT-PCR(图略)的灵敏度为10-6,即4.51EID50。美国农业部推荐的USDA-pH1N1(2009)-rRT-PCR检测方法的灵敏度为10-5, 即 45.1EID50(图 4)。pH1N1(2009)灵 敏 度 与CDC-InfA-rRT-PCR的灵敏度相当,比USDA-pH1N1(2009)-rRT-PCR灵敏度高10倍,并且荧光增幅也较高。所建立的pH1N1(2009)-rRT-PCR检测方法检测5株甲型H1N1(2009)流感病毒的灵敏度为100%(5/5),无漏检现象。

2.35 种实时荧光RT-PCR检测方法特异性试验结果 对11株流感病毒株进行特异性检测,5株甲型H1N1(2009)流感病毒株结果为阳性,其他6株非甲型H1N1(2009)流感病毒株均无扩增结果。表明本研究建立的方法特异性强,在流感病毒亚型之间无交叉反应(图1)。通过对16份非流感病毒株阳性样品的检测,结果均为阴性(图略),表明本研究建立的pH1N1(2009)-rRT-PCR检测方法的特异性为100%(27/27)。表明该方法特异性强,与其他检测对象无交叉反应。
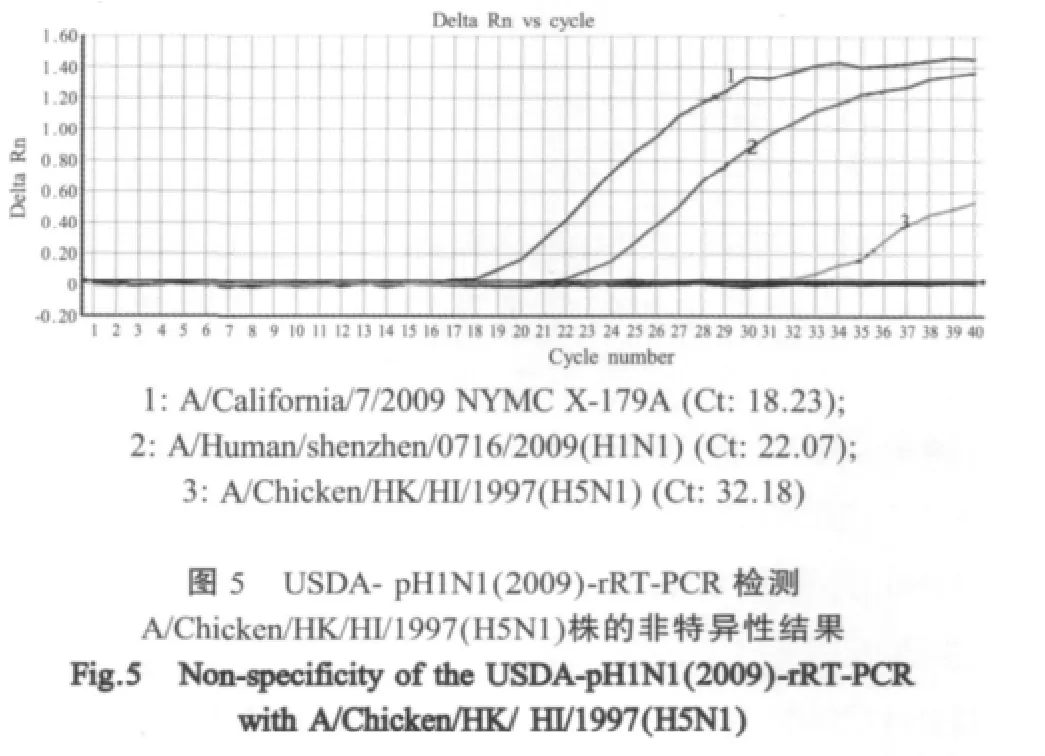
针对所有亚型的流感病毒,通用型检测方法CDC-InfA-rRT-PCR特异性较好,能够全部扩增出11株流感病毒株,与其他非流感病毒株的16份核酸样品无交叉。CDC-SW-InfA-rRT-PCR主要是用来检测SIV,但试验表明,该方法不但可以检测出SIV A/Sw ine/huanan/szciq-1/2006(H1N1),而且能够检测出 AIV A/Chicken/HK/HI/1997(H5N1)和 AIV H5、H7和H9亚型标准抗原,但却不能检测出SIV A/Sw ine/huanan/szciq-2/2006(H3N2)。CDC-SW-H1-rRT-PCR可以特异性检测所有经典型的H1N1流感和甲型H1N1(2009)流感病毒,但不能将两者区分开来。USDA-pH1N1(2009)-rRT-PCR特异性较差,在检测A/Chicken/HK/HI/1997(H5N1)株时有微弱的扩增信号(图 5)。
2.4 重复性试验结果 采用本研究组装的pH1N1(2009)-rRT-PCR检测试剂盒测定A/California/7/2009NYMC X-179A裂解疫苗株10-4、10-5和10-63个稀释度的组内变异系数CV≤0.45%,符合检测试剂盒的要求。不同时期组装的试剂盒测定3个稀释度后的组间差异系数为1.89%~3.72%,初步将检测试剂盒的有效期定为6个月(表1)。

表1 pH1N1(2009)-rRT-PCR检测试剂盒的组内和组间重复性实验结果Table 1Intra-assay and inter-assay reproducibility test of the pH1N1(2009)-rRT-PCR kit
2.5 深港实验室之间的比较 本研究建立的pH1N1(2009)-rRT-PCR检测方法与香港实验室同时进行6株流感病毒株的检测,可以特异性地检测出两株甲型H1N1(2009)流感病毒株。检测香港甲型H1N1(2009)分离株的灵敏度为10-6。所建立的方法与香港采用的方法特异性和灵敏度一致,但扩增效率明显高于香港方法(图略)。
2.6 田间试验 采集2009年~2011年注册猪场和注册禽场近3800份混合棉拭子样品进行3种rRT-PCR检测。其中CDC-InfA-rRT-PCR和CDCSW-H1-rRT-PCR两种方法共筛选出23例阳性样本,但经pH1N1(2009)-rRT-PCR检测全部为阴性。挑选其中8例样本送至国家参考实验室进行亚型确定,检测结果全部为经典型猪流感H1N1,而未检测到甲型H1N1(2009)流感病毒。pH1N1(2009)-rRT-PCR检测方法与国家参考实验室检测结果一致。
3 讨论
甲型H1N1(2009)流感病毒在许多洲的猪群中均有检出,同时也进行了人工感染和传播试验[1]。目前没有证据表明猪在甲型H1N1(2009)流感病毒的流行病学中具有重要的作用。但香港已经发现甲型H1N1(2009)流感病毒已经开始与一些经典型的H1N1流感病毒和其他亚型发生重组,可能导致新的高传播性病毒株出现。因此,对猪群中的甲型H1N1(2009)流感病毒进行流行病学调查和普查监测尤为迫切。鉴于SIV的危害性,WHO、FAO和OIE均加大了对SIV的检测和监测。世界各国对动物及动物进出口产品贸易中甲型H1N1(2009)流感病毒实施严格的控制和检疫。
实时荧光PCR由于具有灵敏、准确、快速的特点而被国内外广泛应用于临床诊断[6-7]。WHO在2009年4月甲型H1N1(2009)流感病毒株暴发流行期间,将CDC所建立的甲型H1N1(2009)流感病毒实时荧光RT-PCR检测方法作为国际标准。但本研究在对WHO推荐的方法进行评估过程中表明,这些检测方法的特异性存在问题,不能对甲型H1N1(2009)流感病毒和经典型SIV H1N1病毒进行区分。美国CDC建立的特异性检测SIV的CDC-SW-InfA-rRT-PCR检测方法,在检测H1N1亚型SIV和AIV样品时也表现出阳性结果,并且对于A/Swine/huanan/szciq-2/2006(H3N2)非H1N1亚型病毒株出现漏检。美国农业部推荐的USDA-pH1N1(2009)-rRTPCR检测方法可以区分经典型SIV H1N1和甲型H1N1(2009)流感病毒,但检测灵敏度较低(10-5),并且对检测A/Chicken/HK/HI/1997(H5N1)株有微弱非特异性反应。Blast分析表明,其探针位点有4个碱基缺失。根据理论推算,探针中每一个碱基的错配可导致降低约一个Ct值[8]。另外其上游引物也出现了一个碱基的错配和一个碱基的缺失。本研究在美国农业部推荐的引物和探针基础上,重新设计了探针,确保100%相符率,并且在反转录引物处设计了简并引物,以避免漏检[9-10]。在扩增反应中提高了退火温度,以确保检测方法的特异性[11]。
本研究建立的pH1N1(2009)-rRT-PCR检测方法对检测甲型H1N1流感裂解疫苗的灵敏度可以达到10-6,与WHO推荐的A型流感病毒实时荧光PCR检测方法的灵敏度相同,而高于美国农业部推荐方法的检测灵敏度(10-5)。pH1N1(2009)-rRT-PCR检测方法与经典型H1N1和其他亚型流感病毒株无任何交叉反应,可以有效区分经典型SIV H1N1和甲型H1N1(2009)流感病毒,保证了检测的特异性。与香港兽医化验所进行了检测比较,检测灵敏度和特异性完全一致。田间试验对3800份猪和禽类样品进行检测,CDC-InfA-rRT-PCR和CDC-SW-H1-rRTPCR方法检测到的23份阳性样品,经pH1N1(2009)-rRT-PCR检测均为阴性。抽样送国家参考实验室进行检测,结果也均为阴性,证实了pH1N1(2009)-rRT-PCR检测方法的在田间试验中具有较高的特异性。本研究建立的检测方法灵敏度高、特异性好,适合于甲型H1N1流感病毒的分子生物学检测和田间样品的大规模普查监测。
[1]Hana M,Weingartl,Yohannes B,et al.Genetic and pathobiologic characterization of Pandemic H1N12009influenzaes from a naturally infected sw ine herd[J].JVirol,2010,84(5):2245-2256.
[2]WHO.CDC protocol of real time RT-PCR for influenza A(H1N1) [EB/CD]. http://www.who.int/csr/resources/publications/sw ineflu/realtimeptpcr/en/,2009.
[3]OIE,Manual of diagnostic tests and vaccines for terrestrial animals 2008[EB].http://www.oie.int/international-standard-setting/terrestrial-manual/access-online/,2011.
[4]David S,Erica S.SEPRL V.051209real time RT-PCR for the detection of H1N12009N1gene[S].National Veterinary Serv Lab Test Protoc,2009.
[5]Bao Y,Bolotov P,Dernovoy D,et al.The influenza resource at the national center for biotechnology information[J].J Virol,2008,82(2):596-601.
[6]Mackay IM,Arden K E,Nitsche.Real-time PCR in virology[J].Nucleic Acids Res,2002,30:1292-1305.
[7]秦智锋,吕建强,肖性龙,等.禽流感H5、H7、H9亚型多重实时荧光RT-PCR检测方法的建立[J].病毒学报,2006,22(2):131-136.
[8]秦智锋,吕建强,肖性龙,等.禽流感H5、H7、H9亚型多重实时荧光RT-PCR检测试剂盒灵敏性试验[J].中国预防兽医学报,2006,28(03):336-340.
[9]Van Elden L J,Nijhuis M,Schipper P,et al.Simultaneous detection of influenza viruses A and B using real-time quantitative PCR[J].JClin M icrobiol,2001,39(1):196-200.
[10]Spackman E,Senne D A,Myers T J,et al.Development of a real-time reverse transcriptase PCR assay for type A influenza virus and the avian H5and H7hemagglutinin subtypes[J].J Clin M icrobiol,2002,40(9):3256-3260.
[11]Van Borm S,Suarez D L,Boschmans M,et al.Rapid detection of Eurasian and American H7subtype influenza A viruses using a single Taq Man MGB real-time RT-PCR[J].Avian Dis,2010,54(1Suppl):632-638.

