糙米发芽过程中蛋白酶活力动态变化研究
鲁红侠,杜先锋,陈文帮,许亮亮
(1.合肥师范学院生命科学系,安徽合肥230601;2.安徽农业大学茶与食品科技学院,安徽合肥230601;3.安徽省兽药饲料监查所,安徽合肥230601)
糙米发芽过程可显著提高蛋白酶[1]、淀粉酶[2]、谷氨酸脱羧酶[3]等内源酶活力及还原糖、游离氨基酸[4]等营养成分含量,并有效降低抗营养因子植酸[5]的含量。发芽期间,糙米内的蛋白酶和谷氨酸脱羧酶等被激活,积累大量的γ-氨基丁酸(GABA)。GABA具有降低血压增强脑细胞代谢,活化肾功能、改善肝功能、防止肥胖、降压、促进乙醇代谢和消除体臭等多种医疗保健功能[6-8]。发芽糙米中GABA含量大幅度升高的主要途径之一是蛋白酶水解蛋白质生成一定量的谷氨酸,谷氨酸由谷氨酸脱羧酶催化生成GABA[9]。曹晓虹[1],丁俊胄等[2]对糙米在不同发芽时间的蛋白酶活力进行了研究,然而每种酶都有其最适温度,在不同温度下,达到酶活高峰期的时间也不一样。但是针对采用不同温度、时间浸泡和发芽的糙米,其发芽过程中蛋白酶活力的动态变化研究却未见报道。硒是一种与人及其他哺乳动物生理密切相关的微量元素,兼具营养、毒性、解毒三重生物学功能,被称为“生命保护剂”。在糙米发芽过程中添加亚硒酸钠溶液,使糙米在发芽过程中富集GABA同时进行富硒,将有毒性的无机硒转化为具有生理活性的有机硒。本研究根据单因素实验,利用响应曲面法(RSM)对糙米发芽过程中蛋白酶活力影响因素的条件进行优化,分析浸泡时间、发芽时间、发芽温度、亚硒酸钠浓度对蛋白酶活力动态变化的影响,建立影响蛋白酶活力因素的数学模型。为更进一步研究富硒发芽糙米中蛋白质降解产物谷氨酸及谷氨酸在谷氨脱羧酶作用下生成GABA的机理提供理论基础,并为开发新型富硒发芽糙米食品提供技术支持。
1 材料与方法
1.1 材料与仪器
糙米(辽粳294) 安徽燕之坊食品有限公司提供;GABA 纯度99%标准样品,购自Sigma公司;硒标准储备液 100μg/mL;乙腈、甲醇 色谱纯;亚硒酸钠、磷酸二氢钾、磷酸氢二钾、无水乙醇、三氯乙酸(TCA) 均为分析纯,由上海国药集团化学试剂有限公司提供。
1260型高效液相色谱仪 美国安捷伦公司;RV10BS25型旋转蒸发仪 美国IKA公司;SPX-150C型恒温恒湿培养箱 上海博讯实业有限公司;Multifuge X1R型高速冷冻离心机 美国Thermo公司;UV-1800型紫外分光光度计、RF-5301PC型原子荧光光度计 日本岛津公司;电子天平 上海精密科学仪器公司。
1.2 实验方法
1.2.1 糙米发芽工艺流程
糙米→除杂→筛选→分级→清洗→沥干→浸泡→发芽→干燥→除根→发芽糙米。
1.2.1.1 原料准备 选取大小均匀一的糙米粒,用自来水洗去糙米表面灰尘,再用蒸馏水清洗,沥干。
1.2.1.2 浸泡 在36℃恒温恒湿培养箱中浸泡。
1.2.1.3 发芽 将不同条件下吸水胀润的糙米放入恒温恒湿培养箱中进行不同时间、不同温度催芽(相对湿度为90%)。糙米的芽长为1mm左右时是发芽糙米的最佳状态[10],本实验的糙米材料发芽24h即可达到芽长1mm左右,当芽长超过2mm时,发芽糙米色泽偏黄、易发霉,并产生发酵味,严重影响产品品质。
1.2.2 蛋白酶液提取及酶活测定 在Harvey等[11]的测定方法上稍有修改。称取2.00g发芽糙米,用16mL磷酸缓冲液(pH7.2),冰浴研磨匀浆,4℃下10000r·min-1离心30min,上清液为蛋白酶粗提液。1mL底物(20g·L-1酪蛋白溶液)与1mL粗酶液在40℃下保温10min,90℃水浴5min灭酶,再加入2mL 0.14mol·L-1TCA溶液,室温下放置15min沉淀残余的蛋白质,6000r·min-1离心15min后上清液在275nm处测定吸光值。以酪氨酸作标准,先加TCA溶液为对照。将1g发芽糙米粗酶液催化酪蛋白每分钟产生1μg酪氨酸定义为1个蛋白酶活力单位(U)。以反应前先加入TCA溶液的体系为对照。
1.2.3 单因素实验 选择对酶活力有影响的四个因素,即发芽时间(X1)、浸泡时间(X2)、发芽温度(X3)和亚硒酸钠浓度(X4),按照1.2.2方法提取蛋白酶液,3次重复,并测定酶活。
1.2.3.1 浸泡时间对蛋白酶活力的影响 取糙米样品150g,放入35℃恒温恒湿培养箱中浸泡,每隔3h,分别取出20g糙米样品,置于35℃培养箱中,发芽24h取样提取蛋白酶液并测定酶活。
1.2.3.2 发芽时间对蛋白酶活力的影响 取糙米样品150g,放入35℃恒温恒湿培养箱中浸泡6h,分别取出20g糙米样品,置于35℃培养箱中,发芽12h后,每隔12h取样提取蛋白酶液并测定酶活。
1.2.3.3 发芽温度对蛋白酶活力的影响 取糙米样品150g,放入35℃恒温恒湿培养箱中浸泡6h,分别取出20g糙米样品,置于不同培养箱中,设置不同的发芽温度(20、25、30、35、40、45℃),发芽24h取样提取蛋白酶液并测定酶活。
1.2.3.4 亚硒酸钠浓度对蛋白酶活力的影响 取糙米样品,设置不同浓度亚硒酸钠浸泡液(0、5、10、20、30、40mg/L)浸泡6h,分别取糙米样品,置于35℃培养箱中,发芽24h取样提取蛋白酶液并测定酶活。
1.2.4 响应曲面法实验 结合单因素实验结果,采用Box-Benhnken实验设计方案,采用四因子三水平的响应曲面分析方法,分别用X1、X2、X3和X4来表示,并以+1、0、-1分别代表变量的水平,按照方程xi=(Xi-X0)/△X对自变量进行编码,式中,xi为变量的编码值,Xi为变量的真实值,X0为实验中心点变量的真实值,△X为变量的变化步长,蛋白酶活力为响应值(表1)。

表1 中心组合设计Box-Benhnken方案设计的因素和水平编码值表Table 1 Independent variables and levels for central composite rotatable design
1.2.5 发芽糙米中GABA提取与测定 准确称取优化条件下发芽的3.0g糙米,置于研钵中加超纯水手工研磨成匀浆状,定容到25mL,再于恒温水浴振荡器上振荡提取1h,用0.45μm滤膜过滤,即为样品提取液,采用HPLC法[12]测定GABA含量。HPLC分析条件为:色谱柱:安捷伦Zorbax Eclipse-AAA,C184.6mm×150mm,5μm;流动相:由A、B双组分组成,A,VCH3CN∶VH2O=1∶1;B,pH7.0的磷酸盐缓冲液。流速为1.0mL/min;检测波长为360nm;柱温35℃;进样量10μL。
1.2.6 发芽糙米中有机硒含量的测定 糙米按照优化后的浸泡和培养条件进行发芽,待发芽结束后,将发芽糙米用大量蒸馏水充分清洗,以去除表面残留的亚硒酸钠,55℃烘干至恒重后,采用原子荧光光度法[13]测定硒含量。有机硒含量=总硒-无机硒。
2 结果与讨论
2.1 单因素实验结果
2.1.1 浸泡时间对蛋白酶活力的影响 从图1可以看出,随着浸泡糙米时间的延长,酶活是先升高再降低,实验研究发现浸泡时间超过12h,浸泡液开始变浑浊,并产生异味,这是由于浸泡时间过长造成糙米表层发生部分溶解,微生物大量滋生。表明浸泡糙米的时间不宜过长,短时间浸泡可以很快达到酶活高峰期,但浸泡超过一定时间反而对酶活有一定的抑制作用,最适宜的浸泡时间为6h,酶活达到最高值。
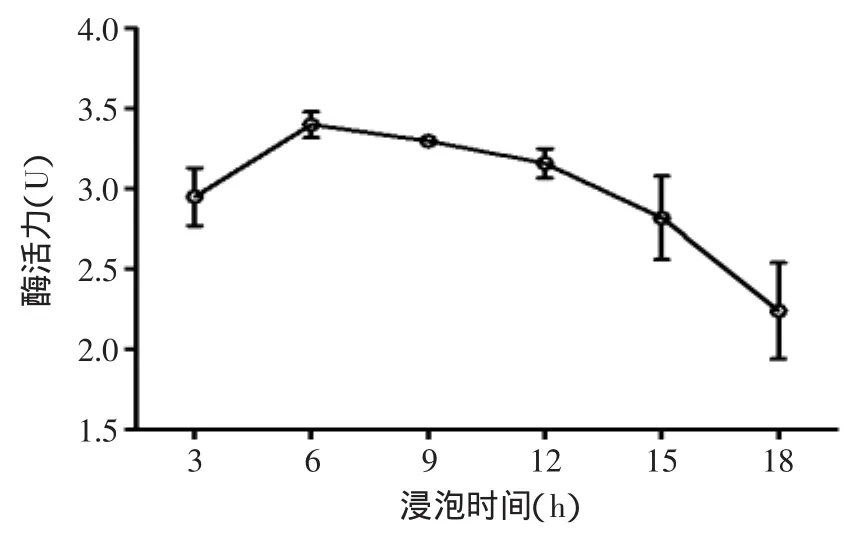
图1 浸泡时间对酶活力的影响Fig.1 Effects of soaking time on enzyme activity
2.1.2 发芽温度对蛋白酶活力的影响 从图2可以看出,45℃时,发芽糙米的酶活达到最高值,但实际情况是此温度下的发芽糙米刚刚露白,由于温度超过糙米发芽的适宜温度,发芽的糙米开始干瘪,不能继续发芽,严重影响发芽糙米品质,此数值不宜采用。当发芽温度低于45℃时,蛋白酶活先升高而后降低,当温度达到35℃时,酶活最高,说明在糙米的适宜发芽温度范围内,低温条件下,对蛋白酶有激活作用,而超过35℃,温度的升高开始抑制酶活力。
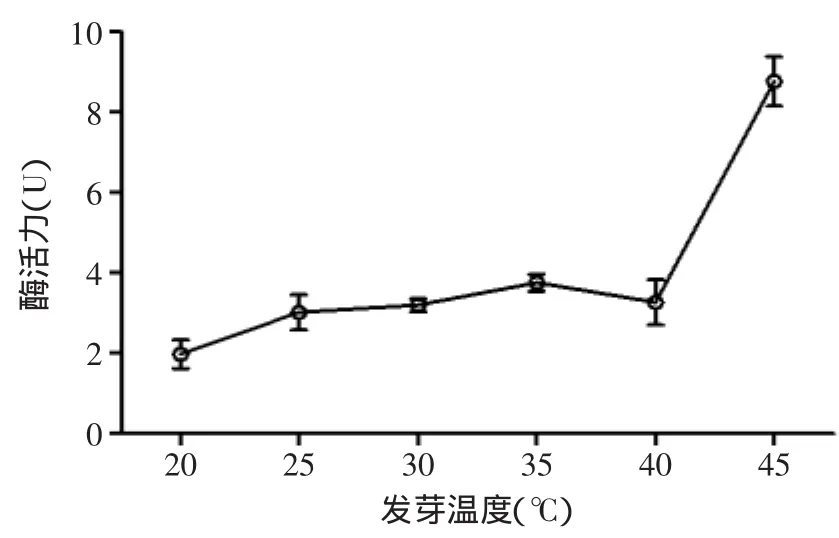
图2 发芽温度对酶活力的影响Fig.2 Effects of germination temperature on enzyme activity
2.1.3 发芽时间对蛋白酶活力的影响 从图3可以看出,糙米发芽时间在24h内,蛋白酶活力迅速提高,当发芽时间超过36h,酶活随着发芽时间增加而降低,这可能是由于发芽时间过长后,在发芽过程中产生的可溶性固形物溶于水中而流失掉,且微生物大量繁殖,开始出现腐烂现象。最适宜发芽时间在24~36h,达到发芽糙米的最佳状态1mm左右,酶活力达到最高值。
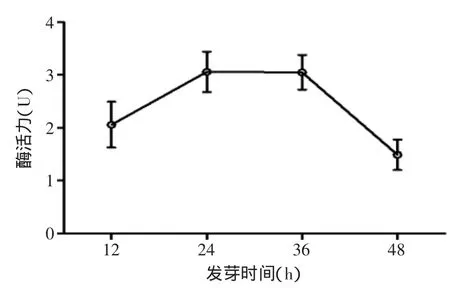
图3 发芽时间对酶活力的影响Fig.3 Effects of germination time on enzyme activity
2.1.4 亚硒酸钠浓度对蛋白酶活力的影响 从图4可以看出,低浓度亚硒酸钠对蛋白酶有激活作用,而高浓度亚硒酸钠对酶活有抑制作用,当亚硒酸钠浓度20mg/L时,酶活力最高。
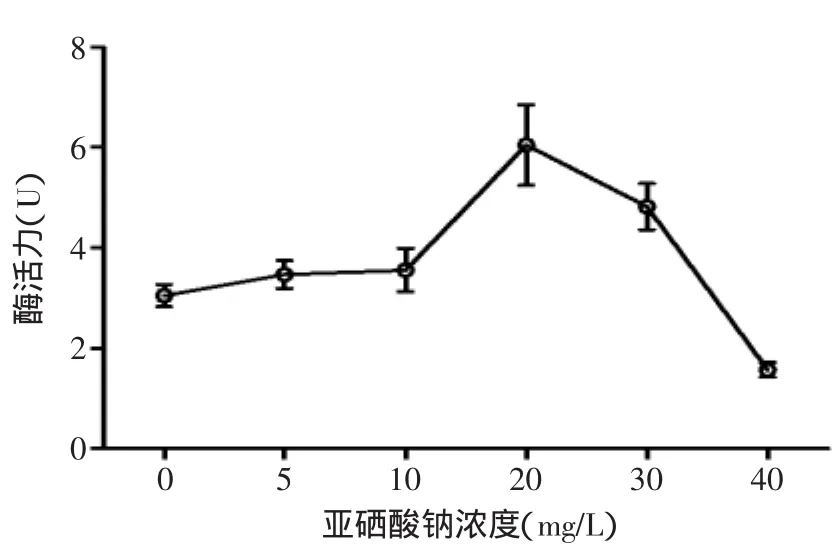
图4 亚硒酸钠浓度对酶活力的影响Fig.4 Effects of the concentration of sodium selenite on enzyme activity
2.2 响应面实验结果及分析
利用Design Expert 8.0软件,对表2的实验数据进行多元回归拟合,得到蛋白酶活力对发芽时间(X1)、浸泡时间(X2)、发芽温度(X3)和亚硒酸钠浓度(X4)的二次多项回归模型为:Y=3.66+0.82X1+0.59X2-0.88X3-0.27X4-0.59X2X4+0.51X3X4-0.57X42,对该模型进行方程分析及显著性检验,结果见表3。
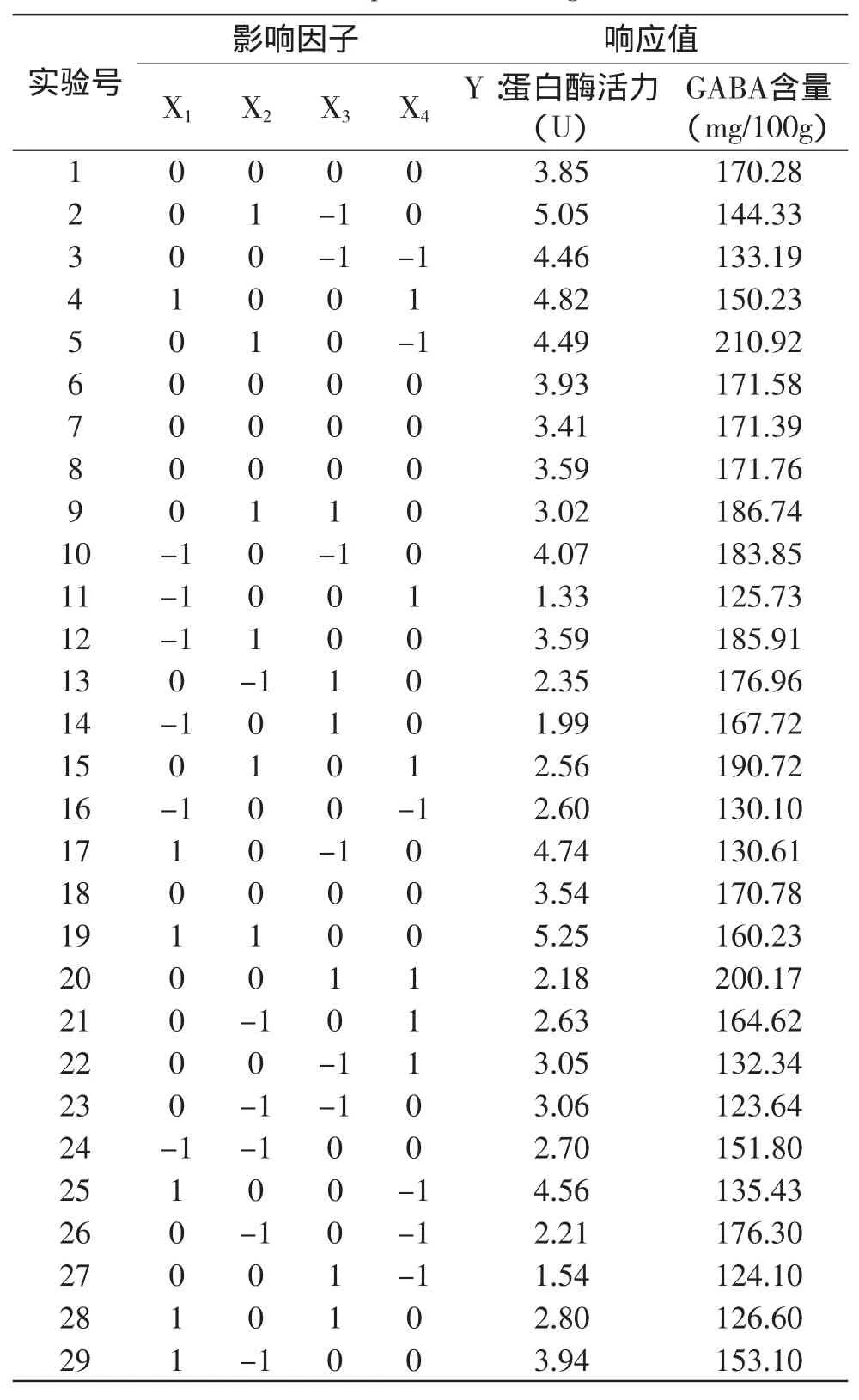
表2 Box-Behnken实验设计及实验结果Table 2 Box-Behnken experimental design matrix and results
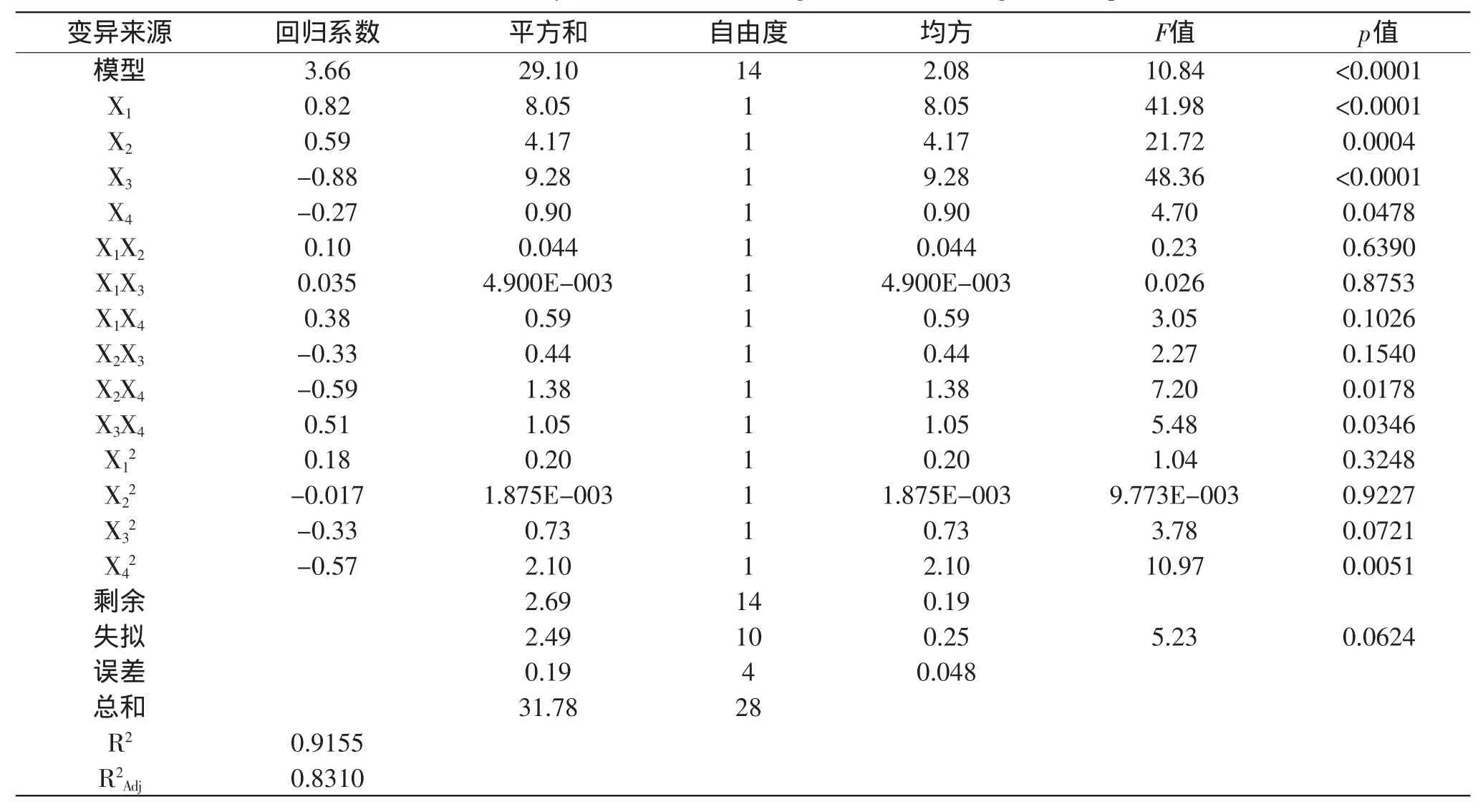
表3 实验结果方差分析及显著性检验Table 3 ANOVA analysis and coefficients significant test for regression equation
由表3可以看出,模型回归系数是3.66,p<0.0001,R2=91.55%,表明回归模型极显著,该模型与实际实验拟合很好;失拟项p=0.064>0.05,不显著;调整后的R2为83.10%,即表明模型可以解释83.10%的蛋白酶活力的变化,进一步说明回归方程的拟合程度较好,实验误差小,可信度高,该模型是合适的,可以用此模型对蛋白酶活力动态变化规律的影响因素进行分析和预测;各因素中X1、X2、X3、X4、X2X4、X3X4、X42效应均显著,说明实验因子对响应值不是简单的线性关系。由响应面回归分析和回归方程拟合可以绘出响应面图形,见图5、图6。
由图5可知,当亚硒酸钠处于低浓度时,酶活力随着浸泡时间的增加而增加,且增加幅度较大;当亚硒酸钠处于高浓度时,酶活力随着浸泡时间的增加其增加幅度而减小。糙米进行短时间浸泡时,随着亚硒酸钠浓度增大,蛋白酶活力先升高后降低;当进行长时间浸泡时,酶活力随着亚硒酸钠浓度增大呈现出下降的趋势,且亚硒酸钠浓度越大,下降的趋势越显著。因为糙米充分吸胀是糙米发芽的必要条件,当糙米充分吸胀饱和、浸泡时间过长时,细胞结构就会受到严重损害,营养物质大量损耗。细胞结构的破坏必然会使蛋白酶的活性受到抑制,从而也会影响到酶解产物GABA的生成。因此,浸泡时间不宜过长。
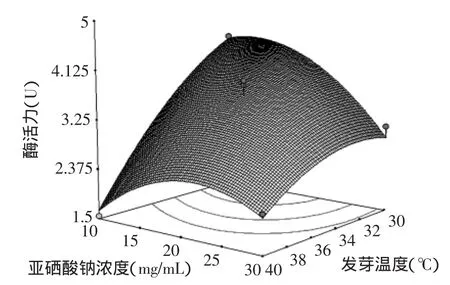
图6 亚硒酸钠浓度(X4)与发芽温度(X3)响应面立体分析图Fig.6 Response surface plot of concentration of Sodium seleniteand germination emperature
由图6可知,在发芽温度不变的条件下,当亚硒酸钠浓度逐渐增大时,发芽糙米的蛋白酶活力是先升高后降低的趋势,亚硒酸钠浓度大于20mg/L时,加入的亚硒酸钠对蛋白酶活起到抑制作用。不同浓度亚硒酸钠溶液浸泡的糙米,在发芽温度不断升高的情况下,蛋白酶活力呈下降趋势,随着亚硒酸钠浓度的增大,酶活力下降的趋势变缓。因为任何种子发芽和酶的激活都有自己的最适温度,温度偏低、偏高都会使呼吸速率降低,为糙米种子发芽提供的能量减少,物质转化的速度变慢,进而影响蛋白酶活及酶解产物GABA的生成。
2.3 最佳工艺参数的确定
为求得影响蛋白酶活力动态变化规律因素的最佳参数,利用回归拟合方程分别对各自的变量求一阶偏导数,并令其为0可得到曲面的稳定点,即最大值点。蛋白酶活力最大估计值为5.11U,各因素的取值分别为发芽时间24h、浸泡时间9h、发芽温度30℃和亚硒酸钠浓度20mg/L。为验证模型的准确性,在此条件下对实验结果进行验证,得到蛋白酶活力为5.09U,与理论预测值5.11U接近。由此可以看出,利用响应面设计来优化富硒发芽糙米蛋白酶提取工艺是可行的、有效的。
2.4 发芽糙米中GABA的含量
GABA标准色谱图及发芽糙米色谱图分别见图7、图8。
图7 GABA标准品色谱图Fig.7 Chromatogram of γ-aminobutyric acid standard powder sample
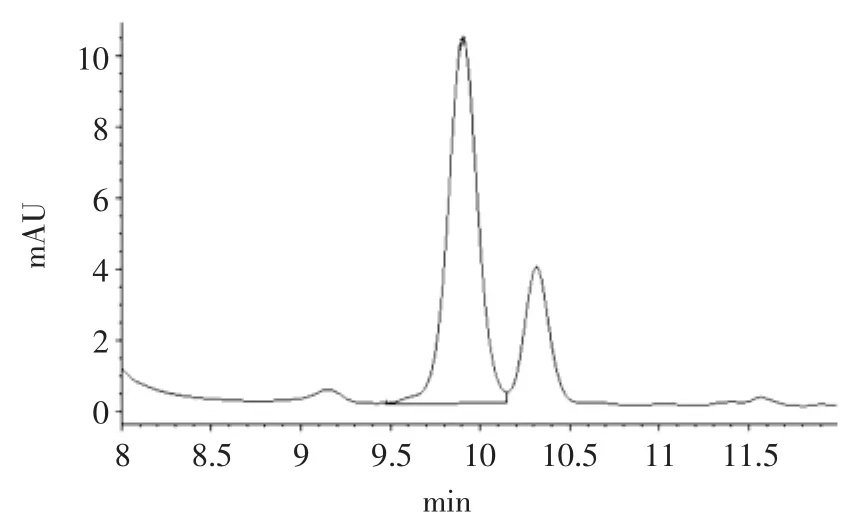
图8 发芽糙米色谱图Fig.8 Chromatogram of the germinated brown rice
在此优化发芽条件下,测得的GABA含量为144.33mg/100g。
2.5 发芽糙米中有机硒含量
采用原子荧光光度法测得优化条件下发芽的糙米中有机硒含量为0.376mg/kg。
3 结论
本研究结果显示糙米在富硒发芽过程中将有毒性的无机硒生物转化为有生理活性、易于人体吸收的有机硒。同时糙米发芽过程中,内源酶系统被激活,糙米的食用营养价值大幅度提升。在不同温度下发芽的糙米,低浓度的亚硒酸钠对酶活力有一定的激活作用,而高浓度的亚硒酸钠对酶活有抑制作用,其蛋白酶活力动态变化趋势总体是先升高再降低。每种酶都有其最适温度,过高过低对酶活都有一定的抑制作用,研究结果表明温度35℃时,糙米发芽24h,酶活达到最大有效值。在单因素实验的基础上,采用中心组合设计对糙米发芽过程中蛋白酶活力的动态变化规律影响因素进行了优化。最佳条件工艺参数为发芽时间24h、浸泡时间9h、发芽温度30℃和亚硒酸钠浓度20mg/L,在此条件下,蛋白酶活力为5.09U,GABA含量为144.33mg/100g,是未发芽糙米的28倍,有机硒含量为0.376mg/kg。
[1]曹晓虹,温焕斌,李翠娟,等.糙米发芽过程中蛋白酶活力及含氮物质的变化[J].南京农业大学学报,2010,33(2):96-100.
[2]丁俊胄,刘贞,赵思明,等.糙米发芽过程中内源酶活力及主要成分的变化[J].食品科学,2011,32(11):29-32.
[3]李冰冰,王玉萍,顾振新,等.发芽糙米与稻米的谷氨酸脱羧酶活力及γ-氨基丁酸含量比较[J].食品与发酵工业,2006,32(5):28-30.
[4]陈志刚,顾振新,汪志君,等.糙米的营养成分及其在发芽过程中的变化[J].南京农业大学学报,2003,26(3):84-87.
[5]郑艺梅,何瑞国,郑琳,等.糙米发芽过程中营养成分及植酸含量变化的研究[J].中国粮油学报,2006,21(5):1-4.
[6]Takayo SAIKUSA,Toshiroh HORINO,Yutaka MORI.Distributing of amino acids in the rice kernel and kernel fractions and the effect of water soaking on the distributing[J].J Agric Food Chem,1994,42:1122-1125.
[7]管娜娜,张晖,王立,等.米糠中γ-氨基丁酸的富集及纯化工艺研究[J].食品工业科技,2011(6):292-295.
[8]张泓,刘玉芳,许杨.发芽糙米开发价值[J].食品工业科技,2009(6):368-374.
[9]Takayo Saikusa,Toshiroh Horino,Yutaka Mori.Accumulation of γ-aminobutyric acid in the rice germ during water soaking[J].Biosci Biotech Biochem,1994,58(12):2291-2292.
[10]王传梁,陈坤杰.富硒发芽糙米加工工艺的研究[J].粮食加工与食品机械,2006(7):62-64,68.
[11]Harvey B M R,Oaks A.Characteristics of an acid protease from maize endosperm[J].Plant Physiology,1974,53:449-452.
[12]孟祥勇,张晖,陶冠军,等.反相高效液相色谱法测定发芽糙米中γ-氨基丁酸含量的影响[J].粮食与饲料工业,2008(12):41-42.
[13]GB/T 5009.93——2003食品中硒的测定[S].

