猪血红蛋白ACE抑制肽的分离和理化性质研究
邓惠玲,刘 嘉,陈光镜,阚建全,*
(1.西南大学食品科学学院,重庆400715;2.农业部农产品贮藏保鲜质量安全风险评估实验室(重庆),重庆400715)
血管紧张素转化酶(The angiotensin I-converting enzyme,ACE)是一种二肽基肽酶,在血压调节系统中起关键作用。ACE一方面通过水解作用,使不具有催化活性的血管紧张素Ⅰ成为具有促进血管收缩作用的血管紧张素II;另一方面通过降解作用,使具有舒张血管紧张作用的舒缓肌肽失活[1]。ACE酶活性过高会导致高血压病的产生,因此需要服用ACE抑制剂。一些合成的ACE抑制剂,如卡托普利、赖诺普利、卡托普利等被用来治疗高血压和心血管疾病,降压效果显著。但是研究发现,长期使用这些合成抑制剂会导致近44%的病人出现诸如咳嗽、皮疹、味觉失调等副作用[2]。Ferreira[3]首次在美洲矛头蝮的毒液中发现ACE抑制肽,此后,食源性ACE抑制肽受到众多学者的关注,被认为是最有希望取代合成ACE抑制剂的天然活性物质[4]。近年来,从各种食物蛋白质中分离纯化出许多ACE抑制肽,如Anne等[5]从牛奶中分离纯化出了a-1a f105-110,β-lg f9-14,f15-20,as1-cn f142-147,f157-164,f194-199,β-cn f108-113,f177-183和193-1989多肽。Hiroyuki等[6]从鲣鱼肉中分离纯化出Leu-Lys-Pro-Asn-Met五肽。Daodong等[7]从脱脂牛奶中分离纯化出Val-Pro-Pro三肽。Zhao等[8]从海参中分离纯化出Glu-Asp-Pro-Gly-Ala五肽。Wang等[9]从牡蛎中分离纯化出Val-Val-Tyr-Pro-Trp-Thr-Gln-Arg-Phe九肽。Hee等[10]从阿拉斯加州鳕鱼皮中分离纯化出Gly-Pro-Leu三肽。ACE抑制肽的降血压活性与其纯度密切相关,目前肽类的分离纯化方式主要包括大孔树脂[11]、凝胶色谱[12]、离子交换色谱[13]、疏水相互作用色谱[14]、高效液相色谱[15]等。本研究以猪血血红蛋白的胃蛋白酶水解液为原料,使用大孔吸附树脂DA201-C和葡聚糖凝胶Sephadex LH-20对其进行初步分离,并对初步分离后具有较高ACE抑制活性的组分进行理化性质研究,旨在为猪血红蛋白ACE抑制肽的工业开发利用提供参考依据。
1 材料与方法
1.1 材料与仪器
猪血血红蛋白粉 实验室自制;血管紧张素转化酶(ACE)(纯度2~6U/mg)、马尿酰-组胺酰-亮氨酸(HHL) Sigma公司;Pepsin胃蛋白酶(酶活20万U/g) Sigma公司;胰蛋白酶(酶活1万U/g)、胰凝乳蛋白酶(酶活1万U/g) 南宁东恒华道生物科技有限公司;Sephadex LH-20 美国GE公司;DA201-C大孔树脂(孔径0.315~1.25) 沧州宝恩化工有限公司。
ALPAAI-4LSC型真空冷冻干燥机 德国Chris公司;1-15PK型冷冻离心机 SIGMA公司;LC-20AD型高效液相色谱仪 日本岛津公司;DBS-100型电脑全自动部分收集器 上海沪西分析仪器厂;HL-2型恒流泵 上海沪西分析仪器厂;UV-2450PC型紫外可见分光光度计 SHIMADZU。
1.2 实验方法
1.2.1 猪血红蛋白酶解液的制备[16]取25g猪血红蛋白粉,加入蒸馏水(502mL),配制成4.98%(m/v)底物,以HCl(1mol/L)调节底物pH至1.98,再按照胃蛋白酶∶猪血血红蛋白粉为3∶100(w/w)的比例加入胃蛋白酶进行水解,37.6℃酶解,以HCl维持反应体系的pH恒定。水解4h后,100℃水浴10min灭酶,流水冷却至37℃,以10000r/min,5℃离心10min,收集上清液,真空冷冻干燥后备用。
1.2.2 猪血红蛋白ACE抑制肽的纯化实验
1.2.2.1 大孔树脂DA201-C的分离实验[17]在室温下,将大孔树脂浸泡于95%乙醇中24h,使其充分溶胀;然后用无水乙醇淋洗至220nm处无吸收峰;再用蒸馏水洗至无乙醇味。接着浸泡于5倍体积的5%NaOH中8h,用蒸馏水洗至pH为7;最后浸泡于5倍体积的5%HCl中8h,用蒸馏水洗至pH为7,备用。在层析柱中装满预处理好的大孔吸附树脂DA201-C(2.6cm×50cm),湿法上柱;将浓度为45mg/mL的猪血红蛋白多肽溶液30mL以0.5mL/min的流速流经层析柱,用紫外检测器检测流出液在280nm处的吸光度(A280nm),以A280nm≥0.05时停止上样。将500mL的75%(v/v)的乙醇以1.0mL/min的流速流经层析柱,以A280nm≥0.05时停止上样。收集洗脱液进行旋转蒸发浓缩后真空冷冻干燥,备用。并进行ACE抑制活性的测定和脱盐率[18]测定。
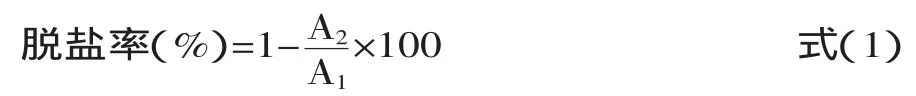
式中,A1为脱盐前样品中的灰分;A2为脱盐后样品中的灰分。
1.2.2.2 葡聚糖凝胶Sephadex LH-20的分离实验[19]在室温下将葡聚糖凝胶LH-20浸泡于55%乙醇中24h后,使其充分溶胀;然后用去离子水洗至无乙醇味,溶胀24h。0.2mol/L的HCl中浸泡12h,用去离子水洗至中性,备用。
在层析柱中装满预处理好的葡聚糖凝胶Sephadex LH-20(1.6cm×100cm),湿法上柱;取0.5g 1.2.2.1中的洗脱组分作为纯化样品溶于10mL超纯水中配成50mg/mL的上样浓度;以去离子水为洗脱剂,流速为0.2mL/min在280nm处检测吸光度,收集不同组分真空冷冻干燥,备用。
1.2.3 ACE抑制活性的测定[20]在试管中依次加入1000μL硼酸盐缓冲溶液(pH 8.3,0.2mol/L)、200μL酶解液以及10μL ACE,把以上混合液放入37℃恒温水浴中保温5min,再加入50μL5mmol/LHHL(pH8.3,0.3mol/L NaCl)于37℃中恒温30min,加入100μL 1mol/L HCl终止反应,至室温,取5μL反应产物过0.45μm水相膜处理后进样,通过反相高效液相色谱洗脱图谱定量马尿酸的生成量,从而计算ACE抑制肽的抑制率,ACE抑制率计算公式如下:
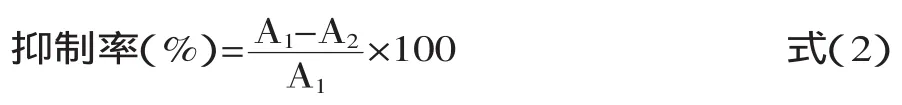
式中,A1为不存在ACE抑制肽时的峰面积;A2为存在ACE抑制肽时的峰面积。
色谱条件:高压液相色谱系统:SHIMADZU LC-20AD;检测器:SPD-M20A;色谱柱:SHIMADZU VPODS 4.6mm×150mm;洗脱液为乙腈:超纯水(24:76,v/v);洗脱液流速:0.4mL/min;检测波长:228nm,进样量:5μL。
半数抑制浓度(IC50):指当抑制率为50%时,所需抑制剂的质量浓度(mg/mL)计算方法为:检测多个质量浓度梯度下ACE抑制肽的抑制率,通过SPSS软件的概率系统(Probit)分析获得IC50值。
1.2.4 猪血红蛋白ACE抑制肽的理化性质实验
1.2.4.1 猪血红蛋白ACE抑制肽(α-Ⅱ)的溶解性实验[21]取0.5g经Sephadex LH-20分离得到的组分α-Ⅱ,加入30mL去离子水中,以1mol/L HCl和1mol/L NaOH调节pH2.0~10.0,室温下50r/min搅拌1h;9000r/min离心20min,取上清液测定其中的蛋白质含量[22],公式如下:

式中,M1为样品的质量;M2为上清液中的肽含量。
1.2.4.2 猪血红蛋白ACE抑制肽(α-Ⅱ)的模拟消化道环境稳定性实验[23]取0.1g经Sephadex LH-20分离得到的组分α-Ⅱ用去离子水配成1mg/mL的溶液(样品溶于0.1mol/L的KCl-HCl缓冲液,pH2.0)中,以1mol/L HCl调节pH到2.0,加入胃蛋白酶∶ACE抑制肽(α-Ⅱ)为1∶100(w/w)的比例加入胃蛋白酶于37℃下水解4h。反应结束后将其置于100℃水浴10min灭酶;并以1mol/L NaOH调节pH至7.0,取50mL水解液在5000r/min下离心15min,测定上清液的ACE抑制活性。在剩余的50mL水解液中再加入胰蛋白酶∶胰凝乳蛋白酶∶ACE抑制肽(α-Ⅱ)为1∶1∶100(w/w/w)的比例加入胰蛋白酶和胰凝乳蛋白酶于37℃下水解4h。反应结束后将其置于100℃水浴10min灭酶。再取适量水解液于5000r/min离心15min,测定上清液的ACE抑制活性。
1.2.4.3 猪血红蛋白ACE抑制肽(α-Ⅱ)的热稳定性实验[24]取0.1g经Sephadex LH-20分离得到的组分α-Ⅱ用去离子水配成1mg/mL的溶液,以1mol/L HCl和1mol/L NaOH调节pH7.0,分别置于温度为25、35、45、55、65、75、85、95℃下水浴2h,再测定其ACE抑制活性。
1.2.4.4 猪血红蛋白ACE抑制肽(α-Ⅱ)的pH实验[25]取0.1g经Sephadex LH-20分离得到的组分α-Ⅱ用去离子水配成1mg/mL的溶液,调节HAc-NaAc缓冲溶液的pH为2、3、4、5、6、7、8、9、10,室温放置2h,再测定其ACE抑制活性。
1.2.4.5 猪血红蛋白ACE抑制肽(α-Ⅱ)的盐稳定性实验[26]取0.1g经Sephadex LH-20分离得到的组分α-Ⅱ分别溶于0.2、0.4、0.6、0.8、1.0、1.2mol/L的NaCl溶液中,浓度为1mg/mL,室温放置2h,再测定其ACE抑制活性。
1.2.5 数据处理方法 实验数据均是经过3次平行实验得到的平均值,并计算其误差,SPSS18.0分析数据之间的相关性,Simaplot10软件作图。
2 结果与分析
2.1 猪血红蛋白ACE抑制肽的分离实验结果
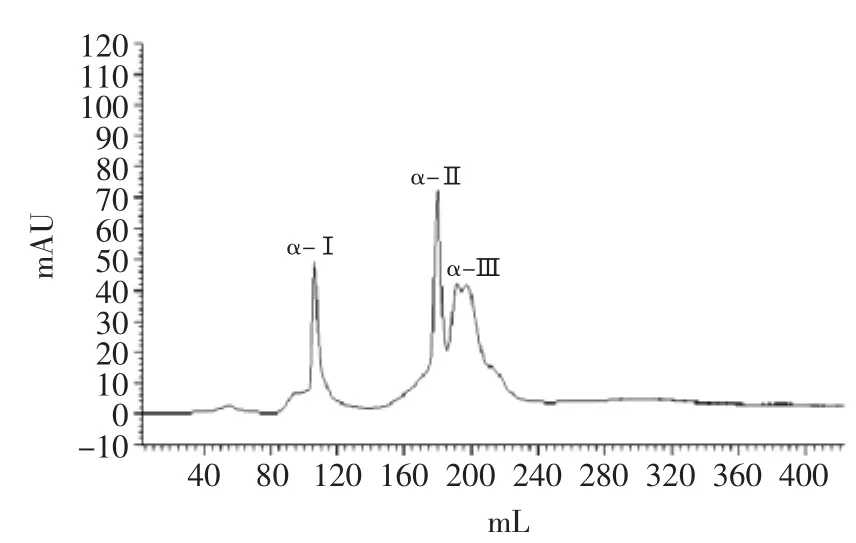
图1 Sephadex LH-20分离猪血红蛋白ACE抑制肽的HPLC图谱Fig.1 HPLC chromatograms of ACE inhibitory peptides from porcine hemoglobin separated after Sephadex LH-20

表1 不同分离方法得到的分离组分的ACE活性抑制比较Table 1 Comparison of inhibition of ACE activity of fractions prepared by different separation methods
从表1和图1可知,与酶解原液相比,分离后的组分IC50差异极显著(p<0.01)。经过大孔树脂DA201-C分离的组分ACE抑制活性明显提高,其IC50为0.87,脱盐率为94.52%;再经过葡聚糖凝胶Sephadex LH-20的分离,洗脱出3个组分,各个组分的ACE抑制活性与经过大孔树脂DA201-C分离的组分相比也均有提高;其中组分α-Ⅱ的抑制活性最强,IC50为0.21。根据凝胶过滤色谱的分离原理,分子量大的组分先出峰,分离量小的分子后出峰,由此可知,其分子量大小顺序为:α-Ⅰ<α-Ⅱ<α-Ⅲ。
2.2 猪血红蛋白ACE抑制肽(α-Ⅱ)的溶解性实验结果
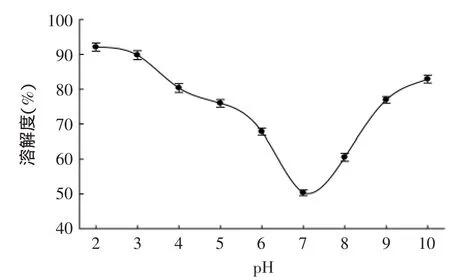
图2 猪血红蛋白ACE抑制肽(α-Ⅱ)的溶解性Fig.2 Solubility of ACE inhibitory peptides from porcine hemoglobin(α-Ⅱ)
从图2可知,猪血红蛋白ACE抑制肽α-Ⅱ的溶解性在pH7附近最低,溶解度仅为50.37%。而升高或降低pH,其溶解度均有所提高。这可能是由于血红蛋白ACE抑制肽α-Ⅱ是由不同氨基酸组成的短肽,该短肽的等电点位于pH7附近。因此,在这个范围内,分子间没有作用力,容易聚集,导致溶解度降低;加入酸或碱以后,氨基酸与酸或碱结合,分子间电荷互相排斥,不易聚集,继而溶解度变大。
2.3 猪血红蛋白ACE抑制肽(α-Ⅱ)的模拟消化道环境稳定性实验结果
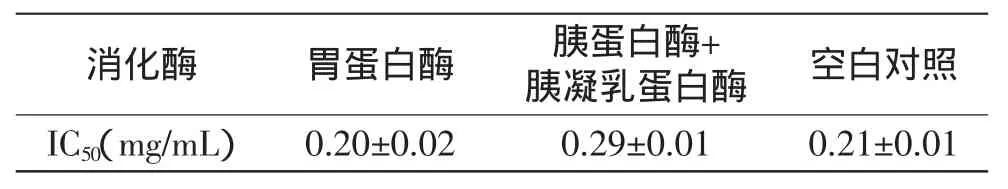
表2 消化酶对猪血红蛋白ACE抑制肽(α-Ⅱ)活性的影响Table 2 Effect of digestive enzyme on the activity of ACE inhibitory peptide(α-Ⅱ)from porcine hemoglobin
从表2可知,猪血红蛋白ACE抑制肽(α-Ⅱ)经消化酶水解后ACE活性变化不大。跟空白组比较,胃蛋白酶水解后组分的IC50变化不明显,差异不显著(p>0.05),这说明胃蛋白酶对猪血红蛋白ACE抑制肽(α-Ⅱ)的活性影响非常小;经胰蛋白酶和胰凝乳蛋白酶水解后的组分的IC50增加了4%,这可能是因为胰蛋白酶和胰凝乳蛋白酶水解了少部分多肽,打断了某些具有活性的肽段,从而降低了猪血红蛋白ACE抑制肽(α-Ⅱ)的活性。
2.4 猪血红蛋白ACE抑制肽(α-Ⅱ)的热稳定性实验结果
由图3可知,猪血红蛋白ACE抑制肽(α-Ⅱ)在不同温度下水浴2h后,其ACE抑制活性差异显著(p<0.05)有一定的变化。随着温度的升高,猪血红蛋白ACE抑制肽(α-Ⅱ)的IC50也逐渐增大。当温度在25~55℃时,猪血红蛋白ACE抑制肽(α-Ⅱ)的活性无显著变化(IC50:0.20~0.25);继续升高温度,猪血红蛋白ACE抑制肽(α-Ⅱ)的IC50也迅速增大,当温度达到95℃时,其IC50增大到1.93mg/mL。由此可知,高温对猪血红蛋白ACE抑制肽(α-Ⅱ)的活性影响较大。
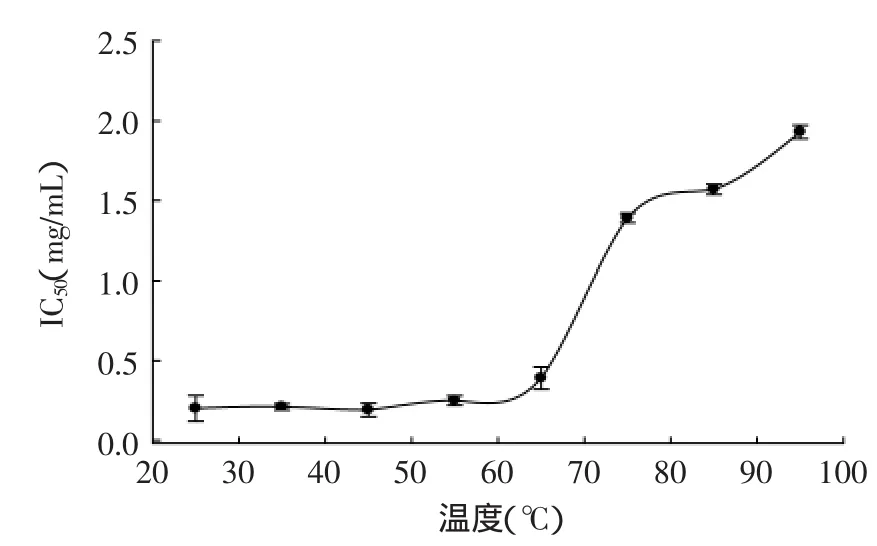
图3 温度对猪血红蛋白ACE抑制肽(α-Ⅱ)活性的影响Fig.3 Effect of temperature on the activity of ACE inhibitory peptide(α-Ⅱ)from porcine hemoglobin
2.5 猪血红蛋白ACE抑制肽(α-Ⅱ)的pH实验结果
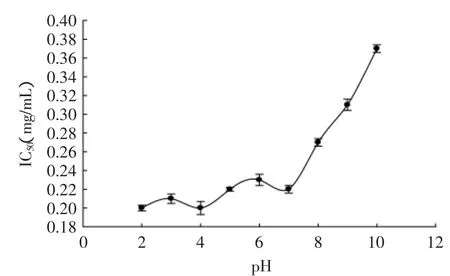
图4 pH对猪血红蛋白ACE抑制肽(α-Ⅱ)的ACE抑制活性的影响Fig.4 Effect of pH value on the activity of ACE inhibitory peptide(α-Ⅱ)from porcine hemoglobin
从图4可知,当pH在2~7之间时,猪血红蛋白ACE抑制肽(α-Ⅱ)的活性变化幅度很小,猪血红蛋白ACE抑制肽(α-Ⅱ)的IC50维持在0.21mg/mL附近。当pH大于7时,其IC50值迅速增大;当pH为10时,其IC50增大为0.37mg/mL。由此可知,猪血红蛋白ACE抑制肽(α-Ⅱ)在中性和偏酸性的条件下比较稳定。
2.6 猪血红蛋白ACE抑制肽(α-Ⅱ)的盐稳定性实验结果
在胃蛋白酶水解猪血红蛋白的过程中,需要不断地加入HCl和NaOH维持体系的pH恒定不变。酶解液在经过DA201-C大孔树脂脱盐后,其ACE抑制活性有了明显提高。从图5可知,当NaCl浓度为0.2~0.6mol/L时,猪血红蛋白ACE抑制肽(α-Ⅱ)的IC50均在0.20~0.21mg/mL的范围内小幅波动;当NaCl浓度超过0.6mol/L时,其IC50迅速增大;当NaCl浓度为1.2mol/L时,IC50为0.33mg/mL。由此可知,在浓度低于0.6mol/L的NaCl溶液中猪血红蛋白ACE抑制肽(α-Ⅱ)的活性变化小,但当其浓度较高于0.6mol/L时,就会显著降低猪血红蛋白ACE抑制肽(α-Ⅱ)的活性。由此可以进一步证明使用DA201-C大孔树脂对其脱盐作用是很明显的。
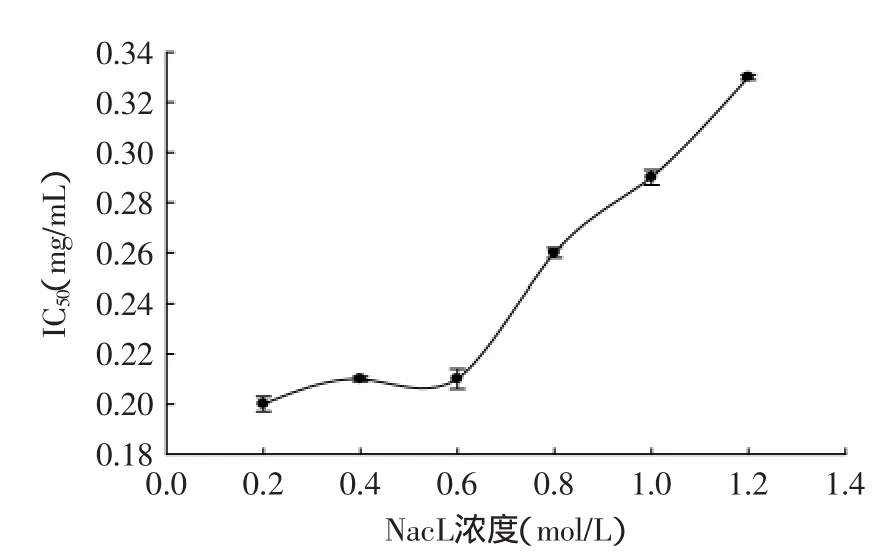
图5 NaCl浓度对猪血红蛋白ACE抑制肽(α-Ⅱ)的ACE抑制活性的影响Fig.5 Effect of NaCl concentration on the activity of ACE inhibitory peptide(α-Ⅱ)from porcine hemoglobin
3 结论
3.1 猪血红蛋白的胃蛋白酶水解液经大孔树脂DA201-C和葡聚糖凝胶Sephadex LH-20的初步分离后,其ACE抑制活性具有明显提高,与酶解原液相比,其IC50最大下降了86%。
3.2 猪血红蛋白ACE抑制肽(α-Ⅱ)在pH7时溶解度最小,为50.37%;经消化酶水解后ACE抑制活性变化不大;在温度为25~55℃时,ACE抑制活性波动不明显;在中性和偏酸性的条件下比较稳定,在NaCl浓度小于0.6mol/L时,ACE抑制活性较稳定。
[1]MURRAY B A,FITZGERALD R J.Angiotensin converting enzyme inhibitory peptides derived from food proteins:Biochemistry,bioactivity and production[J].Current Pharmaceutical Design,2007,13(8):773-791.
[2]CHEUNGIW,NAKAYAMAS,MONICANK,etal.Angiotensin-I converting enzyme inhibitory activity of hydrolysates from oat(Avena sativa) proteins by in silico and in vitro analyses[J].Journal of Agricultural and Food Chemistry,2009,57(19):9234-9242.
[3]FERREIRA S H.A bradykinin-potentiating factor(BPF)present in the venom of Bothrops jararaca[J].British Journal of Pharmacology and Chemotherapy,1965,24(1):163-169.
[4]JIMSHEENA V K,GOWDA R L.Angiotensin I-converting enzyme(ACE) inhibitory peptides derived from arachin by simulated gastric digestion[J].Food Chemistry,2011,125(2):561-569.
[5]PIHLANTOLEPPALA A,ROKKA T,KORHONEN H.Angiotensin I converting enzyme inhibitory peptides derived from bovine milk proteins[J].International Dairy Journal,1998,8(4):325-331.
[6]FUJITA H,YOSHIKAWA M.LKPNM:a prodrug-type ACE-inhibitory peptide derived from fish protein[J].Immunopharmacology,1999,44(1/2):123-127.
[7]PanDao-dong, LuoYong-kang, TANOKURA M.Antihypertensive peptides from skimmed milk hydrolysate digested by cell-free extract of Lactobacillus helveticus JCM1004[J].Food Chemistry,2005,91(1):123-129.
[8]Zhao Yuan-hui,LiBa-fang,Liu Zun-ying,etal.Antihypertensive effect and purification of an ACE inhibitory peptide from sea cucumbergelatin hydrolysate[J].Process Biochemistry,2007,42(12):1586-1591.
[9]Wang Jia-pei,Hu Jia-nen,Cui Jin-zhe,et al.Purification and identification of a ACE inhibitory peptide from oyster proteins hydrolysate and the antihypertensive effectof hydrolysate in spontaneously hypertensive rats[J].Food Chemistry,2008,111(2):302-308.
[10]BYUN H G,KIM S K.Purification and characterization of angiotensin I converting enzyme(ACE)inhibitory peptides from Alaska pollack(Theragra chalcogramma) skin[J].Process Biochemistry,2011,36(12):1155-1162.
[11]Han Hua,Yi Yang-hua,Li Ling,et al.A new triterpene glycoside from sea cucumber Holothuria leucospilota[J].Chinese Chemical Letters,2007,18(2):161-164.
[12]KIM M R,KAWAMURA Y,LEE C H.Isolation and identification of bitter peptides of tryptic hydrolysate of soybean 11S glycinin by reverse-phase high-performance liquid chromatography[J].Journal of Food Science,2003,68(8):2416-2422.
[13]Wu Jiang-ping,Ding Xiao-lin.Characterization of inhibition and stability of soy-protein-derived angiotensinⅠ-converting enzyme inhibitory peptides[J].Food Research International,2002,35(4):367-375.
[14]TAKUO N,LECH O.Purification of glycomacropeptide from nondialyzable fraction of sweet whey by hydrophobic interaction chromatography on phenyl-agarose[J].Biotechnology Letters,2000,22(5):413-416.
[15]ALEMAN A,GIMENEZ B,PEREZ-SANTIN E,et al.Contribution of Leu and Hyp residues to antioxidant and ACE-inhibitory activities of peptide sequences isolated from squid gelatin hydrolysate[J].Food Chemistry,2011,125(2):334-341.
[16]Zhao Qiu-yu,SANNIER F,PIOT J M.Kinetics of appearance of four hemorphins from bovine hemoglobin peptic hydrolysates by HPLC coupled with photodiode array detection[J].Biochimica et Biophysica Acta(BBA) -Protein Structure and Molecular Enzymology,1996,1295(1):73-80.
[17]Wan J B,Zhang Q W,Ye W C,et al.Quantification and separation of protopanaxatriol and protopanaxadiol type saponins from Panax notoginseng with macroporous resins[J].Separation and Purification Technology,2008,60(2):198-205.
[18]刘佳.大豆蛋白ACE抑制肽的研究[D].无锡:江南大学,2008.
[19]RIIHINEN K R,GODECKE T,PAULI G F,et al.Purification ofberry flavonolglycosidesby long-bed gelpermeation chromatography[J].Journal of chromatography A,2012,1244(29):20-27.
[20]Wu J,ALUKO R,MUIR A.Imp roved Method for Direct High-performance Liquid Chromatography Assay of AngiotensinconvertingEnzyme-catalyzed Reaction[J].Journal of Chromatograpy A,2002,950:125-131.
[21]盛彩虹,刘晔,刘大川,等.紫苏分离蛋白功能性研究[J].食品科学,2011,32(17):137-139.
[22]陈季旺,孙勤,夏文水.鱼降压肽的大孔树脂分离及其活性稳定性[J].食品科学,2009,30(18):25-28.
[23]LIESELOT V,GUY S,TOSHIRO M,et al.C(ACE)inhibitory peptide from the gastrointestinal hydrolysate of the cotton leafworm,Spodoptera littoralis[J].Process Biochemistry,2008,43(8):900-904.
[24]廖丹葵.鸡蛋蛋黄蛋白质制备降血压肽的研究[D].南宁:广西大学,2006.
[25]杨锋,马千里,黄永春.醋蛋中ACE抑制肽的分离及稳定性研究[J].食品科学,2009,30(24):78-79.
[26]Jiang Jiang,Chen Jie,Xiong You-ling.Structural and emulsifying properties of soy protein isolate subjected to acid and alkaline pH-shifting processes[J].Journal of Agricultural and Food Chemistry,2009,57(16):7576-7583.
[27]潘道东,林璐.DA201-C大孔吸附树脂静态吸附ACE抑制肽的研究[J].食品科学,2009,30(5):20-23.

