一株降解酒糟稻壳纤维素菌株N53的筛选与鉴定
牛梅丽,徐 慧,李文婧,刘建军,,*
(1.山东轻工业学院食品与生物工程学院,山东济南250353;2.山东省食品发酵工程重点实验室,山东济南250013)
我国是白酒生产大国,酒糟是白酒生产的副产物,据统计其年产量超过了3×107t[1]。如果酒糟得不到及时处理会引起腐败变质,浪费资源的同时还会污染环境。因此解决酒糟的综合利用问题是非常重要的。目前,酒糟没有得到有效的利用,主要是用来作为肥料或饲料[1-3]。将酒糟稻壳中同时接入能够高效降解纤维素的菌株及饲料酵母进行发酵是当前饲料业的一个发展方向,较高的纤维素酶活性及高蛋白含量的饲料酵母可将酒糟稻壳转化为猪禽可利用的成分。既缓解了我国蛋白饲料紧缺情况,又使酒糟得以综合利用,变废为宝,保护环境[3-4]。目前,能够降解纤维素的菌株有很多,主要为绿色木霉、康宁木霉及黑曲霉等几个菌株。本文报道了以酸处理后的酒糟废料为原料筛选出了一株能够高效降解酒糟稻壳纤维素的菌株,为后续生产饲料蛋白奠定了基础,有助于进一步实现酒糟的综合利用价值。
1 材料与方法
1.1 材料与仪器
酒糟 来自于山东某酿酒公司;土样 来自山东、河北、内蒙古地区;富集培养基[5]CMC-Na 1%、K2HPO4·3H2O 0.1%、Na2CO30.5%、MgSO4·7H2O 0.01%、FeSO4·7H2O 0.015%、蛋白胨1%、酵母膏1%,pH自然;筛选培养基 CMC-Na 1%、K2HPO4·3H2O 0.2%、(NH4)2SO40.4% 、MgSO4·7H2O 0.01% 、FeSO4·7H2O 0.015%、蛋白胨0.5%、酵母膏0.3%、琼脂2%,pH自然;斜面培养基 土豆200g、葡萄糖20g、琼脂20g、水1000mL,pH自然;液体产酶培养基 CMC-Na 1%、KH2PO40.4%、(NH4)2SO40.2%、MgSO4·7H2O 0.03%、GaCl2·2H2O 0.03%、蛋白胨0.3%、酵母膏0.2%,pH自然;发酵培养基 酒糟2%、麸皮1%、KH2PO40.4%、(NH4)2SO40.2% 、MgSO4·7H2O 0.03% 、GaCl2·2H2O 0.03%、蛋白胨0.3%、酵母膏0.2%,pH自然。
SPX-150生化培养箱 上海跃进医疗器械有限公司;SPH-111C恒温培养振荡器 上海世平实验设备有限公司;HH-4数显恒温水浴锅 国华电器有限公司;LDZX-75KBS立式压力蒸汽灭菌锅 上海申安医疗器械厂;722可见分光光度计 上海菁华科技仪器有限公司;TDL-5-A离心机 上海安亭科学仪器厂;LCT-10S-A净化工作台 济南绿洁空气设备厂;SMART生物显微镜 重庆奥特光学仪器有限公司;UB-7酸度计 美国丹佛。
1.2 实验方法
1.2.1 菌株的筛选方法
1.2.1.1 初筛 酒糟及土样中的微生物经富集培养后,梯度稀释至适当浓度涂布到筛选培养基中,30℃培养3~4d,挑取单菌落转接至斜面培养基中30℃培养3~4d,然后划线到筛选培养基中30℃培养,待长出单菌落后加入1%的刚果红溶液染色2h,再经1%NaCl脱色1h,观察有无透明圈的产生,并记录透明圈直径及菌落直径的大小。选取透明圈直径与菌落直径比值较大的菌株进行复筛[5-6]。
1.2.1.2 复筛 将初筛分离得到的菌株接种到液体产酶培养基中,30℃、180r/min培养3d后,测定各菌株发酵液的纤维素酶酶活,选取酶活较高的菌株[6]。
将测定出的纤维素酶酶活较高的菌株以一株接三瓶的方式接入发酵培养基中,30℃、180r/min培养3d后,测定各菌株纤维素酶的酶活,选取酶活较高且稳定的菌株作为目的菌株[7]。
1.2.1.3 纤维素酶活力的测定[7-9]还原糖的测定采用DNS(3,5-二硝基水杨酸)法测定[8]:在540nm处有最大光吸收,在一定范围内还原糖的量与反应液的颜色成比例关系,利用比色法测定还原糖的生成量即可测定出纤维素酶的活力。
a.粗酶液的制备 将菌株接种到液体产酶培养基中,30℃、180r/min培养3d后,将发酵液于4000r/min离心10min,上清液即为粗酶液[9]。
b.酶活定义 在pH5.0、50℃的条件下,粗酶液每分钟催化纤维素水解生成1μmol葡萄糖的酶量为一个酶活单位。
c.CMC-Na(羧甲基纤维素钠)酶活性的测定 取4支干净的25mL的比色管,分别编号后加入1.5mL pH5.0、1%CMC-Na的柠檬酸钠缓冲液,将4支管同时放入50℃水浴锅中预热5min后,向1号管中加入0.5mL稀释后并灭活的粗酶液,其余3支管中加入0.5mL稀释了相同倍数的粗酶液。50℃水浴30min后,取出立即加入3mL DNS终止反应,混匀后沸水浴5min后,取出立即冷却,加水定容到10mL。在540nm处以1号管为对照,测定各比色管中溶液的吸光值并记录。在DNS葡萄糖标准曲线上查出相对应的葡糖糖量并计算CMC-Na酶活。
d.滤纸酶活性(FPA)的测定 取4支干净的25mL的比色管,分别编号后加入1.5mL pH5.0的柠檬酸钠缓冲液,再分别加入一条1cm×6cm去淀粉的滤纸条,将4支管同时放入50℃水浴锅中预热5min后,向1号管中加入0.5mL稀释后并灭活的粗酶液,其余3支管中加入0.5mL稀释了相同倍数的粗酶液。50℃水浴60min后,取出立即加入3mL DNS终止反应,混匀后沸水浴5min,取出立即冷却,加水定容到10mL。在540nm处以1号管为对照,测定各比色管中溶液的吸光值并记录。在DNS葡萄糖标准曲线上查出相对应的葡萄糖量并计算滤纸酶活。
1.2.2 菌种鉴定 通过形态特征、《真菌分类鉴定手册》[10]及18s rDNA全序列分析等手段来鉴定菌种。
2 结果与分析
2.1 初筛结果
刚果红与纤维素大分子结合显示出红色,而不能与小分子的还原糖结合呈现红色,产纤维素酶的菌株在CMC-Na平板上生长产生的纤维素酶能够降解大分子的纤维素为小分子的还原糖,当加入刚果红染色时,没有被降解的大分子纤维素与刚果红结合显示出红色,而被降解为小分子的还原糖不能与刚果红结合,从而呈现出透明圈,如图1所示。其中,透明圈的直径与菌落直径的比的大小可以初步判定菌株产纤维素酶酶活力的大小。
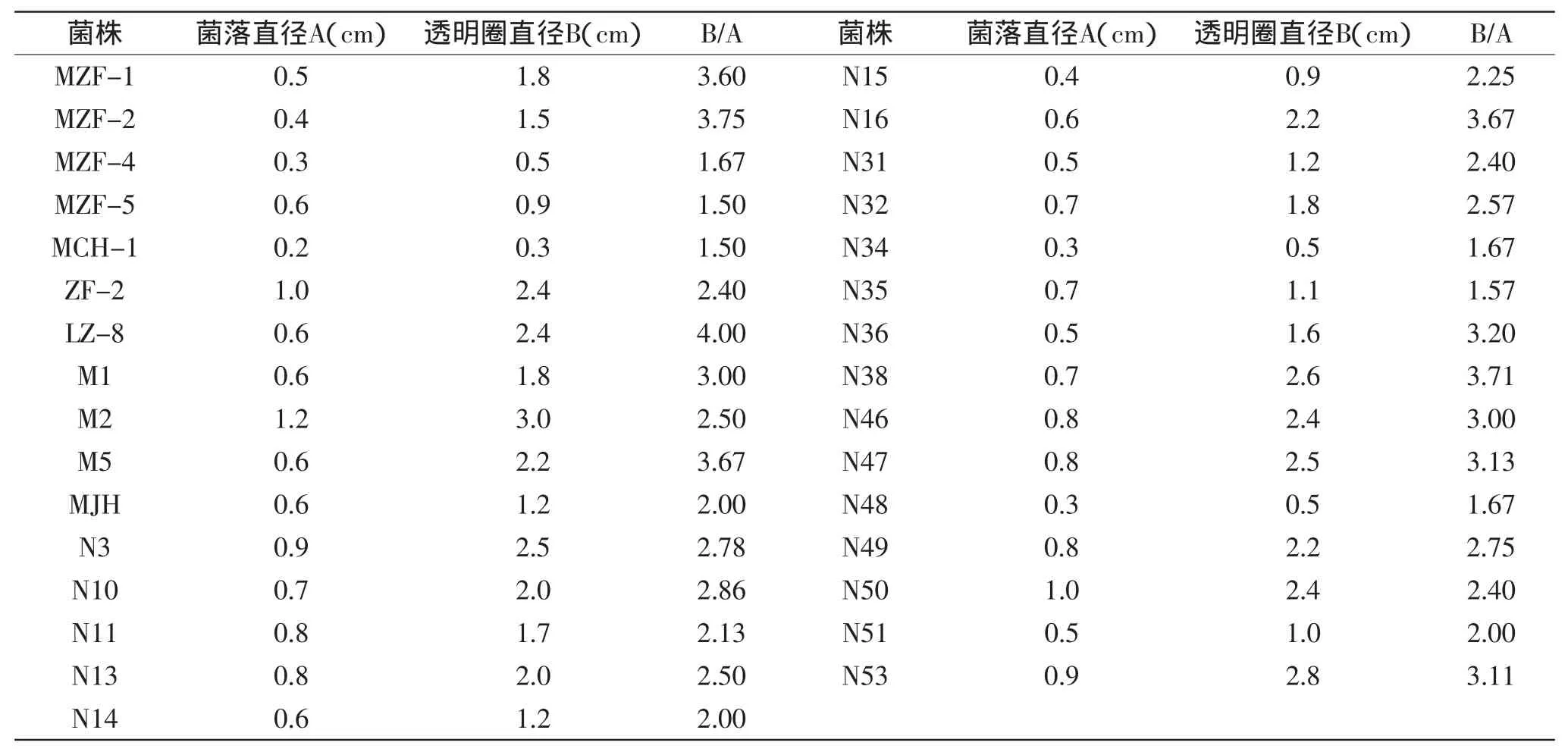
表1 不同菌株在CMC-Na平板上的透明圈大小Table 1 The size of transparent circle of different strains on CMC-Na plate
图1 CMC-Na平板上的透明圈Fig.1 The transparent circle on CMC-Na plate
从土样及稻壳中初步筛选出了193株菌,经刚果红染色后透明圈大的菌株有60株。表1是在CMC-Na平板上的透明圈直径与菌落直径比大于1.5的菌株。
2.2 复筛结果
将上述产透明圈较大的60株菌接种到液体产酶培养基中复筛,经多次重复实验得到酶活力较高的菌株共10株,如表2所示。
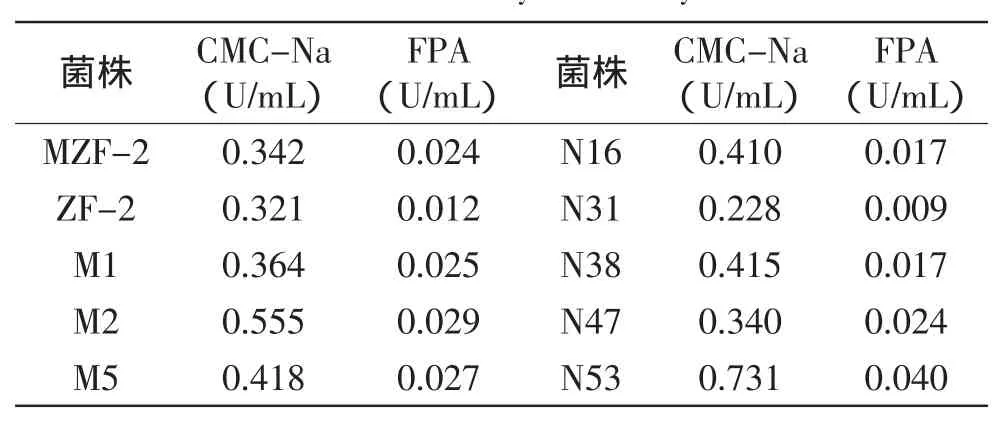
表2 10株菌产纤维素酶酶活力的大小Table 2 The cellulose enzyme activity of 10 strains
由表2可知,菌株M2、M5、N53的CMC-Na活性及滤纸酶活性都较高,故将菌株M2、M5、N53以一株接三瓶的方式接入发酵培养基中。经多次重复实验,得复筛结果,如表3所示。
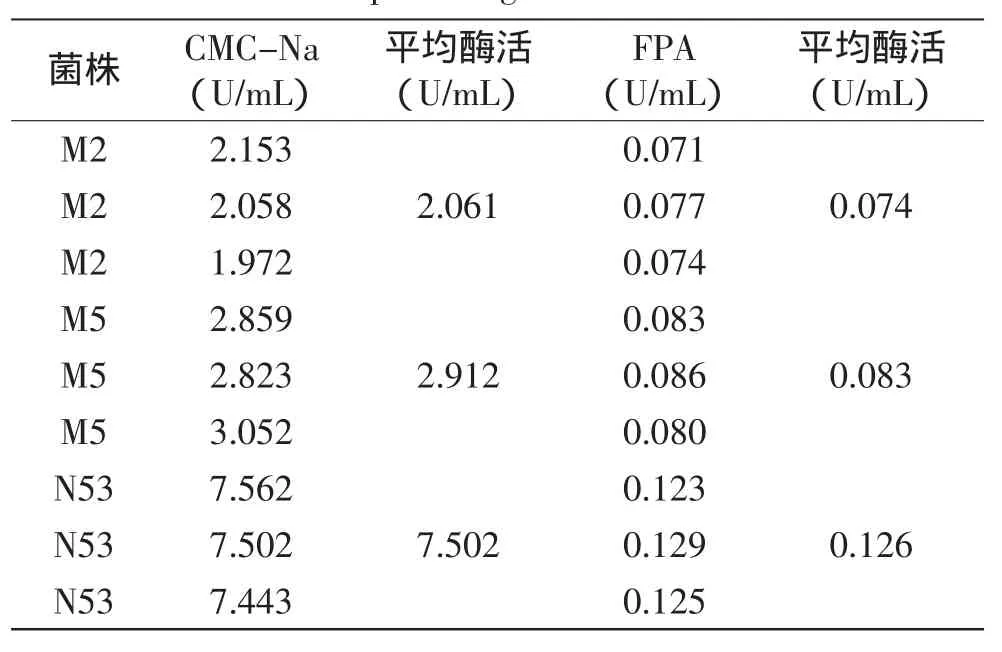
表3 纤维素酶产生菌的复筛结果Table 3 The results of secondary screening of cellulose producing strains
由表3可知,菌株N53产纤维素酶的酶活最高,稳定性较好,故选择菌株N53作为目的菌株。对比表2与表3结果,可以看出菌株N53在以发酵培养基(酒糟稻壳与麸皮)为原料培养时,CMC-Na酶活与滤纸酶活(7.502、0.126U/mL)分别是以CMC-Na(0.731、0.040U/mL)为原料培养时的10倍和3倍,故该菌株更适宜在以酒糟稻壳为主的天然碳源下生长。
2.3 菌种鉴定
2.3.1 菌株N53形态观察 菌株N53在平板上的特征如下:菌落圆形铺展,向四周成辐射状,中间成绒状,孢子成暗绿色,有白色的边缘,最后变为褐色。如图2所示。
图2 菌落形态(PDA 30℃ 4d)Fig.2 Colonial morphology(PDA 30℃ 4d)
光学显微镜下观察发现:分生孢子梗有隔膜且较长,比较光滑,顶端排列成帚状的分枝,分枝1~2次,顶层以切离法生成分生孢子,分生孢子串呈不分枝的链状,单个孢子成椭圆形,光滑无色,如图3所示。
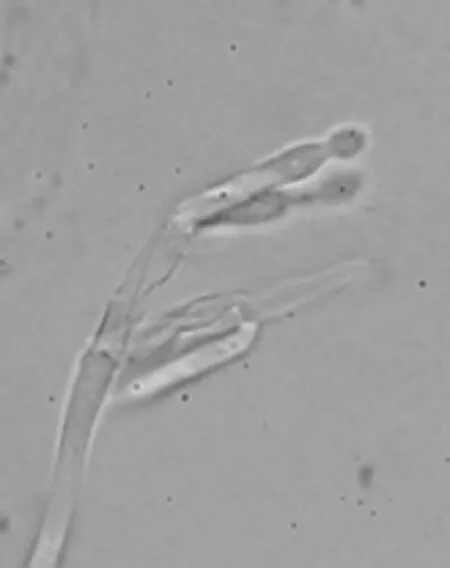
图3 分生孢子梗(1000×)Fig.3 Conidiophore peduncle(1000×)
从菌落形态及显微镜观察,按照《真菌鉴定手册》检索表进行检索,发现菌株N53与扩展青霉(Penicillium expansum)的特征最为相似。
2.3.2 18S rDNA序列分析及系统发育树的构建 18s rDNA是编码真核生物核糖体小亚基rDNA的DNA序列,序列中既有保守区又有可变区,保守序列区域反映了生物物种间的亲缘关系,而高变序列区域则能体现物种之间的差异,且18s rDNA在进化速率上比较保守,因此在系统发育研究中较适用于种级以上阶元的分类。通过基因克隆所得的菌株N53的18s rDNA序列全长为1688bp,将序列结果在NCBI中进行同源序列搜索,根据搜索结果,选取同源性较高的菌种的相关序列进行比对分析。利用MEGA 5.05软件中的Neighbor-Joining法进行分子生物学分析,构建系统发育树,如图4所示。结果表明,菌株N53与Penicillium expansum HDJZ-ZWM-17(GU227344)的遗传距离最近,核苷酸序列同源性高达99%,因此可以认为菌株N53属于Penicillium expansum(扩展青霉)。
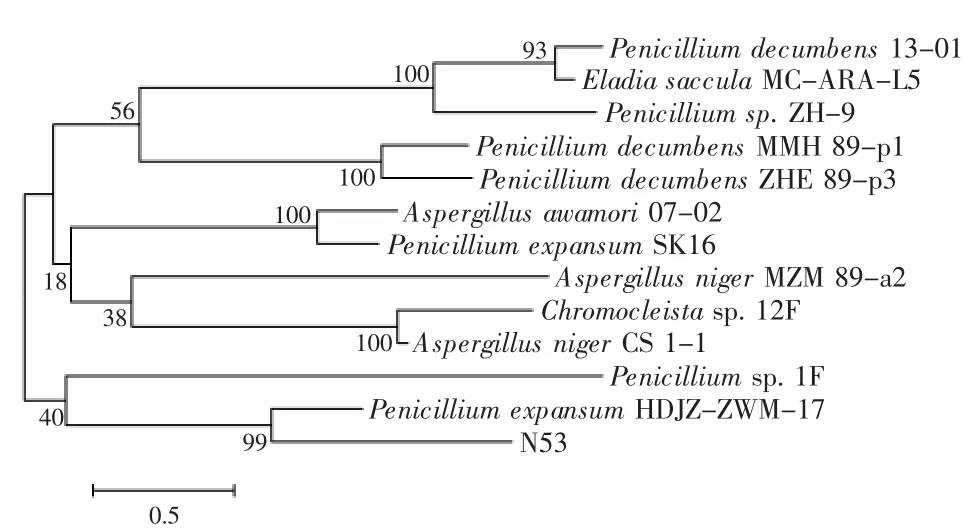
图4 菌株N53的系统发育树Fig.4 Phylogenetic tree of strain N53
3 结论
从酒糟及土样中分离出了193株能够降解酒糟稻壳纤维素的菌株,通过多轮筛选确定了一株降解效果较好的菌株N53,通过形态特征观察及18s rDNA序列分析等手段,初步鉴定菌株N53为扩展青霉菌(Penicillium expansum)。菌株N53以酒糟稻壳为碳源时产纤维素酶的酶活较高,性能稳定,是一株具有应用潜力的酒糟稻壳纤维素降解菌株。
[1]李日强,张峰,韩文辉,等.不同菌株固态发酵废白酒糟生产饲料蛋白的研究[J].重庆环境科学,2003,25(11):63-65.
[2]罗辉芬,张庆华,徐国华,等.白酒糟纤维素降解菌种的筛选[J].微生物学杂志,1997,17(4):19-22.
[3]徐坚平,刘钧松,孔维,等.利用秸秆类物质进行微生物共发酵生产单细胞蛋白[J].微生物学通报,1995,22(4):222-225.
[4]M K BHAT,S BHAT.Cellulose degrading enzymes and their potential industry applications[J].Biotechnology Advances,1997,15:583-620.
[5]曲小爽.高效桔青霉纤维素分解菌筛选及酶学初探[D].哈尔滨:东北农业大学,2009.
[6]Huang Jin-yong,Wang Mei-rong,Wang Bing.Screening and identification ofceIlulose-degradation strain M1 and its characteristics of cellulase[J].Life Science,2009,3(9):21-26.
[7]殷中伟.秸秆纤维素高效降解菌株的筛选及对秸秆降解效果初步研究[D].北京:中国农业科学院,2010.
[8]Manmeet Kaur,Dr S Arora.Isolation and Screening of Cellulose Degrading Bacteria in Kitchen Waste and Detecting Their Degrading Potential[J].Mechanical and Civil Engineering,2012,2(1):33-35.
[9]伍时华,徐雅飞,黄翠姬.降解纤维素菌株的筛选[J].食品科技,2006,8(3):50-52.
[10]魏景超.真菌分类鉴定手册[M].上海:山海出版社,1974.

