藏灵菇发酵纯牛奶过程中的物性变化
袁祎琳,李云飞,2,*,梅 俊,王邦权,刘志宇
(1.上海交通大学农业与生物学院,上海200240;2.上海交通大学陆伯勋食品安全研究中心,上海200240)
藏灵菇(Tibetan kefir)是一种产自西藏的开菲尔粒,乳白色、胶质状的块状物,外形酷似小块花椰菜[1-2],包含由多种微生物组成的微生态群落,对牛奶有发酵作用。开菲尔粒是一种天然形成的混菌发酵系统,能够对牛乳等进行乳酸发酵及酒精发酵[3]。其发酵牛乳的风味与普通酸牛乳有较大差别,除了具有发酵牛乳特有的酸味、香味,还有轻微醇香味及起泡性[4]。藏灵菇制作酸奶饮品在西藏、青海等地区有着悠久的历史,其传入内地以来引起了更多人的关注。目前,对藏灵菇的研究刚刚起步,在菌相、风味、微观、物性等方面缺乏相关文献。本实验是将民间收集的藏灵菇作为发酵剂进行牛奶发酵实验,并跟踪整个发酵过程,研究了牛奶在发酵过程中的物性变化,为研究藏灵菇发酵牛奶奠定了基础。
1 材料与方法
1.1 材料与仪器
藏灵菇 西藏当雄寺庙;纯牛奶 光明乳业无抗生素巴氏奶。
DHG-9240A电热鼓风干燥箱 上海-恒科学仪器有限公司;METJLER TOLEDO实验pH计(FE20) 仪器(上海)有限公司;Thermo Scientific Heraeus Labofuge 400通用台式离心机 上海创萌生物科技有限公司;KDN-04A凯氏定氮仪 浙江托普仪器有限公司;SXT-06索氏抽提器 上海洪纪仪器设备有限公司;R/S plus流变仪 美国Brookfield公司;E-1045离子溅射仪(Ion Sputter) 日立Hitachi;Sirion 200场发射扫描电子显微镜(FE-SEM) 荷兰FEI.
1.2 实验方法
1.2.1 发酵前处理 日常培养藏灵菇将其放于巴氏奶中,置于28℃环境培养,每隔24h更换一次牛奶;在实验前一天将藏灵菇以10g/100mL接种于纯牛乳中,在28℃恒温箱中培养24h,使之标准化,沥出后用蒸馏水清洗藏灵菇表面,将白色附着物洗净,置于蒸馏水中备用。所有备用藏灵菇在1h内使用完。
1.2.2 发酵时间与温度 按照15g/100mL进行接种,然后将其放在恒温生化培养箱内进行培养,发酵温度为28℃和34℃,发酵时间为3、6、9、12、15、18、21、24、27h。
1.2.3 pH测定 每隔3h对发酵过程中的发酵液进行pH测定。
1.2.4 保水率(WHC) 借鉴Harte[5]对于开菲尔的保水率测定方法,30mL发酵液置于50mL离心管中,以4500g,4℃离心18min,以下公式用于计算发酵液的保水率(WHC):
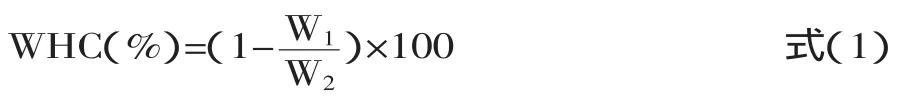
式中:W1为离心之后乳清的质量(g);W2为所有发酵液的质量(g)。每个梯度两个平行。
1.2.5 脱水收缩 参考文献[6]的方法:在50mL的离心管中加入约30g左右的藏灵菇发酵液,在4℃环境中静置2h,然后在3400g(5804R)10℃条件下离心15min,以下公式用于计算脱水收缩率:
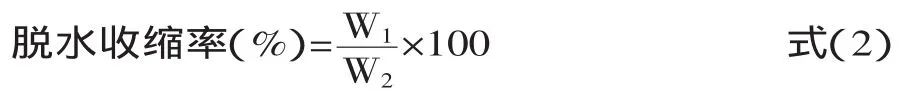
式中:W1为离心之后乳清的质量(g);W2为所有发酵液的质量(g)。每个梯度三个平行。
1.2.6 黏度分析 采用R/S plus流变仪测定藏灵菇发酵液的黏度,参数设定为25℃,剪切速率变化为5min内0~512s-1,转子采用CC 25,每个样品平行做3次。
1.2.7 化学成分分析 乳糖测定采用GB方法[7],平行操作三次,得出平均消耗样液的体积。以下公式计算样品中乳糖的含量:
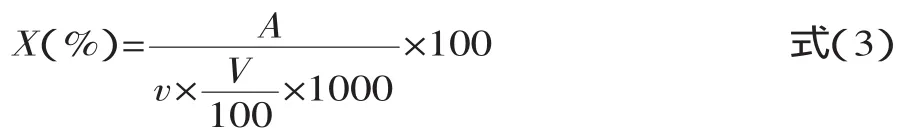
式中:X为样品中乳糖的含量(mg/mL);A为碱性酒石酸铜溶液(甲、乙液各半)相当于乳糖的质量(mg);v为样品的体积(mL);V为测定时消耗样品溶液的平均体积(mL);100为样品溶液总体积(mL)。
化学成分分析蛋白质测定参考文献[8]的方法,换算系数为6.38。
1.2.8 藏灵菇的扫描电镜观察 将藏灵菇切成小片,大小约5.5mm,将小片置于戊二醛溶液中,25℃放置4h,进行固定。然后用磷酸缓冲液洗涤2次,每次15min,再分别用15%、30%、50%、70%的酒精各脱水15min,再用99.5%酒精脱水1h,将脱水岩心放入临界点干燥机用液态二氧化碳进行临界点干燥,然后用离子膜覆膜机镀金,最后用扫描电镜观察。
1.2.9 藏灵菇发酵乳和市售普通酸奶(光明莫斯利安)扫描电镜观察 将发酵乳和市售酸奶在干净平整的玻璃板上涂片,涂片厚度约为2mm。在通风的恒温箱内(28℃)下静置48h以上,保证完全干燥。电镜扫描前,撬取一小块样品薄片在离子覆膜机镀金,最后用扫描电镜观察。
1.2.10 数据分析 利用SAS软件进行数据分析,显著性水平定在0.05%。
2 结果与讨论
2.1 pH的变化
原奶的pH为6.62,经过27h的发酵,28℃环境中的纯牛乳pH降低到3.93,34℃环境中的纯牛乳pH降低到3.91。由图1可观察到,两个温度组的pH降低趋势相似,12h之前pH的降低速度较快,12h之后降低比较平缓。此结果与王晴等[9]对kefir的研究结果相似,这是由于发酵初期乳酸菌(Lacteus)为优势菌种,大量利用乳糖并产酸,导致发酵乳的pH大幅降低。后期由于发酵乳的酸度过高抑制了乳酸菌的生长,因此pH降低变缓。
根据SAS软件的T TEST检验,设计程序对于两个温度进行测试,结果显示3~15h温度(28、34℃)对于pH降低有显著性影响(p<0.05),18~27h这个时间段的温度(28、34℃)对于pH也存在显著性影响,但是显著性不如前面的15h。整体上整个发酵阶段温度(28、34℃)组对于pH降低具有显著性影响(p<0.05),藏灵菇34℃发酵纯牛奶产酸比28℃更快;对于发酵时间进行测试,结果显示两个温度组的发酵时间对于pH降低具有显著性影响(p<0.01)。
并且,由于发酵温度不同,菌相的变化和产物的组成以及产品的微观结构也会有很多差别,因此每个发酵阶段产物的感官质量也存在差别。
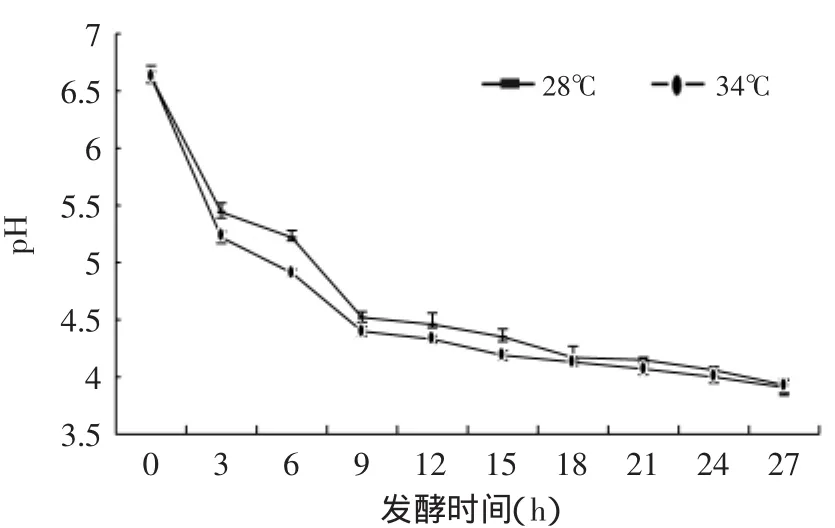
图1 藏灵菇发酵纯牛奶pHFig.1 The pH of Tibetan kefir fermentation samples
2.2 保水率和脱水收缩的变化
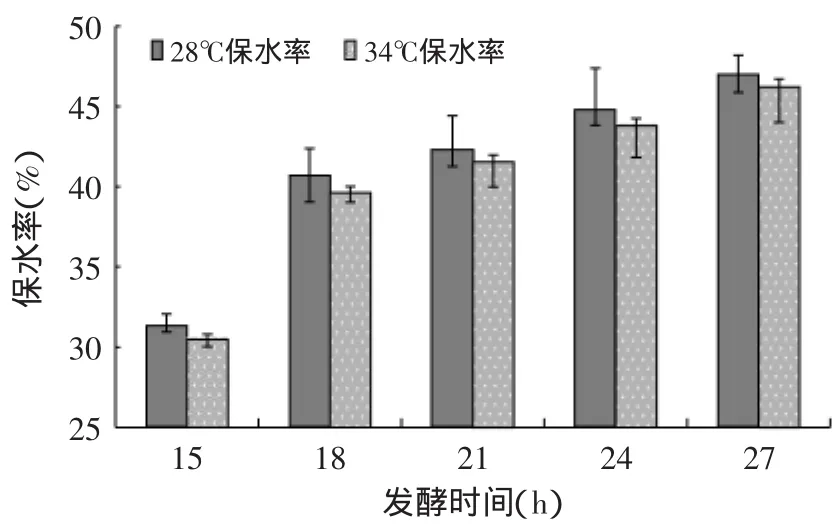
图2 藏灵菇发酵纯牛乳的保水率Fig.2 Water-holding capacity(WHC)of Tibetan kefir fermentation samples
2.2.1 保水率(WHC) 15~27h发酵纯牛乳的WHC随发酵时间而升高(见图2),这是由于随着发酵时间的增长,藏灵菇发酵产物胞外多糖增多的缘故[10],因为胞外多糖(EPS)结合水的能力很强[11]。从图2中看28℃比34℃有更高的保水率,这个结果与文献[12]的研究结果一致。28℃与34℃组的15h保水率分别为31.29%和30.48%,到了27h,两组的保水率分别提升到了46.94%和46.22%。经过SAS的ANOVA检验,时间对于藏灵菇发酵纯牛乳的保水率均有及其显著的影响(p<0.01)。3~12h发酵阶段温度组时间对于保水率没有影响(p>0.40),这可能是发酵不稳定的缘故。整个发酵阶段温度对于保水率并没有显著性影响(p>0.05)。
2.2.2 脱水收缩率 由图3可知,发酵15~27h随着发酵时间的增长,脱水收缩率降低。根据有关文献[13]报道,在发酵过程中pH降低,导致酪蛋白颗粒抗脱水收缩能力增强,这应该就是脱水收缩率随着时间降低的原因。图3中显示,28℃发酵的脱水收缩率要比34℃组的略低。采用SAS的ANOVA检测分析可知,发酵时间对于脱水收缩率的影响极其显著(p<0.01),而发酵温度对于脱水收缩的影响不显著(p>0.05)。
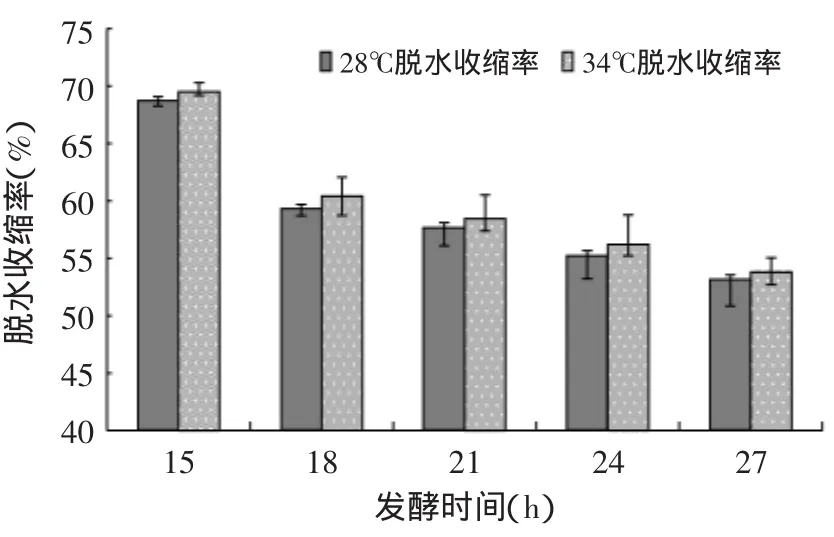
图3 藏灵菇发酵纯牛乳的脱水收缩率Fig.3 The syneresis of Tibetan kefir fermentation samples
2.3 粘度的变化
从表1中可知,发酵乳的黏度随发酵时间的延长而提高。经过ANOVA检验,发酵时间对于黏度的影响极其显著(p<0.01),发酵时间和发酵温度的交互效应对于黏度的影响也极其显著(p<0.01)。可以看到第15h时两个温度组的黏度均出现峰值,18h黏度又有所降低,18~27h的黏度再次稳步上升。
藏灵菇发酵乳对于黏度的影响主要由胞外多糖和脂肪决定,整个发酵过程中胞外多糖主要由乳酸菌中的乳杆菌属(Lactobacillus)和明串珠菌属(Leuconostoc)的肠膜明串珠菌葡聚糖亚种(Leuconostocn.mesnteroidessubsp.dextranicum)产生[14],肠膜明串珠菌葡聚糖亚种的最佳发酵温度是20~30℃,提高温度并有酵母(fermento)存在时,肠膜明串珠菌葡聚糖亚种活力增强。王晴等[9]研究发现,16h之后发酵乳中的酵母菌数明显比12h之前的减少了很多,这点可能影响了明串珠菌葡聚糖亚种的生长,导致了胞外多糖分泌暂时受阻。又由于根据王晴等[9]的生长曲线,16h之后乳杆菌(Lactobacillus)的生长速率高于12h之前,乳杆菌的最适生长温度为37~42℃,具有很强的分泌胞外多糖的能力。故此研究18h之后发酵乳的粘度再次升高,且发酵时间越长,34℃组比28℃组的黏度高的幅度越大。
经过流变仪的检测,市售酸奶的黏度随时间的变化趋势全部呈对称的开口向上的抛物线状(见图4),藏灵菇发酵液黏度曲线基本都呈开口向上的不对称抛物线状,且抛物线的最低点接近600s(转子的剪切速率接近0s-1)处。这与藏灵菇发酵的成分和微观结构有关,究其具体原因在下文电镜扫描之后会加以解释。酸牛乳都是触变性流体,但是由于藏灵菇奶是由一个微生物群落发酵而成的,其成分要比市售酸奶复杂得多,并且从微观结构图7(C、D、E)上也可以看出结构致密平整,就造成了藏灵菇奶黏度恢复能力与市售酸奶有很大不同,从时间-黏度曲线上可以看出,黏度恢复能力比较滞后。
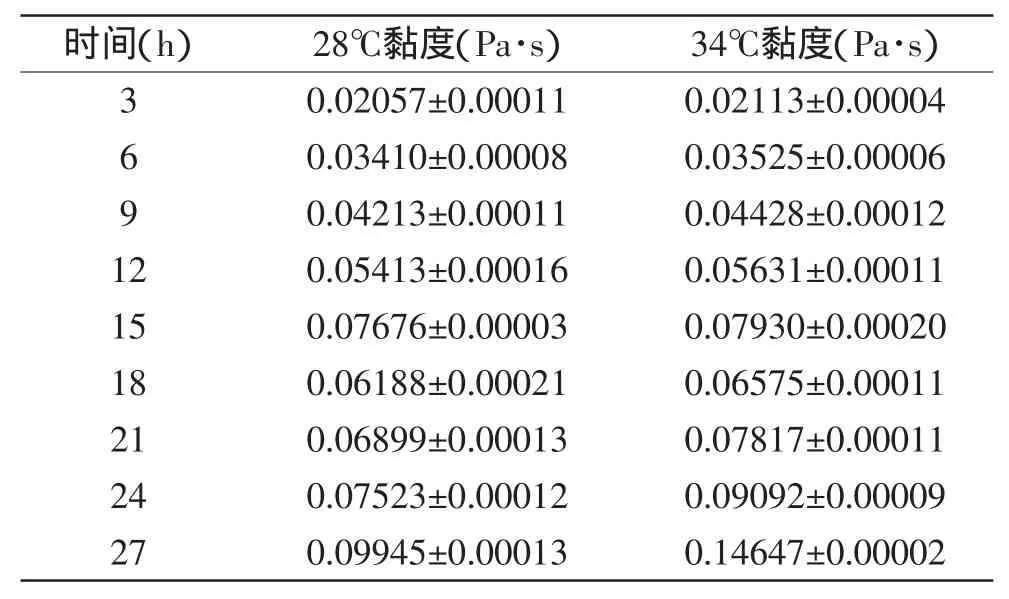
表1 藏灵菇发酵纯牛乳的黏度对比结果Table 1 The viscosity of Tibetan kefir fermentation samples
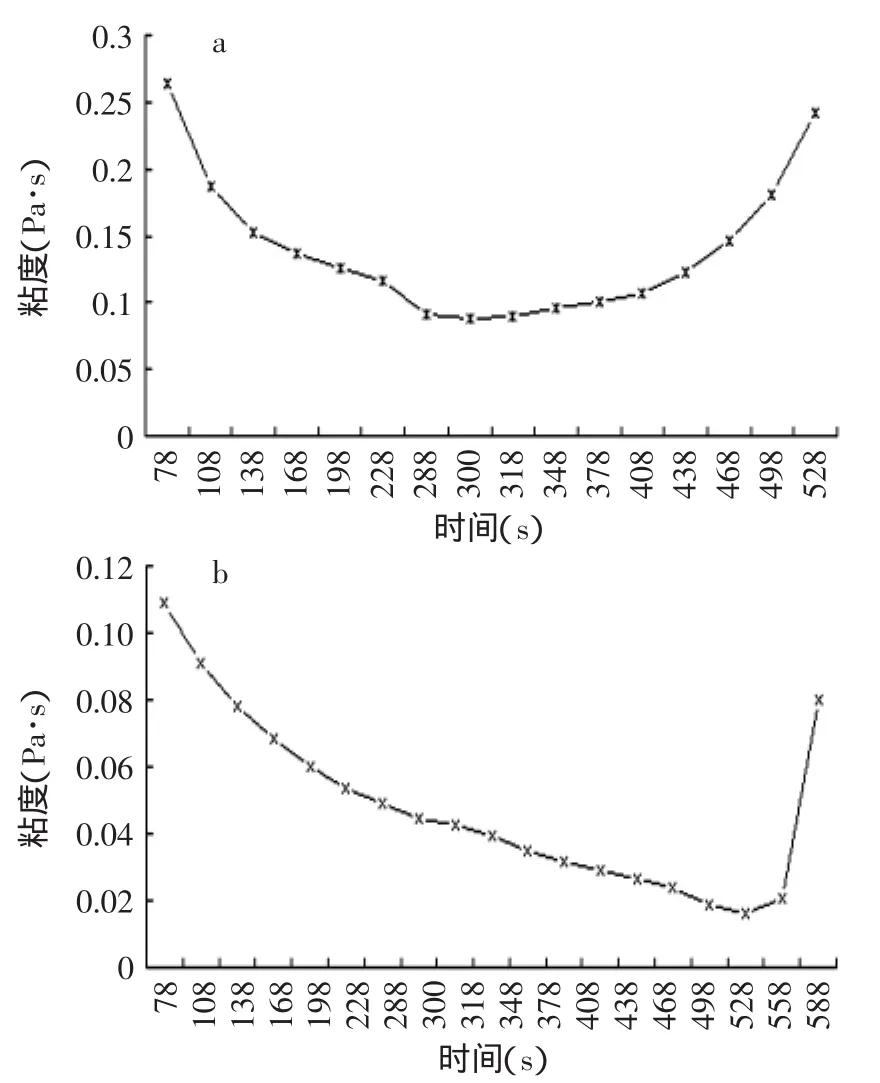
图4 市售普通酸奶和藏灵菇发酵液粘度(34℃,27h)Fig.4 The viscosity of Tibetan kefir fermentation samples andordinary yogurt(34℃,27h)
2.4 乳糖及蛋白质的变化
2.4.1 乳糖 经过检测,纯牛乳的乳糖含量为5.06%,经过27h的发酵,28℃组的乳糖降低到3.42%,34℃组的乳糖降低至3.31%。从图5中可以看出,12h之前乳糖急剧减少,15h之后乳糖虽仍在减少,但是降低的趋势比较平缓。可能因为乳糖发酵型酵母菌适合酸性生长环境,而乳糖非发酵型酵母只能利用葡萄糖和半乳糖[15],导致开菲尔乳中乳糖含量在发酵后期下降幅度降低。经过SAS的ANOVA检验可知,整个发酵阶段的时间对于乳糖含量的影响极其显著(p<0.01),发酵温度对于乳糖含量的影响也极其显著(p<0.01),但是12h之前发酵时间与发酵温度的交互效应对于乳糖的含量有影响,但是不显著(p>0.05),15h之后发酵时间与发酵温度的交互效应对于乳糖含量的无影响。
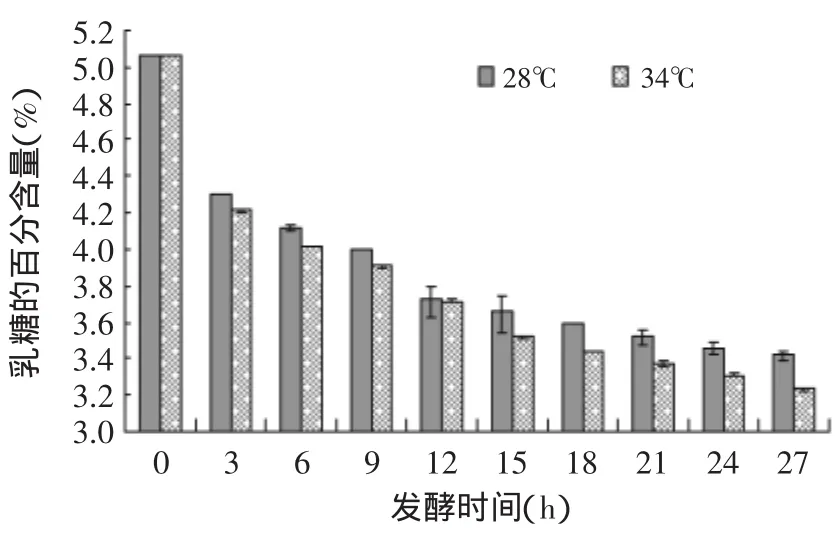
图5 雪莲菌发酵纯牛乳乳糖含量趋势图Fig.5 lactose of the Tibetan kefir fermentation samples
2.4.2 蛋白质 纯牛乳的蛋白质含量为2.92%,进过27h的发酵,34℃组的蛋白质含量升至3.87%,然而28℃组的蛋白质含量升至了3.93%。有学者通过胃蛋白酶体外消化实验表明,开菲尔发酵酸奶中,非蛋白质氮及游离氨基酸比普通牛奶多[16];研究发现,在开菲尔发酵成熟过程中,蛋白质发生变性和分解,游离氨基酸如脯氨酸、亮氨酸、赖氨酸、鸟氨酸、组氨酸有限制增加,这可能为乳酸菌、醋酸菌中的纹膜醋酸杆菌(Acetobacter)或酵母菌作用的结果[17]。从图6中可以看出,15h之前蛋白质含量上升得比较快,18h之后,蛋白质含量上升的趋势逐渐平缓;两个温度组的蛋白质含量上升的趋势比较相似;并且28℃温度下藏灵菇发酵纯牛乳的蛋白质含量高于34℃温度组。
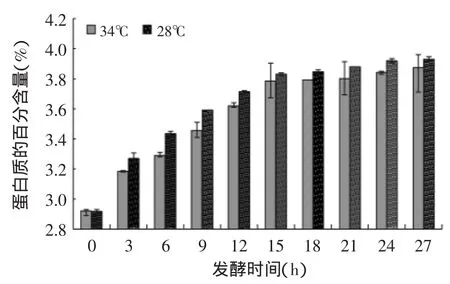
图6 藏灵菇发酵纯牛乳蛋白质含量趋势图Fig.6 Protein content of the Tibetan kefir fermentation samples
经过SAS的ANOVA分析,发酵时间对于蛋白质含量变化的影响极其显著(p<0.01),发酵温度(28℃,34℃)对于蛋白质含量变化的影响不显著(p>0.05),发酵温度和发酵时间的交互作用对于蛋白质含量的影响不显著(p>0.05)。0~3h,6~9h,15~18h发酵液的蛋白质含量有比较大幅度的上升,ANOVA分析显示这三个温度组的蛋白质含量具有显著性差别。
2.5 电镜扫描(SEM)结果及分析
从图7(A)和图7B中可以看到,雪莲菌的外观似花椰菜花蕾形状,形成的过程为片状结构→涡旋状→花椰菜[18]。对于此种藏灵菇的电镜扫描外观,菌种的表层栖息的菌种为乳糖发酵型酵母(Fermento.lactose fermentescentis)、嗜温型乳球菌(Lactococcus.mesophilic)、嗜温型乳杆菌(Lactobacillu.mesophilic)、嗜热型乳杆菌(Lactobacillu.thermophilus),稍进入里层酵母和乳杆菌的比例逐渐增大直至酵母占绝对优势,内层主要为非乳糖发酵型酵母(Fermento.nonlactose fermentescentis)[19]。
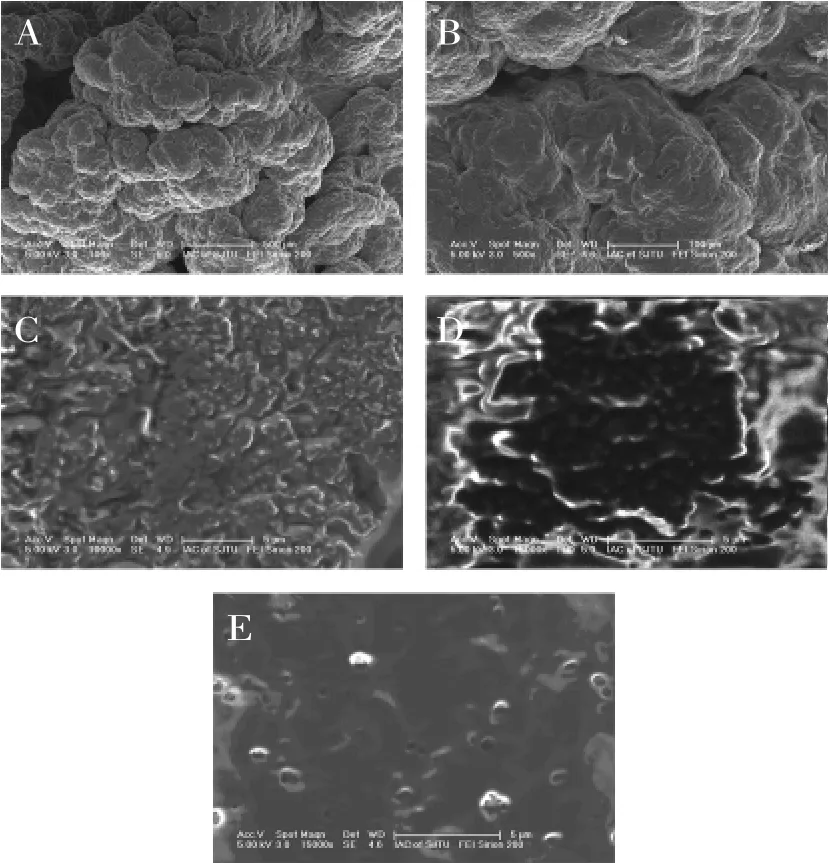
图7 藏灵菇、光明莫斯利安酸奶、藏灵菇发酵纯牛乳(28℃,27h)组的电扫描照片Fig.7 SEM of Tibetan kefir,Bright Mosley Ann yogurt,Tibetan kefir fermentation samples(28℃,27h)
藏灵菇发酵准牛乳27h之后发酵液的结构非常致密平整(见图7E),而市售酸奶就有比较多的网络结构(见图7C、D),空间结构也比较复杂。这也许能解释藏灵菇发酵液粘度曲线的特殊性,由于这样的平整主要是由多糖造成的,多糖的交联性会促进蛋白颗粒之间的粘合,但是这样的结构一旦在高速剪切力的作用之下被破坏之后,恢复的速度就比较慢,这也是为什么藏灵菇发酵液的粘度曲线在剪切速率降低的情况下还是久久不能恢复的原因。在不添加任何增稠剂的情况下发酵而得的发酵液就具有如此独特的空间结构,添加了一定量的甜味剂以后,成为一种比市售酸奶更加健康、绵滑、开胃的保健酸奶。藏灵菇发酵时间越久,发酵液的质构就更加致密[20]。发酵温度也会影响到藏灵菇发酵乳的致密程度,温度高(34℃)相较于温度低(28℃)蛋白颗粒结合更加紧密,促进了脱水收缩,但是平整度不如低温发酵[21]。
3 结论
3.1 发酵温度(28、34℃)和发酵时间对降低pH和增加黏度均有显著性或者极显著性影响,发酵至15h黏度达到最大值,分别为0.07676Pa·s和0.07930Pa·s。发酵温度对保水率和脱水收缩率的影响表现为:发酵前期无显著性影响,但是在发酵15h后有极显著影响。
3.2 整个发酵阶段,发酵时间对于乳糖的降低影响极其显著(p<0.01);发酵温度(28、34℃)对于乳糖的影响极其显著(p<0.01),34℃组强于28℃组;发酵时间与发酵温度的交互效应对于乳糖的含量无显著性影响;发酵时间对提高蛋白质含量的影响极其显著(p<0.01),发酵温度对于蛋白质含量变化无显著性影响(p>0.05)。
3.3 酸牛乳是触变性流体,但是由于藏灵菇奶是由一个微生物群落发酵而成的,其成分要比市售酸奶复杂得多,微观结构较市售酸奶致密平整,黏度恢复能力滞后。
[1]Marshall V,Cole WM,Brooker BE.Observations on the structure of kefir grains and the distribution of the microflora[J].Appl Bacteriol,1984,57(3):491-497.
[2]Duitschaever CL,Kemp,NSmith,et al.studies of the microflora of kefir grains and of kefir made by different methods[J].Milchwissenschaft,1988,48(9):479-481.
[3]Zajesk K,GorsekK A.Modelling of batch kefir fermentation kinetics for ethanol production by mixed natural microflora[J].Food and Bioproducts Processing,2010,88(1):55-60.
[4]Zajek K,Gorek A.Effect of natural starter culture activity on ethanol content in fermented dairy products[J].International Journal of Dairy Technology,2010,63(1):113-118.
[5]Harte F,Luedecke L,Swanson B,et al.Low-fat set yogurt made from milk subjected to combinations of high hydrostatic pressure and thermal processing[J].Journal of Dairy Science,2003,86(4):1074-1082.
[6]B L Pertersen,R I Dave,D J McMahon,et al.Influence of Capsular and Ropy Exopolysaccharide-Producing Streptococcus thermophilus on Mozzarella Cheese and Cheese Whey[J].Journal of Dairy Science,2000,83(9):1952-1956.
[7]中华人民共和国卫生部中国国家标准化管理委员会.GB 5413.5-2010婴幼儿食品和乳品中乳糖、蔗糖的测定[S].北京:中国标准出版社,2010.
[8]Rouch D A,Roginski H,Britz M L,et al.Determination of a nitrogen conversion factor for protein content in Cheddar cheese[J].Int Dairy J,2008,18(2):216-220.
[9]王晴,王宇,韩建荣,等.开菲尔发酵乳发酵参数的变化趋势,食品与发酵工业[J].2009,35(11):189-191.
[10]Bensmira M,Nsabimana C,Jiang B.Effects of fermentation conditions and homogenization pressureon the rheological properties of Kefir[J].LWT-Food Science and Technology,2010,43(8):1180-1184.
[11]De Vuyst L,Degeest B.Heteropolysaccharides from lactic acid bacteria[J].FEMS Microbiology Reviews,1999,23(2):153-177.
[12]D Ercili Cura,M Lille,R Partanen,et al.Effect of Trichoderma reesei tyrosinase on rheology and microstructure of acidified milk gels[J].International Dairy Journal,2010,20(12):830-837.
[13] Öztürk BA,Öner MD.Production and evaluation of yogurt with concentrated grape juice[J].Journal of Food Science,1999,64(9):530-532.
[14]Rosi J.The Kefir microorganism:the lactic acid bacteria[J].SienzaTecnica Lattiero-Casearia,1978,29(8):221-227.
[15]王蕊.酸牛乳酒开菲尔的研究[J].食品研究与开发,2008,29(6):143-146.
[16]Marcela Zubillaga,Ricardo Weillb,Eric Postaire,et al.Effect of probiotics and functional foods and their use in different disease[J].Nutrition Research,2001,21(3):569-579.
[17]袁永平,黄丽金,陈伟.发酵乳饮料—开菲尔的研究进展[J].安徽农业科学,2009,37(23):11154-11156.
[18]Marshall V M.Editional[J].International Dairy Journal,2001,11(9):659-661.
[19]Zeynep GS.Turkish kefir and kefir Grains:Microbial Enumeration and Electron Miroscopic observation[J].Dairy Technology,2005,58(1):25-29.
[20]T Ozcan,D Horne,JA Lucey.Effect of increasing the colloidalcalcium phosphate ofmilk on the texture and microstructure of yogurt[J].Journal of Dairy Science,2011,94(11):5278-5288.
[21]Meriem Bensmira,Bo Jiang.Effect of some operating variables on the microstructure and physical properties of a novel Kefir formulation[J].Journal of Food Engineering,2012,108(4):579-584.

