响应曲面法优化酪蛋白磷酸肽的制备
曹文辉,王志耕,梅 林,薛秀恒
(安徽农业大学茶与食品科技学院,安徽省乳品工程技术研究中心,安徽合肥230036)
酪蛋白磷酸肽(Casein Phosphopeptides,CPP)是以牛奶酪蛋白为原料,经过蛋白酶水解,再分离纯化之后得到的含有磷酸丝氨酰基的多肽。其活性中心是成串的磷酸丝氨酸和谷氨酸簇,其核心结构可表示为-Ser(P)-Ser(P)-Ser(P)-Glu-Glu-[1]。CPP具有促进钙、铁和锌等微量元素的吸收与利用,还具有抗氧化、促进益生菌增殖等作用[2-7],由于其稳定性好、有多种生物活性因此具有相当大的开发应用潜力[8-9]。国外研究采用多种蛋白酶酶解酪蛋白,成功地制备出不同种类的CPP[10],之后也有研究采用RP-HPLCESL-MS/MS方法成功地分离出12种CPP[11]。我国CPP的相关研究相对滞后,有研究采用反相C18液相制备色谱柱,制得了4种不同组分的CPP[12],但在CPP的常规酶法制备方法上,研究基本以水解度为指标,探讨酪蛋白的单酶、多酶水解条件优化,而以目标产物CPP的得率为指标进行酶解条件优化的研究开展较少。本文选择具有可释放CPP链段更短、产率高、含磷量高[13]等优点的碱性蛋白酶为工具酶,以CPP的得率为指标,采用Plackett-Burman设计和响应面分析法相结合的方法,研究获得较高CPP得率的酪蛋白水解液优化条件,为CPP的有效制备提供技术参数。
1 材料与方法
1.1 材料与仪器
酪蛋白(高纯级:95%) AMRESCO;碱性蛋白酶(Alkaline Protease) RUIBIO公司;其他试剂 均为分析纯。
实验HJ-3型控温磁力搅拌器、HH-S型恒温水浴锅 江苏金坛市金城国胜实验仪器厂;BS210S型电子天平 北京赛多利斯天平有限公司;SJ-3F型精密pH计 上海雷磁仪器厂;TU-1901型双光束紫外可见分光光度计 北京普析通用仪器有限公司;Allegra 64R CentrifugeBECKMAN COULTER。
1.2 实验方法
1.2.1 酶活的测定
1.2.1.1 标准曲线的绘制 精确称取标准酪氨酸100mg,逐步加入1mol/L盐酸6mL使溶解。用0.2mol/L的盐酸溶液溶解,定容至100mL,再配制成不同浓度的酪氨酸溶液。取不同浓度的酪氨酸溶液各1mL,分别加入0.4mol/L碳酸钠溶液5mL,酚试剂1mL。置于40℃恒温水浴中显色20min,用分光光度计在660nm处测吸光值,并同时做空白管(只加水、碳酸钠和酚试剂)对照,以吸光值为纵坐标,以酪氨酸的微克数为横坐标,绘制标准曲线。
1.2.1.2 酶活力的测定 取3支试管,编号,各吸取2%的酪蛋白溶液1mL,在40℃水浴中预热2min后加入同样预热的酶液(稀释2000倍)1mL,立即计时。反应10min后,立即加入0.4mol/L三氯乙酸溶液2mL,保温20min后,用滤纸过滤,取上清液。另取3支试管,编号,各加入上清液1mL,然后各加入0.4mol/L的碳酸钠溶液5mL,混匀后再各加入酚试剂1mL。立即混匀,在40℃显色20min。在660nm处测定吸光值。对照组测定方法同上,但在加酪蛋白之前先加0.4mol/L三氯乙酸2mL,使酶失活,再加入酪蛋白。
规定在40℃和pH10.0的条件下,水解酪蛋白每分钟产生酪氨酸1μg为一个酶活力单位。
酶活力单位=(A样-A对)×K/10×4×N 式(1)
式中,A样为样品液的吸光值;A对为对照液的吸光值;K为标准曲线上吸光值为1时的酪氨酸微克数;10为酶促反应时间(min);4为所测溶液的体积数(mL);N为酶液的稀释倍数。
1.2.2 酪蛋白的水解 取一定量的酪蛋白,溶于60~70℃的一定浓度的碱性溶液中,配成一定底物浓度的酪蛋白,放入水浴锅中,用0.5mol/L的NaOH调pH至实验设计值,加入适量碱性蛋白酶,保温至水解结束,沸水浴灭酶10min,冷却至室温,用2mol/L的HCl调pH至4.6,离心(8000r/min,10min)去除沉淀,取上清液。
1.2.3 CPP的制备 上述上清液→加10%的CaCl2使其终浓度为1.0%和2倍体积的无水乙醇→离心(8000r/min,10min)→取沉淀→烘干(80℃,4h)→称重。
CPP得率(mg/mL)=(m2-m1)/v 式(2)
式中,m2为烘干之后称量瓶和CPP的重量(mg);m1为烘干之前称量瓶的重量(mg);v为所取1.2.2中上清液的体积数(mL)。
1.3 实验设计
1.3.1 Plackett-Burman法筛选影响CPP得率的酶解主要因素 采用Plackett-Burman法,设计2水平实验,实验因素和水平如表1所示。
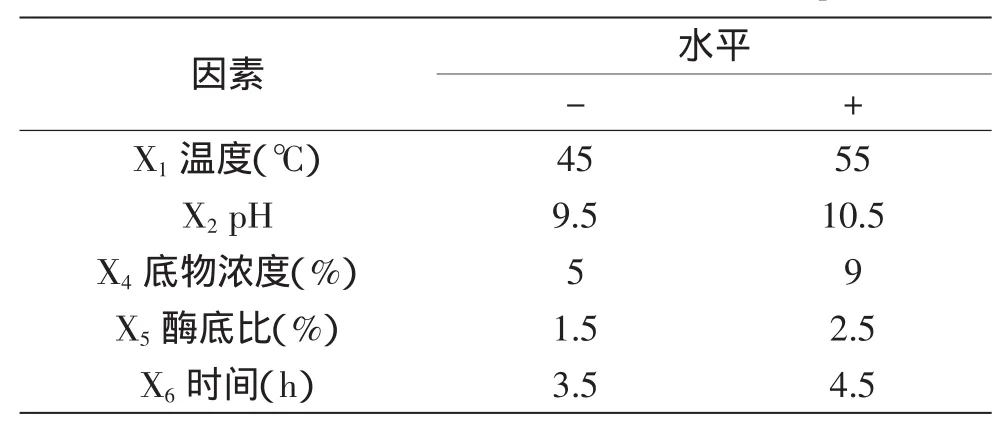
表1 Plackett-Burman实验因素及水平Table 1 Factors and levels of Plackett-Burman experiments
1.3.2 最陡爬坡实验 根据1.3.1的结果,影响CPP得率的酶解因素中温度、pH、底物浓度、时间均为正效应,应增大,酶底比为负效应,应减小。其中温度、pH、底物浓度三个因素影响较大。为此,确定酶解时间(4.5h)、酶底比(1.5%)为固定因子。因底物浓度的增大会使溶液的粘稠度相应增大,过大的粘稠度会给实际操作造成难度,亦不利于工业化的生产。为此,根据预实验结果,将底物浓度固定为11%,对温度、pH两个因素实施最陡爬坡实验。
最陡爬坡实验设计为:温度起点50℃,变化步长为5℃;pH起点为10.5,变化步长为0.5。
1.3.3 响应面实验优化水解条件 根据CCD响应曲面设计的中心组合实验设计原理,并结合单因素实验结果,采用3因素5水平的中心组合实验设计方法对水解条件进行优化设计。
根据最陡爬坡实验结果,以第二组为中心点施行中心组合实验。因为有3个自变量,为使拟合响应方程具有旋转性和通用性,选择中心点实验数为6,星号臂长1.682。各自变量水平见表2。
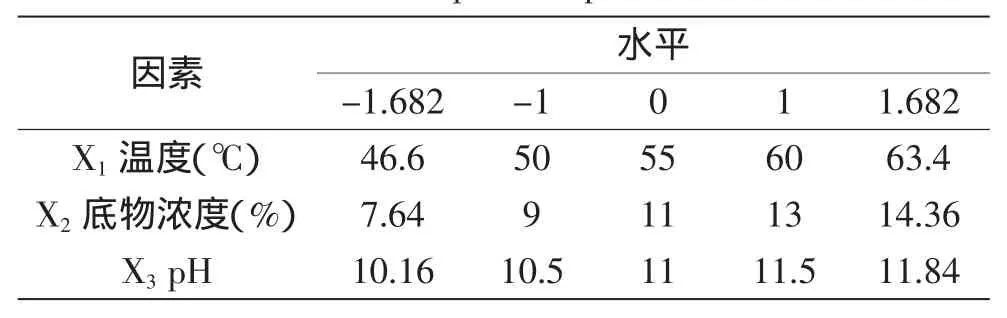
表2 中心组合实验的因素及水平设计Table 2 Factors and levels design of central composite experiments
2 结果与分析
2.1 酪氨酸标准曲线
参照SB/T 10317-1999的方法测定蛋白酶的酶活力,根据实验测定的结果,绘制吸光度值与酪氨酸浓度之间的标准关系曲线,如图1所示。
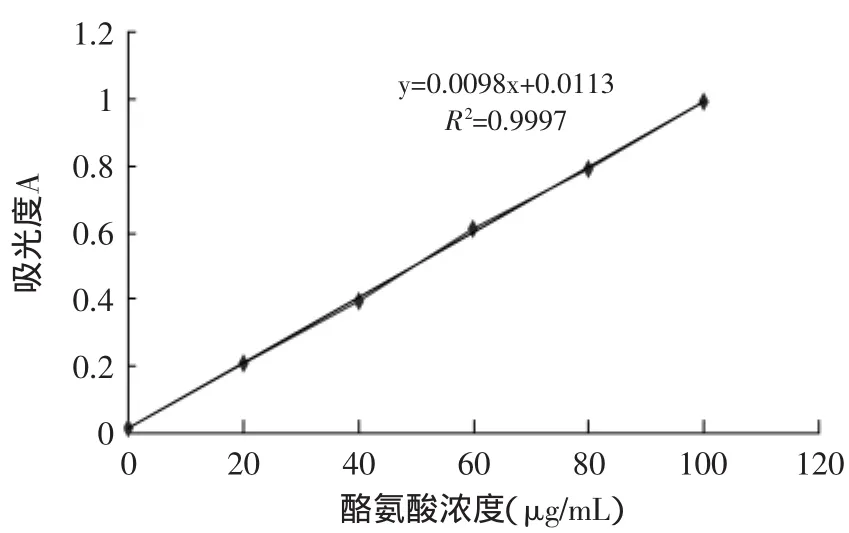
图1 酪氨酸标准曲线Fig.1 Standard curve of Tyrosine
2.2 碱性蛋白酶的活力
为准确确定酶的添加量,提高实验精度,对商品酶的活力进行测定。实验所选用的碱性蛋白酶的实测活力为35348U/g。
2.3 影响CPP得率的酶解主要因素
Plackett-Burman法筛选酶解酪蛋白获得CPP的主要因素的实验结果见表3。
由表3可知,影响CPP得率的5个因素中,温度、pH、底物浓度、时间对CPP的得率表现为正效应(Exi>0),应增大,酶底比对CPP的得率表现为负效应(Exi<0),应减小。影响CPP得率的最主要的三个因素为:底物浓度、温度、pH确定酶底比为1.5%,时间4.5h。故确定可选取这三个因素进行下一步的优化。
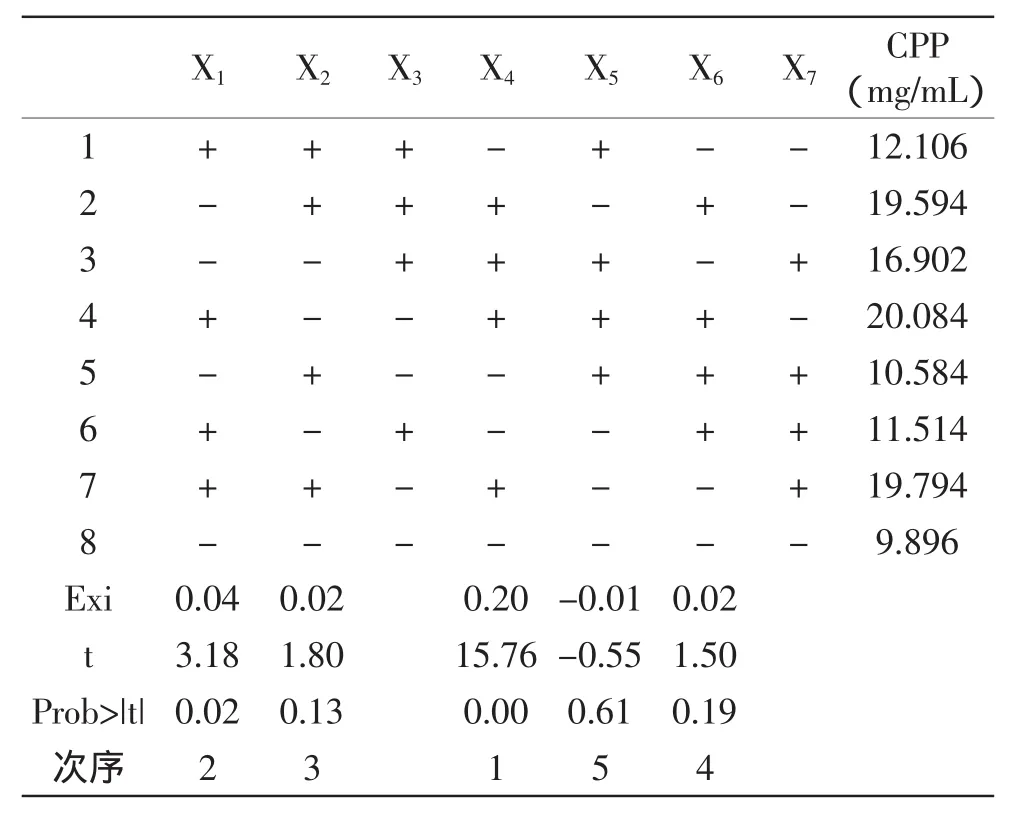
表3 Plackett-Burman实验设计与结果Table 3 The Plackett-Burman exprimental design and results
2.4 最陡爬坡实验
最陡爬坡实验结果见表4。由表4可知,第二组的CPP得率最高,故选择第二组作为实验中心点,进行下一步的实验。

表4 最陡爬坡实验结果Table 4 Experimental results of steepest ascent path
2.5 响应面实验优化水解条件
CCD响应曲面设计的中心组合实验的结果见表5。
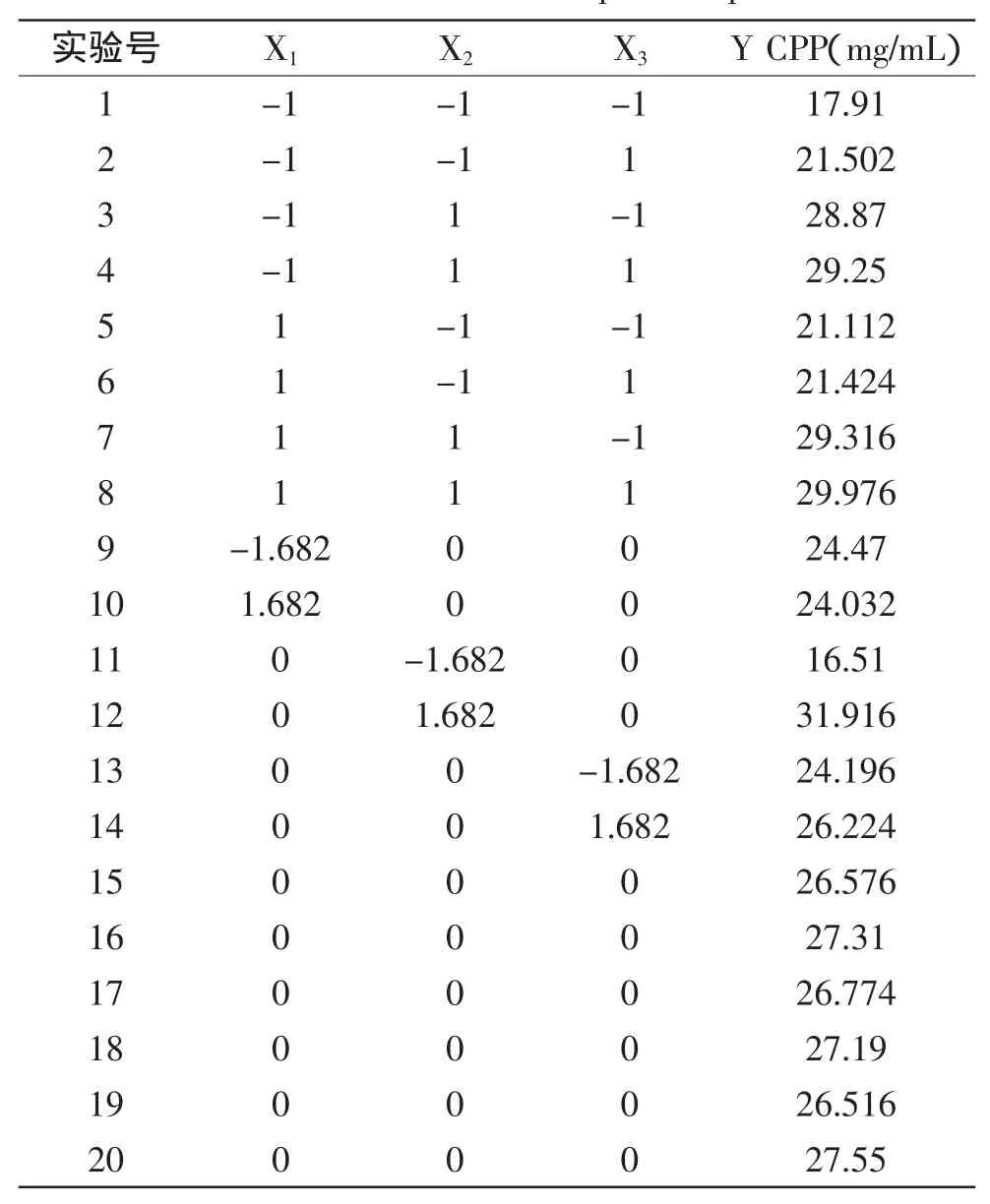
表5 中心组合实验结果Table 5 Results of central composite experiments
根据表5的实验结果,用Design-Expert 8.06软件进行多元回归拟合,得到二次回归方程:
Y=26.97+0.26X1+4.49X2+0.61X3-0.24X1X2-0.37X1X3-0.36X2X3-0.86X12-0.87X22-0.52X32。
回归方程的模型显著性分析、失拟显著性分析以及回归系数显著性分析见表6。
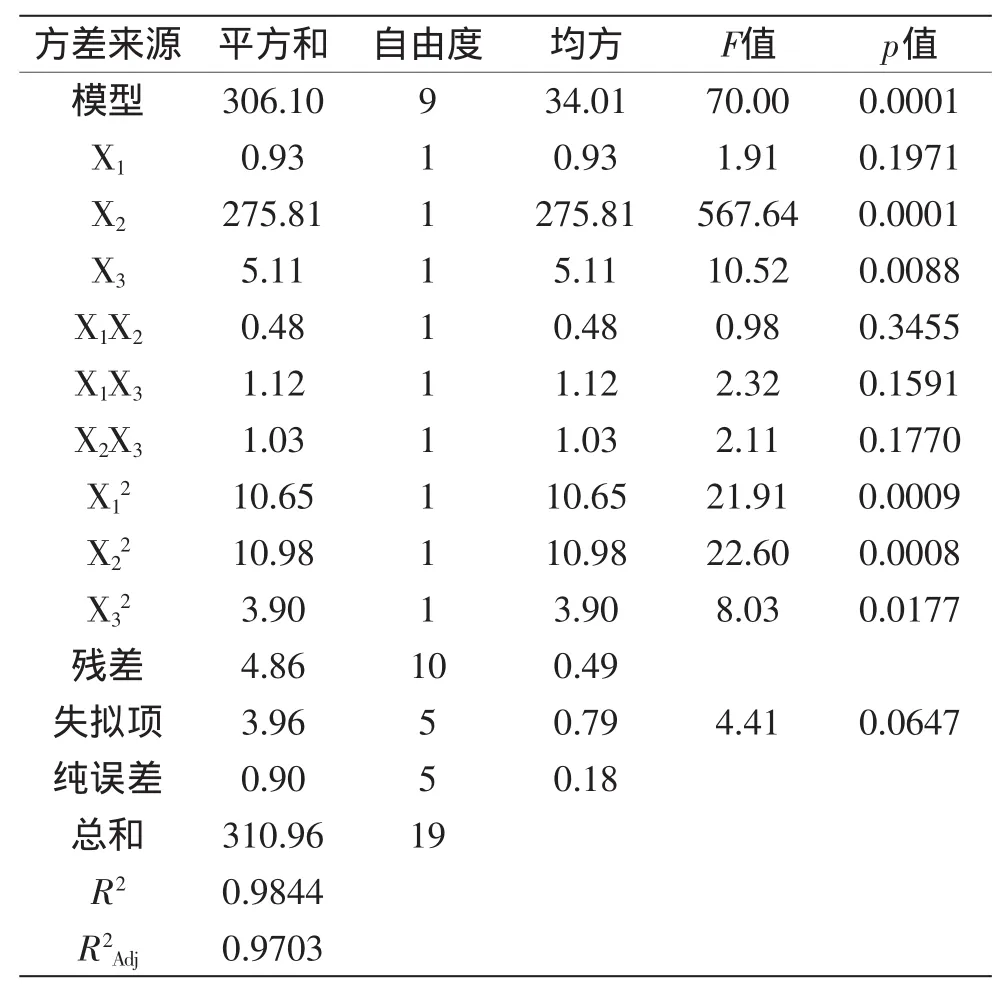
表6 拟合二次多项式模型的方差分析Table 6 Variance analysis of fitted quadratic polynomial model
从表6的结果分析中可以看出,模型显著,失拟项不显著,决定系数(R2)为0.9844,校正系数(R2Adj)为0.9703,说明该回归模型与实际值拟合程度高。回归模型中一次项中的X2、X3和二次项表现显著,一次项中的X1和交互项表现不显著。利用软件得到的响应面图见图2~图4。
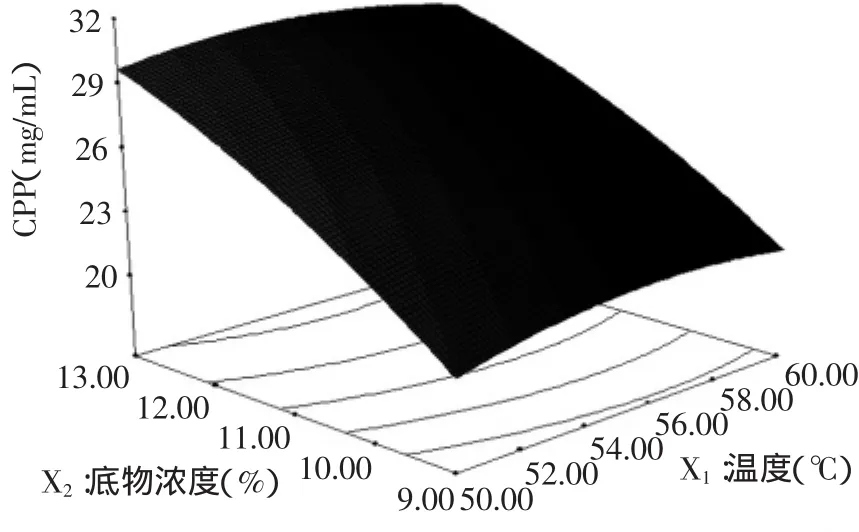
图2 底物浓度和温度对CPP得率的响应曲面图Fig.2 Response surface of substrate concentration andtemperature on the extraction rate of CPP
从图2中可以看出,底物浓度对CPP得率的影响曲线呈不断上升的趋势,温度对CPP得率的影响曲线较平缓。结合图2及表6中的方差分析,底物浓度对CPP得率的影响显著(p<0.01);在实验设定温度范围内,温度对CPP得率的影响不显著(p>0.05);底物浓度和温度的交互作用对CPP得率的影响不显著(p>0.05)。
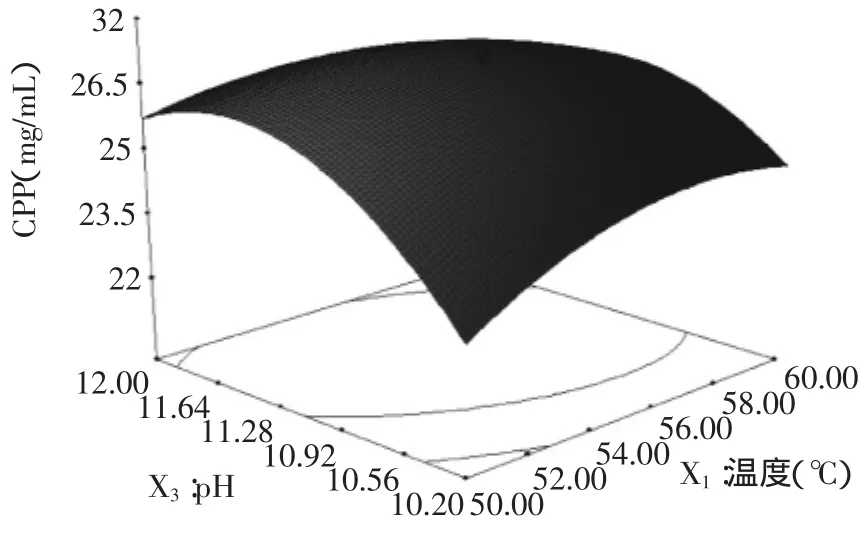
图3 pH和温度对CPP得率的响应曲面图Fig.3 Response surface of pH and temperature on the extraction rate of CPP
从图3中可以看出,pH对CPP得率的影响曲线呈现先快速上升后略有下降的趋势,温度对CPP得率的影响曲线呈现先上升后略有下降的趋势。结合图3及表6中的方差分析,pH对CPP得率的影响显著(p<0.01);温度对CPP得率的影响不显著(p>0.05);pH和温度的交互作用对CPP得率的影响亦不显著(p>0.05)。
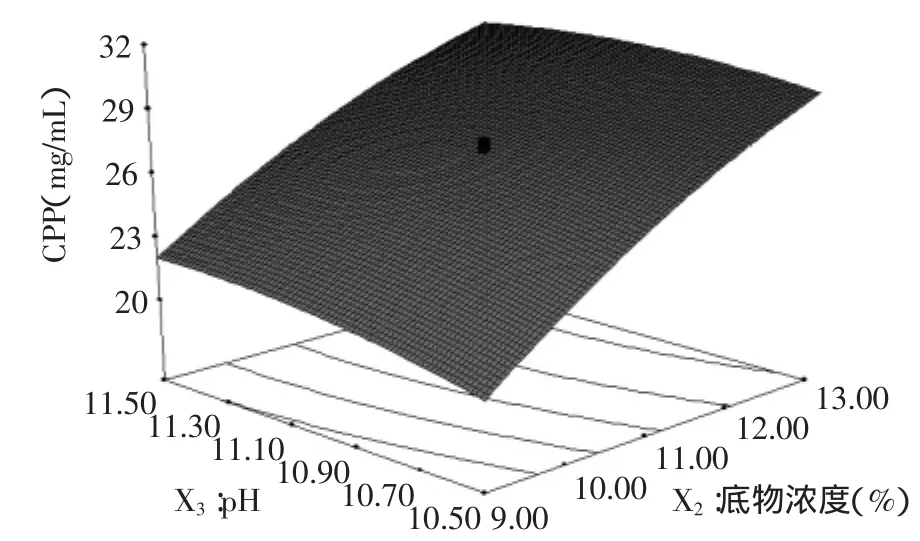
图4 pH和底物浓度对CPP得率的响应曲面图Fig.4 Response surface of pH and substrate concentration on the extraction rate of CPP
从图4中可以看出,底物浓度对CPP得率的影响曲线呈不断上升的趋势,pH对CPP得率的影响曲线较平缓。结合图4及表6中的方差分析,pH对CPP得率的影响显著(p<0.01);底物浓度对CPP得率的影响显著(p<0.01),且底物浓度对CPP得率的影响大于pH对CPP得率的影响;底物浓度和pH的交互作用对CPP得率的影响亦不显著(p>0.05)。
2.6 模型的验证
利用软件求解回归方程,得到最佳CPP得率的工艺条件为:温度54.16℃、底物浓度16.3%、pH10.87,在此条件下得到的CPP得率为32.8mg/mL。考虑到实际操作的情况,将工艺条件调整为:温度55℃、底物浓度16%、pH10.8,在酶底比1.5%、时间4.5h的情况下,验证实验CPP得率为33.2mg/mL,实际值与预测值之间相对误差为1.22%,在可接受范围。
3 讨论
现有一些研究结果表明,酪蛋白酶解过程中,CPP的释放与水解度只呈现一定的正相关关系,当酪蛋白水解度达到16%时,大部分CPP已释放出来,所以在CPP生产过程中可不必使水解度达到最大值[14]。有鉴于此,本研究尝试采用CPP的得率为指标进行条件优化,取得较好结果,最优条件下,可获得33.2mg/mL浓度得率的CPP,表明这一路径是可行的,但与现行水解度为指标的技术方案优劣的系统比较研究尚有待进行。
在本研究实验结果中,图2温度对CPP得率的影响和图4中pH对CPP得率的影响的响应面变化趋势基本一致,这与方差分析结果:温度对CPP得率的影响不显著、pH对CPP得率的影响显著不一致。分析认为,可能是因为底物浓度对CPP得率的影响效应较大,从而掩盖了pH对CPP得率的影响。为此,可以采用固定底物浓度(使CPP有较高的得率且不会产生过大的粘稠度给实际操作造成难度)的方式,优化CPP得率的其他影响因素,这有待于进一步的研究。
4 结论
底物浓度、温度和pH是影响碱性蛋白酶酶解酪蛋白制备CPP得率的主要因素,其最优水解条件为:温度55℃、底物浓度16%、pH10.8、酶底比1.5%,时间4.5h,在此条件下,水解所得到的CPP得率为33.2mg/mL。
[1]Typic.Hydrolysis of CMP in membrane reactor preparation of bioactive peptides[J].Biotechnology letters,1992,14:805-810.
[2]Cross K J,Huq N L,Palamara J E,et al.Physicochemical Characterization of Casein Phosphopeptide-Amorphous Calcium Phosphate Nanocomplexes[J].J Biol Chem,2005,280:15362-15369.
[3]NettoFlaviaM,GaleazziMarpiaM.Production and Characterization of enzymatic hydrolysate from soy protein isolate[J].Lebensm-wiss.u-technol,1988,31:624-631.
[4]吴建中,赵谋明.食品中的生物活性多肽[J].食品与发酵工业,2002,28(11):46-50.
[5]生庆海,耿倩,邱泉若,等.酪蛋白磷酸肽(CPP)对生长期大鼠骨密度的影响[J].中国乳品工业,2006,34(5):22-25.
[6]Hu M,Mcclements D J,Decker E A.Lipid oxidation in corn oil-in water emulsions stabilized by casein,whey protein isolate and soy protein isolate[J].J Agric Food Chem,2003,51(6):1696-1700.
[7]李勇.生物活性肽研究现况和进展[J].食品与发酵工业,2007,33(1):3-9.
[8]王青华,赵征.酪蛋白磷酸肽(CPPs)的开发趋势和应用前景[J].食品研究与开发,2007,28(5):146-149.
[9]丁莉莎,张永忠.超声波法混合蛋白酶水解酪蛋白制备酪蛋白磷酸肽的研究[J].中国乳品工业,2007,35(11):12-14.
[10]Lorenzen P C.Comparing studieson the proteolytic properties of soluble and immobilized proteases for generating phosphopeptide from casein[J].Milchwissenschaft,1998,53(5):268-272.
[11]Esther Miquel,Amparo Alegría,Reyes Barberá,et al.Specia tionanalysisofcalcium, iron, and zinc in casein phosphopepteide fractions from toddler milk-based formula by anion exchange and reversed-phase-high-performance liquid chromatography-mass spectrometry/flame atomic-absorption spectroscopy[J].Anal Bioanal Chem,2005,381:1082-1088.
[12]周杏琴,冯风琴.反相高效液相制备色谱分离酪蛋白磷酸肽[J].分析仪器,2002(4):19-21.
[13]Adamson N J,Reynolds E C.Characterization of casein phosphopeptides prepared using alcalase:determination of enzyme specificity[J].Enzyme and Microbial Technology,1996,19:202-209.
[14]赵利,王璋,许时婴.Alcalase在酪蛋白磷酸肽生产中的应用研究[J].中国奶牛,2002(5):15-18.

