单细胞网络谱分析方法及应用
邢永华,孟爱民
(1.中国医学科学院北京协和医学院放射医学研究所、天津市分子核医学重点实验室,天津 300192;2.青海大学医学院公共卫生系,青海西宁 810001)
近现代生物分析技术手段的革新推动着生物学的发展,亦决定着人们对生命现象及其规律的认识程度,由于过去技术水平的限制,“还原论”成为生物、医学及药物等研究的指导思想,其强调一类疾病,一种靶标,单一靶向药物治疗和药效预测的模式,主观割裂了生命现象间的相互协调、相互适应、相互影响的复杂联系,因此,阐明疾病、生物靶标与药物三者间关系时,“还原论”则显得过于简单和武断[1]。
近些年,高通量分析技术的出现,使蛋白质、核酸等生物大分子间相互协调变化关系的研究成为可能,并推动着生物学研究从细胞水平上升至系统水平。单细胞网络谱分析(single cell network profiling,SCNP)属于高通量分析手段之一,它是研究复杂组织(血液、骨髓等)内,细胞信号通路网络“节点”(蛋白)表达水平及“节点”间网络调节关系的方法,其在分析疾病进程、预测疾病结局、药物筛选及个体化治疗方面显示出独特优势,应用甚为广泛。现就SCNP的原理及其应用做一综述。
1 SCNP
1.1 SCNP的概念 SCNP技术是利用多参数(同时检测≥5个标记物)流式细胞术,在静止或应激状态下同时检测复杂组织(肿瘤、血液、骨髓)、不同类型(亚群)细胞信号通路网络节点蛋白表达水平,通过高通量数据分析方法描述各通路蛋白之间的网络调节关系,勾勒出信号通路网络谱。由于不同条件下(应激、病理、治疗)基因、染色体、表观遗传分子的改变,最终将集中体现于细胞信号通路网络节点蛋白变化[2],因此,细胞水平上的信号通路网络谱能够全面地描述细胞所处状态(增殖、衰老、细胞周期、磷酸化水平、死亡、凋亡),可为疾病机制的研究、诊断、治疗及药物开发提供更深刻、精确的信息。
通常的做法是,利用多参数流式细胞仪分别检测正常、异常细胞信号通路网络节点蛋白表达水平,并将两种细胞的节点蛋白水平进行对比、关联分析,即可确定异常细胞的信号通路网络谱的特征。该网络谱可分析异常信号通路与病程、药物间的关系;并且结合不同信号通路所控制的细胞行为(转移、增殖、凋亡、分化、衰老),还可预测细胞的最终结局;亦有助于发现可能成为新药物靶标的节点蛋白[3]。
1.2 SCNP技术特征 当结合有不同的抗体标记的细胞通过流式细胞仪,后者可分辨出多种细胞类型及检测不同信号通路网络节点蛋白的表达水平和修饰状态[4],在单细胞水平上即可获得信号通路网络谱,因此有人认为SCNP是一项研究细胞信号通路生物学技术。其特征包括:平台低(多参数流式细胞仪)、快速分析(每秒可分析成千上万的细胞)、高通量(细胞类型多、信号通路多、节点蛋白多)、多维度(数据具有多维度特征)。
1.2.1 细胞处理 SCNP主要分析悬浮状态细胞,研究报道集中于癌症[白血病(AML)[5]、膀胱癌[6]]与自身免疫性疾病[系统性红斑狼疮(SLE)[7]、类风湿性关节炎(RA)[8]]等。体外实验常用骨髓细胞、造血干细胞、外周血单个核细胞、全血细胞、脾细胞等。目前对实体性肿瘤(前列腺癌、胃癌、子宫癌)分析的尝试亦有报道[9-11]。
处理流程包括,首先以固定剂固定不同类型的细胞(无需事先分离),其后,以破膜剂提高细胞膜通透性,最后抗体标记细胞分型蛋白(细胞表面标志蛋白)及节点蛋白(胞内蛋白)(Fig 1)。可见,SCNP技术的高通量特征仅对固定过的细胞而言。
1.2.2 细胞标记 各种荧光素可在不同光源激发下,产生不同波长的光(荧光素发射光光谱),可被流式细胞仪的扫描装置检测,在显示屏上完成细胞分群和节点蛋白所处状态的分析。荧光素开发是流式技术继硬件设备(激发光光源、光栅等)之后发展最为迅速的。荧光素的发射光谱目前已覆盖整个可见光光谱。常见的荧光素有藻红蛋白(PE)、别藻蓝蛋白(APC)、异硫氰酸荧光素(FITC)、多甲藻叶绿素蛋白(PerCP)等30多种(Tab 1)。SCNP技术中,限制检测标记物数量的因素包括荧光素、仪器硬件、数据分析软件,目前,同时测量18种不同标记物是传统多参数流式细胞术的上限[13]。值得提出的是,CyTOF质谱流式细胞仪的出现,加快了荧光标记时代的结束,其以过渡金属(镧)制作的金属抗体代替荧光素抗体标记,使得同时检测的标记物数目增至42个(理论上可超过100),并且消除了背景值影响,减少了检测通道间的信号干扰,检测通道数量可达上百个,可实现单细胞网络谱的精细分析[14]。
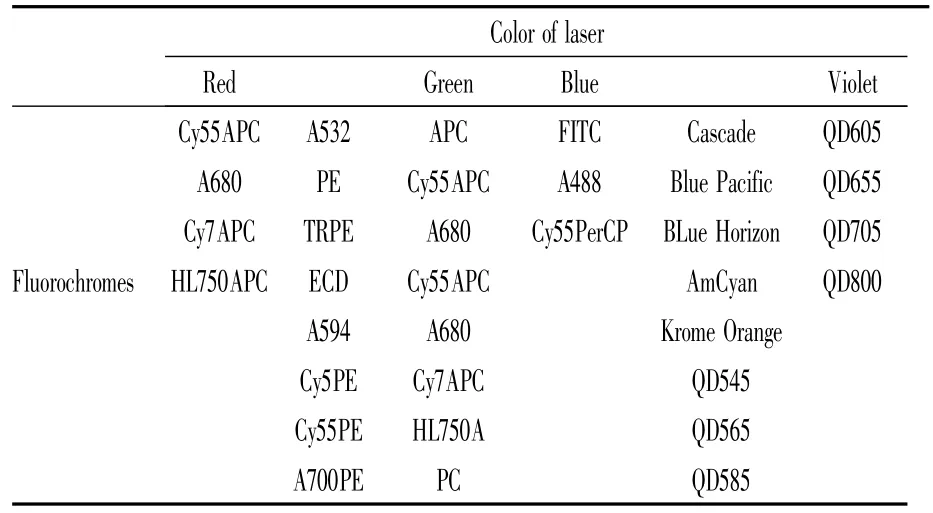
Tab 1 Common laser and fluorochromes used in flow cytometry[15]
在SCNP分析技术中,按照蛋白标记相对于细胞膜的位置,可分为,细胞分型蛋白标记(表面蛋白)与信号通路网络节点蛋白(胞内蛋白)标记。后者是SCNP技术检测分析的主要对象,其可提供疾病机制、结局预测、药物开发、疗效评估等重要信息。因此,抗体与节点蛋白的特异性亲和力,是降低假阳性和假阴性误差的关键。
随着单克隆抗体和激光光源的应用,流式细胞技术的细胞纯化和细胞分型能力有了很大提高。目前已经应用于血液系统疾病、细胞信号网络、淋巴瘤、白血病等研究,以血液及骨髓细胞(亚群)表面标志蛋白研究尤深入,例如“造血干祖细胞”(hematopoietic stem cells,HSCs)表面标志 Lin-(L)c-Kit+ (K)Sca-1+ (S)[16];淋巴细胞表面标志 CD45、CD34、CD11b、CD15、TCR、BCR;干细胞样记忆 CD8+细胞表面标志CD161++IL-18Rα+[17];干细胞样记忆T细胞(TSCMs)表面标志CD3+CD8+CD45RO-CCR7+CD45RA+CD62L+CD27+CD28+IL7Rα+CD95+[18]。表面标志不仅能够帮助区分细胞类型、异常细胞,还可反映出细胞生长、分化阶段。目前,新型的CyTOF质谱流式细胞仪的电感偶合等离子体(inductively coupled plasma,ICP)替代了广泛被使用的激光光源[14],结合金属抗体标记,CyTOF分析精密程度得到极大提高,有利于细化细胞亚群,发现更多数量极少而生物学作用极为重要的细胞群。
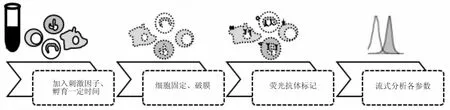
Fig 1 Workflow SCNP by flow cytometry[12]① Incubate cells accompanying stimulators;② Cells are fixed and permeabilized;③ Cellsand nodes are stained with a cocktail ofmonoclonal antibodies;④ The fluorescent signals are detected with flow cytometry
1.2.3 数据分析 SCNP的多维数据分析过程,一般包括数据标准化、可视化、关联分析。数据标准化,目的是去除背景值或噪音值的影响,反映出实验数据的真实变化。通常做法是将数据进行对数标准化(荧光数值分布通常呈现对数正态分布)。例如,估计细胞在静止状态下的平均荧光信号强度(themedian fluorescent intensity,MFI),basal=分辨信号通路网络节点蛋白的反应性和诱导性强弱,fold=所有激活的网络节点蛋白的信号强度,Total=数据可视化处理,以散点图、条图、饼图、线图等较为常用。多色图(热图)常用于高通量数据可视化,通常用红色、绿色和蓝色(包括上述3种颜色的深浅变化)来显示蛋白表达的高低,此时通常的二维图像变成了五维[19],能显示节点蛋白间的变化关系;关联分析则可以揭示不同细胞类型与疾病或免疫水平间的关系。包含了主成份分析和聚类分析模型的多款软件已经开发使用,不同分析模型各有所长。例如,高斯混合模型分析能够避免聚类分析过程中分类个数必须主观指定的缺陷;Boolean算法能够帮助研究者将不同标记的蛋白表型任意组合,有利于发现新的细胞亚型;FlowType工具则可分析若干细胞表型与疾病结果的关联性,对多重统计分析结果可自动校正[20-21],可挑选与疾病结果关联性最强的,具有代表性的细胞或蛋白表型,有助于疾病结局的预测以及设计出简单、有效的免疫分型方案;SPADE(spanning-tree progression analysis of densitynormalized events,SPADE)[22]则可直观区分细胞类型及其转化,甚至是细胞成分变化或细胞分化不同阶段的蛋白表达谱,还提供关于信号通路网络间的反馈调节等信息。
2 SCNP在医学研究中的应用
SCNP技术以其独特优势,在疾病机制、分类、治疗、结局预测、药物筛选、联合用药等医学研究中得以广泛应用。
2.1 发病机制研究 SCNP技术能分析患者的不同类型细胞的信号网络谱,更深刻了解肿瘤、自身免疫性疾病的本质。
利用SCNP技术,Longo等[3]发现B细胞BCR依赖anti-IgD诱导的激活通路蛋白 Syk、SFK、S6、Akt、Erk、p38的磷酸化水平亚裔美国人低于欧裔美国人,证实了相同信号通路的网络谱在人种间并不相同。高龄人群中CD45RA+细胞毒性T细胞的比例降低,与该细胞生存、增殖、分化密切相关的JAK-STAT信号反应性亦下降,证实信号通路网络谱于不同年龄表现出差异。David关于AML的治疗药物阿糖胞苷、吉妥单抗、地西他滨、阿扎胞苷、氯法拉滨的体外实验研究结果显示在不同急性白血病患者骨髓细胞的DNA损伤应答和凋亡信号特征完全不同,从而不同患者对药物的反应性也不相同,证实了患有相同疾病个体间细胞信号通路网络谱并不相同。Steven的研究还提示,属同一年龄段或同一细胞表型的AML个体患者均具有各自与疾病结局密切相关特殊信号网络谱。AML的研究显示,不同DNA损伤引起的凋亡与细胞Jak/Stat和PI3K信号通路模式密切相关[5]。通过 SCNP分析后发现在不同细胞亚群中,该通路的多个节点蛋白磷酸化水平截然不同,说明信号网络谱于不同类型细胞间并不相同[23]。因此,不同的人种、个体、年龄段、细胞类型之间的信号通路网络谱均不同,提示疾病形成机制的可能不同。
此外,研究表明细胞处于非静止状态能够提供更丰富的信息。例如,FMS样酪氨酸激酶受体3(FLT3)的变异(FLT3-ITD)程度一般作为白血病诊断复发的重要指标[24],但是应用SCNP技术研究发现,在细胞静止状态下,野生型和变异型FLT3的变异频率没有统计学差别,当相关癌症因子的刺激下,FLT3与FLT3-ITD对FLTL(FMS样酪氨酸激酶受体配体)的敏感性与信号应答范围不同,后者的应答范围明显比前者小,例如,与FLT3L相关的PI3K和Ras/Raf/Erk信号通路的反应性降低,p-stat5的反应性增强,IL-27刺激的Jak/Stat信号通路的反应性亦降低[25],而这一特点集中体现于疾病复发病例中。因此,SCNP分析,整合了细胞生物学、生物化学、生物信息学于一体,这将更深刻了解在不同环境下细胞表型、功能和行为特征,并在细胞水平上解释疾病在不同个体发展过程与结局并不相同的原因。基于此,SCNP亦将促进个性化治疗的实现。
2.2 疾病分类 细胞信号异常是细胞遗传、表观遗传和生物分子异常的集中体现,细胞信号通路网络谱比临床症状所包含疾病信息更加丰富,通过SCNP分析疾病的细胞信号网络谱,对疾病重新分类,促使更有效的诊疗方法产生,亦可为早期诊断、药物选择等提供信息[23]。
例如,通常只有60%AML的患者对普通化疗有效,应用SCNP分析发现,化疗完全敏感型的病例都具有完整的凋亡的信号通路,而不敏感型则表现出Akt通路蛋白的磷酸化程度比敏感型患者高(FLT3L介导的p-AKT、p-Erk表达信号增强)[7];Rosen等研究表明抗肿瘤药吉妥单抗,能够缓解AML患者的临床症状和提高生存率,而部分患者明显耐药,其部分原因是细胞AKT信号通路的激活,拮抗吉妥单抗诱导凋亡作用。表明相同疾病的不同病人其细胞信号网络谱的差异,导致了治疗的应答结果亦不相同。因此,不同于传统的疾病分类(细胞表型、复发与否、恶性与良性),信号通路网络谱是在分子或蛋白水平上将疾病重新精确分类。
2.3 疾病诊断及预后预测 SCNP方法可监测异常细胞群的细胞信号通路网络谱的变化,确定诊断的最佳时间,提高早期诊断的特异性。例如AML治疗中,除了分析AML细胞数量和免疫表型外,检测不同类型细胞内异常信号通路,为后续合理治疗提供帮助,与细胞形态学方法确定异常细胞免疫表型相比,SCNP则更加灵敏。另外,依赖于信号通路网络谱的疾病精确分类,可促进新型的诊断方法的建立。研究信号通路网络谱与疾病结果间的关系,将有助于对疾病结局的预测。例如,Kotecha等[26]对白血病幼年型粒-单核细胞白血病(juvenilemyelomonocytic leukemia,JMML)的研究中发现全血或骨髓中细胞亚群CD33+CD14+CD38low对GM-CSF异常敏感,p-Stat5的磷酸化水平会明显增强,该信号特征仅出现在JMML复发的病人,这一发现对疾病结局预测以及治疗靶标的选择具有重要意义。Irish等[23]利用SCNP技术发现急性白血病细胞内G-CSF诱导的p-Stat3与p-Stat5信号通路具有重要的预测价值。关于AML治疗效果的评价中,Komblau[7]利用SCNP研究发现除FLT3L变异之外,FLT3L介导的p-AKT,p-ErR表达信号增强亦可以预测AML复发的可能性。
2.4 药物研发 通常根据细胞靶标覆盖度和药物选择性来完成药物的初期筛选,其后的工作重点是候选药物的剂量及其调整。SCNP技术可在病例少、短时间、小投入的情况下能完成更有效的药物筛选。
SCNP技术具有在系统水平上,可检测原代细胞的信号通路网络特征,并兼具高通量分析的能力,决定了其在筛选安全、稳定和有效药物的明显优势。Krutzik等[27]结合FCB(fluorescent cell barcoding)细胞标记技术,选择小鼠的脾脏和外周血细胞,在96孔板上,利用SCNP技术对235个小分子化合物进行筛选,发现化合物对信号通路有选择性作用。例如,B细胞内,NSC210236抑制IL-6诱导的pStat3磷酸化的程度较其对IL-10诱导的pStat3和IL-4诱导的pStat5的抑制程度大。并且上述大部分药物表现出对B细胞的IL-6诱导的pStat3的抑制作用较强,而在T细胞中作用弱,表明化合物对信号通路的抑制作用亦有细胞类型选择性。他们还发现,增加同时分析细胞信号通路数目时,药物选择性降低,表明药物的选择性是相对的,这有利于药物副作用的评估,提高药物筛选的安全性[28]。Bodenmiller等[29]利用 CyTOF流式细胞仪,同时结合MCB(mass-tag cellular barcoding)细胞标记技术,分析了12个激酶刺激因子在8个不同时间点,对人类外周血有核细胞的14个细胞亚群,共186个节点蛋白的作用情况进行了检测,发现SCNP技术不仅能提供体内药物效应和药物代谢动力学的信息,还可提示细胞间信息交流情况,有助于化合物成药性分析。例如在研究中,INF-α诱导的pStat1的磷酸化水平在CD14+与CD14-T细胞中,随着时间延长逐渐降低,而NK细胞与lgM+B细胞与lgM-B细胞的pStat1磷酸化始终维持在中等水平;对LPS的刺激的时程分析中,T细胞和NK细胞的STAT3、STAT5与ITK的磷酸化出现于刺激后的2 h,而B细胞的STAT1的磷酸化出现于刺激后的4 h,研究者认为可能是由于IL-6或者其他因子之间交流所致。
除上述外,肿瘤、免疫性疾病的治疗中,利用SCNP分析,可以发现药物新靶标(通常为节点蛋白),根据新靶标选择药物、设计联合用药方案;其次,用药剂量决定了细胞内靶标修饰程度,后者又决定临床治疗效果,SCNP在细胞水平上可分析用药后,细胞内节点蛋白状态,从而评估药物的效能;第三,SCNP技术亦可应用于给药监测,依据药物靶标的修饰状态(通常监测血药浓度)来调整剂量以及判断有效剂量。故SCNP可以更全面、更有效地为临床药物的选择提供丰富信息,并且SCNP亦会是临床前期药物试验的有力手段。
最后,与非细胞依赖性的药物筛选技术相比,SCNP技术检测未分离组织的(全血、骨髓)细胞靶标状态,准确代表药物结合靶标的实际环境,提高了实验研究与临床关联性。在数据分析方面,传统药物筛选技术,常因“数据平均”处理导致数量较少细胞群的重要信息丢失,SCNP技术则可避免这一缺陷。例如Todd M利用SCNP技术分析PI3K与 Jak/Stat通路(前者影响细胞的生长和增殖,后者则影响细胞基因转录水平)调节因子的作用时发现,获得(重复100次)的调节因子的IC50值时,仅需80个细胞。因此,对数量极少的造血干细胞与肿瘤残留细胞(minimum residual disease,MRD)的生物学特征的分析成为了可能,这将对肿瘤复发研究有重要意义。
3 展望
SCNP以多参数流式细胞术为基础,在单细胞水平对复杂组织(如外周血、骨髓、肿瘤组织等)进行细胞信号通路网络谱分析,该方法优势明显,第一,不需要对细胞进行物理分离,又可避免“平均效应”而丢掉数量较少,但可能发挥关键作用细胞信息的丢失,在治疗后肿瘤复发等研究中有重要意义。第二,由于个体间、细胞类型间以及信号通路间单细胞网络谱具有特异性,相应地,药物作用也表现出这3种选择性,这可为组合用药及个体化治疗提供实验支持。第三,SCNP还能提供大量节点蛋白间的反馈调节及不同细胞间相互交流的丰富信息,因此,在药物筛选、药物浓度动态监测及药物副作用评估方面具有独特优势。最后该方法分析速度快、投入少,据2012年8月辉瑞制药商与美国生物技术公司Nodality达成单细胞网络谱分析技术合作协议,可预见SCNP在疾病机制研究以及药物研发方面的应用前景广阔。
参考文献:
[1] Covey TM,Putta S,Cesano A.Single cell network profiling(SCNP):Mapping drug and target interactions[J].Assay Drug Dev Technol,2010,8(3):321-43.
[2] Krutzik PO,Hale M B,Nolan GP.Characterization of themurine immunological signaling network with phosphospecific flow cytometry[J].J Immunol,2005,175(4):2366-73.
[3] Longo D M,Louie B,Putta S,et al.Single-cell network profiling of peripheral blood mononuclear cells from healthy donors reveals age-and race-associated differences in immune signaling pathway activation[J].J Immunology,2012,188(4):1717-25.
[4] Gibbs K D Jr,Gilbert PM,Sachs K,et al.Single-cell phosphospecific flow cytometric analysis demonstrates biochemical and functional heterogeneity in human hematopoietic stem and progenitor compartments[J].Blood,2011,117(16):4226-33.
[5] Rosen D B,Putta S,Covey T,et al.Distinct patterns of DNA damage response and apoptosis correlate with Jak/Stat and PI3Kinase response profiles in human acutemyelogenous leukemia[J].PLoSOne,2010,5(8):e12405.
[6] Kornblau SM,Minden M D,Rosen D B,et al.Dynamic singlecell network profiles in acutemyelogenous leukemia are associated with patient response to standard induction therapy[J].Clin Cancer Res,2010,16(14):3721-33.
[7] Hale M B,Krutzik PO,Samra SS,et al.Stage dependent aberrant regulation of cytokine-STAT signaling inmurine systemic lupus erythematosus[J].PLoSOne,2009,4(8):e6756.
[8] Leslie D,Lipsky P,Notkins A L.Autoantibodies as predictors of disease[J].JClin Invest,2001,108(10):1417-22.
[9] Braqado P,Estrada Y,Sosa M S,et al.Analysis ofmarker-defined HNSCC subpopulations reveals a dynamic regulation of tumor initiating properties[J].PLoSOne,2012,7(1):e29974.
[10]Choijamts B,Jimi S,Kondo T,et al.CD133+cancer stem celllike cells derived from uterine carcinosarcoma(malignant mixed Mullerian tumor)[J].Stem Cells,2011,29(10):1485-95.
[11]Yang J,Luo H,Li Y,Li J,et al.Intratumoral heterogeneity determines discordant results of diagnostic tests for human epidermal growth factor receptor(HER)2 in gastric cancer specimens[J].Cell Biochem Biophys,2012,62(1):221-8.
[12]Covey T M,Cesano A,Parkinson D R,et al.Single-cell network profiling(SCNP)by flow cytometry in autoimmune disease[J].Autoimmunity,2010,43(7):550-9.
[13]Bendall SC,Nolan G P,Roederer M,et al.A deep profiler′s guide to cytometry[J].Trends Immunol,2012,33(7):323-32.
[14]Bendall SC,Nolan G P.From single cells to deep phenotypes in cancer[J].Nat Biotechnol,2012,30(7):639-47.
[15] Chattopadhyay P K,Roederer M.Cytometry:today's technology and tomorrow's horizons[J].Methods,2012,57(3):251-8.
[16]Suda T,Takubo K,Semenza G L.Metabolic Regulation of Hematopoietic Stem Cells in the Hypoxic Niche[J].Cell Stem Cell,2011,9(4):298-310.
[17]Havenith SH,Yong S L,Henson SM,et al.Analysis of stemcell-like properties of human CD161++IL-18Rα+memory CD8+T cells[J].Int Immunol,2012,24(10):625-36.
[18]Gattinoni L,Lugli E,Ji Y,et al.A human memory T cell subset with stem cell-like properties[J].NatMed,2011,17(10):1290-7.
[19]Roederer M,Moody M A.Polychromatic plots:graphical display ofmultidimensional data[J].Cytometry A,2008,73(9):868-74.
[20] Boedigheimer M J,Ferbas J.Mixture modeling approach to flow cytometry data[J].Cytometry A,2008,73(5):421-9.
[21]Chan C,Feng F,Ottinger J,et al.Statisticalmixturemodeling for cell subtype identification in flow cytometry[J].Cytometry A,2008,73(8):693-701.
[22]Qiu P,Simonds E F,Bendall SC,etal.Extracting a cellular hierarchy from high-dimensional cytometry data with SPADE[J].Nat Biotechnol,2011,29(10):886-91.
[23]Irish JM,Hovland R,Krutzik PO,et al.Single cell profiling of potentiated phospho-protein networks in cancer cells[J].Cell,2004,118(2):217-28.
[24]Baldus C D,Thiede C,Soucek S,et al.BAALC expression and FLT3 internal tandem duplicationmutations in acutemyeloid leukemia patients with normal cytogenetics:prognostic implications[J].JClin Oncol,2006,24(5):790-7.
[25]Döhner H,Estey E H,Amadori S,et al.Diagnosis and management of acute myeloid leukemia in adults:recommendations from an international expert panel,on behalf of the European Leukemia[J].Blood,2010,115(3):453-74.
[26]Kotecha N,Flores N J,Irish JM,etal.Single-cell profiling identifies aberrant STAT5 activation in myeloid malignancies with specific clinical and biologic correlates[J].Cancer Cell,2008 14(4):335-43.
[27]Krutzik PO,Nolan G P.Fluorescent cell barcoding in flow cytometry allows high-throughput drug screening and signaling profiling[J].Nat Methods,2006,3(5):361-8.
[28]Krutzik PO,Crane JM,Clutter M R,Nolan G P.High-content single-cell drug screeningwith phosphospecific flow cytometry[J].Nat Chem Biol,2008,4(2):132-42.
[29]Bodenmiller B,Zunder ER,Finck R,etal.Multiplexedmass cytometry profiling of cellular states perturbed by small-molecule regulators[J].Nat Biotechnol,2012,30(9):858-67.

