牛磺酸镁对缺氧/复氧致大鼠心肌细胞钙离子通道异常的影响
张铭慧,尹永强,康 毅,娄建石
(1.天津医科大学总医院药剂科,天津 300052;2.天津医科大学药理学教研室,天津 300070)
心律失常是临床上常见且对患者生活质量和生命安全影响极大的心血管疾病。对于大多数心律失常患者,无论是预防还是治疗,药物都是主要的手段,但是很多抗心律失常药物在治疗心律失常的同时,又有诱发新的心律失常等不良反应的危险,因此,我们必须以新的思路和途径去寻找和发现疗效高和毒副反应小的抗心律失常药。牛磺酸镁(taurine magnesium coordination compound,TMCC)是我室采用高pH法,将含有受体原子的牛磺酸和镁离子螯合成了一种新的配合物,此配合物对多种原因引起的心律失常都具有防治效果,其对氯化钙、乌头碱、哇巴因、氯化铯、电刺激、肾上腺素等诱导的心律失常与触发活动有确切的防治效果[1-2]。细胞水平的研究也表明该配合物不仅对正常心肌细胞钠、钾、钙离子通道均有影响[3-4],而且能恢复乌头碱和哇巴因诱发的钠电流及钙电流异常[5-7],也能对抗缺氧/复氧损伤引起的内向整流钾电流及瞬时外向钾电流的异常[8-9],提示其可能具有广泛的抗心律失常作用。缺血缺氧一段时间,心肌在重新恢复血液供应后,心肌不一定都会恢复其正常功能和结构,反而出现心肌细胞损伤加重的表现,即心肌缺血/再灌注损伤。心肌缺血/再灌注时,大量钙离子进入细胞内,导致细胞内钙超负荷,引发触发性心律失常,但目前尚未见TMCC对缺氧复氧所致异常钙电流作用的报道,因此,本实验在大鼠心肌细胞缺氧/复氧损伤模型中观察了TMCC对钙离子通道的作用,以进一步探讨其抗心律失常作用机制。
1 材料与方法
1.1 材料
1.1 .1 实验动物 健康成年Wistar大鼠,♂♀不拘,体质量250~300 g,合格证号SCXK(京)2007-0001,由北京维通利华实验动物技术有限公司提供。
1.1 .2 药品和试剂 HEPES、EGTA、Na2-ATP、Mg-ATP、胶原酶Ⅱ等购自Sigma公司。TMCC由天津医科大学化学教研室合成,溶于蒸馏水配成58 g·L-1母液,每次实验时,把母液溶于细胞外液中,配成实验所需浓度。
1.1 .3 主要仪器 膜片钳仪,MuhiClamp 700B,USA;数 -模转换器,DigiData 1440A,USA;倒置显微镜,IX51,Japan;三维操纵仪,MP-225,USA;微电极拉制仪,P-97,USA;恒流泵,Peri-Star,台湾;酸度计,PB-10,German;石英双重纯水蒸馏器,江苏省金坛市正基仪器有限公司。
1.1.4 液体的制备 台氏液(mmol·L-1)NaCl 136,KCl 5.4,MgCl21.0,NaH2PO40.33,HEPES 10,glucose 10,CaC121.8,用NaOH调 pH至7.4。无钙台氏液除没有CaC12外,其余成分与台氏液相同。细胞保存液(KB液,mmol·L-1):L-谷氨酸 70;牛磺酸 15,KCl 30,KH2PO410,MgCl20.5,EGTA 0.5,HEPES 10,glucose 10,用KOH调pH至7.35。钙外液(mmol·L-1):Tris-Cl 136,CsCl 5.4,MgCl21,CaCl22,HEPES 10,glucose 10,用 Tris-OH调 pH至7.4。钙内液 (mmol· L-1):CsOH 110,aspartate 110,CsCl 20,MgCl21,EGTA 10,HEPES 10,Mg-ATP 5,用CsOH调pH至7.2。以上液体在使用前均需充以纯氧20 min以上。模拟钙缺氧外液(mmol·L-1):Tris-Cl 136,CsCl5.4,MgCl21,CaCl22,HEPES 10,用Tris-OH调pH至6.8,并充以100%N220min以上。
1.2 方法
1.2.1 单个大鼠心肌细胞的分离 25%的乌拉坦将麻醉大鼠,仰卧位固定于鼠台上,迅速从剑突下剪开胸腔暴露心脏,从主动脉根部离断取出心脏置于4℃台氏液中,去除脂肪及结缔组织。将主动脉逆行插管连接于Langendorff灌流装置上。首先以无钙台氏液连续灌流5 min,待洗尽残血,心脏停止跳动后改用50 ml含15 mg胶原酶Ⅱ的无钙台氏液进行循环灌流。随着灌流的进行,流出液变得黏稠,心肌的颜色逐渐变浅、透亮,心脏体积逐渐变大、松软。此时将心脏自左心室分段取心室肌组织,置于装有KB液的试管中,用吸管轻轻吹打,使之分散成单个细胞,置4℃冰箱稳定2 h待用。所有液体均以纯氧饱和,整个灌流系统温度保持在37℃。
1.2.2 L-型钙电流(ICa,L)的记录 应用全细胞膜片钳技术记录单细胞离子电流。所用微电极用两步拉制法制成,微电极充灌电极液后电阻在2~4 MΩ之间。电流信号经MultiClamp700B膜片钳放大器、DigiData 1440A数-模转换器及Pclampex 10.0采集、贮存及分析。将细胞悬液置于1 ml浴槽中,待细胞自然贴壁后,用细胞外液进行灌流,流速1ml·min-1。选用静止、大小相近、纹理清晰的杆状细胞进行实验。待高阻封接形成后,进行电极电容补偿,负压或高电压脉冲破膜,补偿膜电容、串联电阻及漏电流,形成全细胞记录方式,平衡5min,待电极内液与细胞内液交换充分后,进行膜电流记录。膜电流的大小以电流密度,即单位膜电容的膜电流表示。
1.2.3 实验分组和造模 实验分为正常对照组、缺氧/复氧模型组(H/R)、100μmol·L-1TMCC+H/R组、200μmol·L-1TMCC+H/R组、400μmol·L-1TMCC+H/R组、24.24μmol·L-1amiodarone+H/R组。将分离的细胞置于槽中,待贴壁后,先用记录钙通道电流的正常细胞外液进行灌流(流速1 ml·min-1),封接形成全细胞记录模式后,平衡5 min,待电极内液与细胞内液交换充分后,进行膜电流记录,此为正常细胞钙电流;然后用记录钙通道电流的模拟缺氧细胞外液冲洗替换原浴槽中的正常外液,15 min后再以正常复氧外液冲洗替换掉模拟缺氧外液,5 min后记录即为缺氧/复氧组钙电流;TMCC组和胺碘酮组分别在正常有氧钙外液中加入不同浓度TMCC和胺碘酮。记录ICa,L时细胞外液中用Tris-Cl代替NaCl,细胞内外液中均用CsCl代替KCl以排除钠电流和钾电流的影响。形成全细胞构型后,在电压钳模式下记录电流。将钳制电位固定于-40 mV,指令电压从-40 mV以10 mV为步阶逐步阶跃至+60 mV,脉冲持续时间150 ms,可记录到大鼠心室肌细胞的ICa,L电流,见Fig 1。

Fig 1 Changes of I Ca,L currents after TMCC and am iodarone adm inistration during hypoxia-reoxygenation in rat ventricular cardiomyocytesA:Control;B:H/R;C:100μmol·L-1 TMCC+H/R;D:200 μmol·L-1 TMCC+H/R;E:400μmol·L-1 TMCC+H/R;F:24.24μmol·L-1 amiodarone+H/R.
1.3 数据处理 实验结果数据以表示,采用SPSS 17.0统计软件,单因素方差分析给药组与对照组间的差异显著性。
2 结果
2.1 TMCC、胺碘酮对大鼠心肌细胞缺氧/复氧损伤模型钙离子通道电流的影响 形成全细胞构型后,在电压钳模式下记录电流。钳制电位固定于-40 mV,指令电压从-40 mV以10 mV为步阶逐步阶跃至+60 mV。各浓度TMCC及胺碘酮作用后钙电流峰值变化见Fig 2A。结果表明,与正常对照组相比,缺氧/复氧使钙电流明显增大(n=6,P<0.01),TMCC(200、400μmol·L-1)能部分恢复缺氧/复氧损伤引起的钙电流增大(n=6,P<0.01),且呈浓度依赖性。胺碘酮也使增大的钙电流减小,其作用与400μmol·L-1TMCC相当。以峰电流对膜电位作图得到电流-电压(I-V)曲线,可以看出缺氧/复氧使钙电流增大,I-V曲线下移。TMCC(100,200、400μmol·L-1)和胺碘酮能部分恢复缺氧/复氧损伤引起的钙电流增大,使I-V曲线上移。曲线无平行移动,基本不改变曲线的形状。TMCC(100、200、400μmol·L-1)及胺碘酮对缺氧/复氧损伤模型ICa,L电流-电压曲线的影响见Fig 2B。

Fig 2 Effects of TMCC and am iodarone on I Ca,L in rat ventricular m yocardiocytes during hypoxia-reoxygenationA:I Ca,L peak;B:I-V curve.*P<0.05,**P<0.01 vs control;ΔΔP<0.01 vs H/R group.
2.2 TMCC、胺碘酮对大鼠心肌细胞缺氧/复氧损伤模型钙离子通道稳态激活动力学的影响 将ICa,L电流-电压(I-V)曲线的结果转化为膜电导(G),对条件刺激电压作图,然后采用Boltzman方程G/Gmax=1/[1+exp(V-V1/2)/K]进行拟合,得到 ICa,L稳态激活曲线。式中Gmax为最大膜电导,V1/2为半数激活电压,K为斜率参数。各浓度TMCC及胺碘酮作用后钙通道半数激活电位及K值变化见Fig 3A。结果表明:与正常对照组相比,缺氧/复氧使半数激活电压明显升高,激活曲线左移,激活加快。TMCC(200、400μmol·L-1)和胺碘酮(24.24μmol·L-1)可使增大的半数激活电位降低,恢复左移的激活曲线,使激活减慢。TMCC(100、200、400μmol·L-1)及胺碘酮对缺氧/复氧损伤模型ICa,L稳态激活曲线的影响见Fig 3B。

Fig 3 Effects of TMCC and am iodarone on I Ca,L steady-state activation kinetics in rat ventricular m yocardiocytes during hypoxiareoxygenationA:Half activation potential and K;B:Steady-state activation curve.*P<0.05,**P<0.01 vs control;ΔP<0.05,ΔΔP<0.01 vs H/R group.
2.3 TMCC、胺碘酮对大鼠心肌细胞缺氧/复氧损伤模型钙离子通道稳态失活动力学的影响 采用双脉冲刺激法测定ICa,L的失活曲线。钳制电压-40 mV施予1000 ms,阶跃10mV,-40~20 mV系列条件脉冲刺激,在每一条件脉冲后紧跟一固定去极化至0 mV,150 ms的测试脉冲。以电流的相对值(I/Imax)对条件脉冲电压作图,得出 ICa,L的失活曲线。依 Boltzman方程 I/Imax=1/[1+exp(V-V1/2)/K]进行拟合。式中Imax为最大膜电流,V1/2为半数失活电压,K为斜率参数。各浓度TMCC及胺碘酮作用后钙通道半数失活电位及K值变化见Fig 4A。结果表明:与正常对照组相比,缺氧/复氧使半数失活电压明显减小,失活曲线右移,失活减慢。TMCC(200、400μmol·L-1)和胺碘酮(24.24μmol·L-1)可使减小的半数失活电位增大,恢复右移的失活曲线,使失活加快。TMCC 100、200、400μmol·L-1及胺碘酮对缺氧/复氧损伤模型ICa,L稳态失活曲线的影响见Fig 4B。
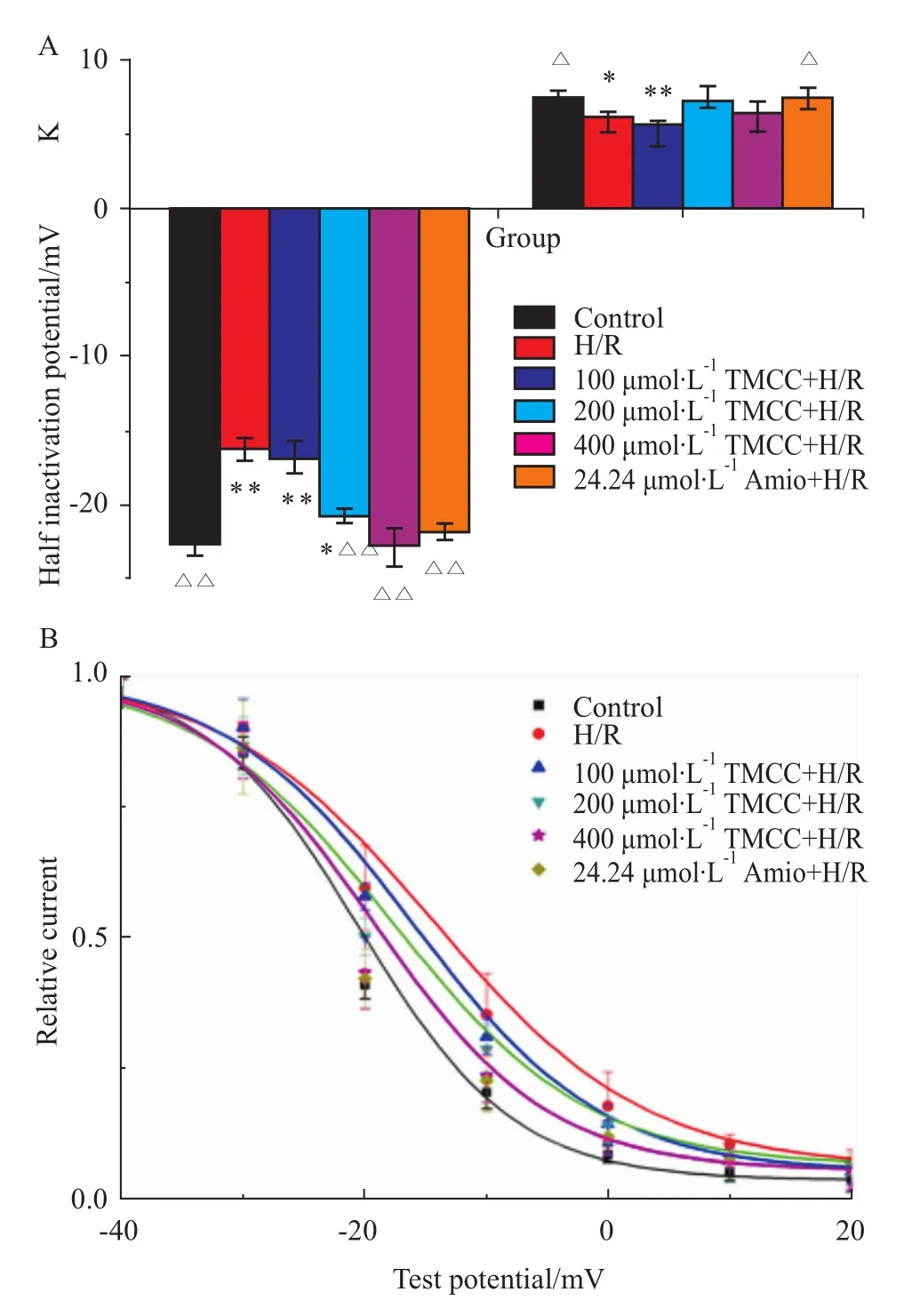
Fig 4 Effects of TMCC and am iodarone on I Ca,L steady-state inactivation kinetics in rat ventricular myocardiocytes during hypoxiareoxygenation)A:Half inactivation potential and K;B:Steady-state inactivation curve.*P<0.05,**P<0.01 vs control;ΔP<0.05,ΔΔP<0.01 vs H/R group.
3 讨论
心脏钙通道功能直接影响到心肌电兴奋的传导及收缩功能,它往往是抗心律失常及抗心力衰竭药物的作用对象。以往有报道表明,缺血10 min后再灌注时,缺血心室肌细胞膜上离子通道电生理学特性的改变与单纯心肌缺血时相似[10],易诱发折返性心律失常[11];缺血30 min后再灌注时,细胞内钠离子增多,激活钠-钙交换电流,引起细胞内钙超载,从而诱发触发电活动,使心脏易发生触发机制介导的心律失常[12]。也有文献报道[13],模拟缺血液灌流10、20 min,使钙电流峰值增大,继以正常电极外液灌流10、20 min后,钙电流将会进一步增大。本实验选用缺氧15 min后复氧,结果显示,缺氧使钙电流增加,复氧使其进一步增大,恢复再灌注后ICa,L的进一步增大不仅在组织学上加重心肌损伤,在电生理上也易产生后除极电位,从而使再灌注触发活性发生率上升,形成再灌注心律失常。
Satoh等[14-15]研究发现,在钙超载时牛磺酸对兔的窦房结细胞自发性活动能明显抑制,但若不连续给予牛磺酸则容易引发细胞内钙超载,另外,在低钙和钙超载情况下,牛磺酸都可能呈现心肌保护作用。镁离子也可通过影响通道的动力学[16]对L-型钙通道起拮抗作用,它是一个广谱抗心律失常药。牛磺酸镁配合物作为一种可行的新型治疗药物,其抗心律失常作用优于牛磺酸与镁剂单独和联合应用。本实验室前期研究证明其对大鼠正常心室肌细胞ICa,L有双向的调节作用,即低浓度时呈现一定的抑制作用,而高浓度则呈现促进作用。本实验中,TMCC对缺氧/复氧损伤引起的钙电流增大不但没有加剧,反而有浓度依赖性的恢复,提示TMCC不但不会引起钙超载的加重,反而会对抗缺氧/复氧损伤引起的钙内流增加,因此推断TMCC可能具有一定的对抗心肌缺血/再灌注损伤的作用,这一现象也提示TMCC的作用可能与钙通道的状态有关,即在钙通道过度抑制时表现为促进作用,而在钙通道过度兴奋时表现为抑制作用,它能够使失衡的钙离子通道状态恢复或接近原有的平衡状态,有利于在治疗心律失常的同时减少致心律失常的风险,满足最佳靶点学说对抗心律失常药物的要求。
L-型钙通道在缺血/再灌注诱发的细胞内钙超载早期形成中起主要作用,一旦细胞内钙负荷持续增加,就会破坏膜的正常通透功能,导致Na+/Ca2+交换激增,引起由Na+/Ca2+交换主导钙超载的进一步发生,而TMCC对其是否起作用尚需在以后的实验中进一步验证。
参考文献:
[1] 刘 欣,汪 涛,周宝宽,等.牛磺酸镁对抗哇巴因诱发心律失常的实验研究[J].中国心血管杂志,2004,9(2):79-82.
[1] Liu X,Wang T,Zhou B K,et al.Antiarrhythmic effects of taurine-magnesium coordination compound in ouabaine-induced arrhythmias of guinea pig in vivo[J].Chin JCardiovasc Med,2004,9(2):79-82.
[2] 孙 涛,康 毅,娄建石,等.牛磺酸镁的合成及对乌头碱诱发心律失常的作用[J].中国心血管杂志,2003,8(4):238-9.
[2] Sun T,Kang Y,Lou JS,etal.Synthesis and effectof arrhythmia induced by aconitine on taurine-magnesium coordination compound[J].Chin JCardiovasc Med,2003,8(4):238-9.
[3] 于 雷,尹永强,李 欣,等.牛磺酸镁对豚鼠心室肌细胞钾离子通道的影响[J].中国药理学通报,2008,24(2):203-5.
[3] Yu L,Yin Y Q,Li X,et al.Effect of taurinemagnesium coordination compound on potassium current in guinea pig ventricular cardiomyocytes[J].Chin Pharmacol Bull,2008,24(2):203-5.
[4] 于 雷,尹永强,李 欣,等.牛磺酸镁配合物对豚鼠心室肌细胞钠离子和钙离子通道的影响[J].中国药理学与毒理学杂志,2009,23(1):17-22.
[4] Yu L,Yin Y Q,Li X,et al.Effect of taurinemagnesium coordination compound on sodium and calcium channels in guinea pig ventricular cardiomyocytes[J].Chin JPharmacol Toxicol,2009,23(1):17-22.
[5] 汪玲芳,尹永强,赵 临,等.牛磺酸镁对乌头碱致大鼠心肌细胞心律失常模型钠离子通道的影响[J].中国药理学通报,2010,26(5):611-5.
[5] Wang L F,Yin Y Q,Zhao L,et al.Effect of taurinemagnesium coordination compound on sodium channel in rat cardiomyocytes of arrhythmia induced by aconitine[J].Chin Pharmacol Bull,2010,26(5):611-5.
[6] 汪玲芳,尹永强,赵 临,等.牛磺酸镁对乌头碱致大鼠心肌细胞心律失常模型钙离子通道的影响[J].中国新药与临床杂志,2011,30(1):39-42.
[6] Wang L F,Yin Y Q,Zhao L,et al.Effect of taurinemagnesium coordination compound on calcium channel in rat cardiomyocytes of arrhythmia induced by aconitine[J].Chin JNew DrugsClin Rem,2011,30(1):39-42.
[7] Zhao L,Lou JS,Wu H,et al.Effects of taurinemagnesium coordination compound on ionic channel in rat ventricularmyocytes of arrhythmia induced by ouabain[J].Biol Trace Elem Res,2012,147(1-3):275-84.
[8] 何海燕,尹永强,李宏杰,等.牛磺酸镁对缺氧/复氧致大鼠心肌细胞内向整流钾通道异常的影响[J].中国药理学通报,2012,28(12):1751-6.
[8] He H Y,Yin Y Q,Li H J,et al.Effects of taurine-magnesium coordination compound on abnormal inward rectifier potassium channel current induced by hypoxia-reoxygenation in cardiomyocytes of rats[J].Chin Pharmacol Bull,2012,28(12):1751-6.
[9] 李宏杰,尹永强,张铭慧,等.牛磺酸镁配合物对缺氧复氧致大鼠心肌细胞瞬时外向钾离子通道异常的影响[J].中国新药与临床杂志,2012,31(5):276-80.
[9] Li H J,Yin Y Q,Zhang M H,etal.Effect of taurine-magnesium coordination compound on abnormal transient outward potassium current induced by hypoxia-reoxygenation in cardiomyocytes of rats[J].Chin JNew Drugs Clin Rem,2012,31(5):276-80.
[10]齐书英,刘坤申,胡丽叶,等.模拟缺血缺氧对左室心肌细胞钠电流跨壁异质性的影 响[J].医学研究生学报,2003,16(11):814-7.
[10]Qi SY,Liu K S,Hu L Y,etal.Effects of simulated ischemia on the sodium current heterogeneity ofmyocytes from rabbit left free wall[J].JMed Postgraduat,2003,16(11):814-7.
[11]刘泰楗.心肌细胞电生理学[M].北京:北京大学出版社,2000:27-9.
[11]Liu T J.Myocardial cell electrophysiology[M].Beijing:Peking U-niversity Press,2000:27-9.
[12]石毓澍,陈 新,周金台.心脏电生理学进展[M].北京:中国科学技术出版社,1994:304-9.
[12]Shi Y S,Chen X,Zhou JT.Progress in cardiac electrophysiology[M].Beijing:China Science and Technology Press,1994:304-9.
[13]邹路芸,蒋文平.缺血/再灌注对心室肌细胞膜离子通道的影响[J].中国心脏起搏与心电生理杂志,1999,13(4):230-3.
[13]Zou L Y,JiangW P.Effectof ischemia/reperfusion onmembrane ionic channels of guinea pig ventricularmyocytes[J].Chin JCard Pacing Electrophys,1999,13(4):230-3.
[14]Satoh H.[Ca2+]i-dependent actions of taurine in spontaneously beating rabbit sino-atrial nodal cells[J].Eur JPharmacol,2001,424(1):19-25.
[15]Satoh H,Sperelakis N.Review of some actions of taurine on ion channels of cardiacmuscle cells and others[J].Gen Pharmacol,1998,30(4):451-63.
[16]Wang M,Tashiro M,Berlin J R.Regulation of L-type calcium current by intracellular magnesium in rat cardiomyocytes[J].J Physiol,2004,555(Pt2):383-96.

