血管紧张素Ⅱ及其受体与类风湿关节炎
王 迪,胡姗姗,魏 伟
(安徽医科大学临床药理研究所,抗炎免疫药物教育部重点实验室,安徽合肥 230032)
类风湿关节炎(rheumatoid arthritis,RA)是一种慢性的、系统性的自身免疫病,以受累关节的滑膜炎症和血管翳为基本病变,多数患者伴有软骨和骨的破坏。1984年,Martin等[1]观察到血管紧张素转化酶抑制剂(angiotensin converting enzyme inhibitors,ACEIs)卡托普利对RA患者具有治疗作用,并将此归因于卡托普利含有的巯基结构使其具有了类似于改善病情的抗风湿药 (disease-modifying anti-rheumatic drugs,DMARDs)的特性。随后的研究发现,血管紧张素Ⅱ与1型受体(angiotensinⅡ type 1 receptor,AT1R)作用后可以促进RA患者体内的炎症免疫反应,通过阻断血管紧张素Ⅱ与AT1R的相互作用可以缓解RA患者的炎症免疫损伤。本文对近年来血管紧张素Ⅱ及其受体在RA中病理机制和治疗作用的研究进展进行综述,以期为其付诸于RA治疗的临床应用提供思路。
1 血管紧张素Ⅱ及其受体参与炎症免疫反应
血管紧张素Ⅱ是血管紧张素原在肾素和血管紧张素转化酶(angiotensin converting enzyme,ACE)的作用下或者通过糜蛋白酶等非ACE途径形成的八肽化合物(Fig 1)。血管紧张素Ⅱ的受体包括AT1R和2型受体(angiotensinⅡ type 2 receptor,AT2R),二者与血管紧张素Ⅱ的亲和力相似,且均与G蛋白偶联,为G蛋白偶联受体。血管紧张素Ⅱ通过AT1R在循环系统内发挥着收缩血管、调节血压和水钠平衡等作用。在高血压、充血性心力衰竭等心血管疾病治疗中广泛使用的ACEIs和AT1R阻断剂就是分别通过限制血管紧张素Ⅱ的产生或者阻断血管紧张素Ⅱ与AT1R受体的结合来发挥治疗效应。由于理论上血管紧张素Ⅱ的产生还存在糜蛋白酶等非ACE途径,且有部分病人因干咳不能耐受ACEIs,因此AT1R阻断剂较ACEIs具有更好的应用前景。目前临床使用的或正进行临床试验的AT1R阻断剂已达10多种,其中研究与应用最多的是氯沙坦。
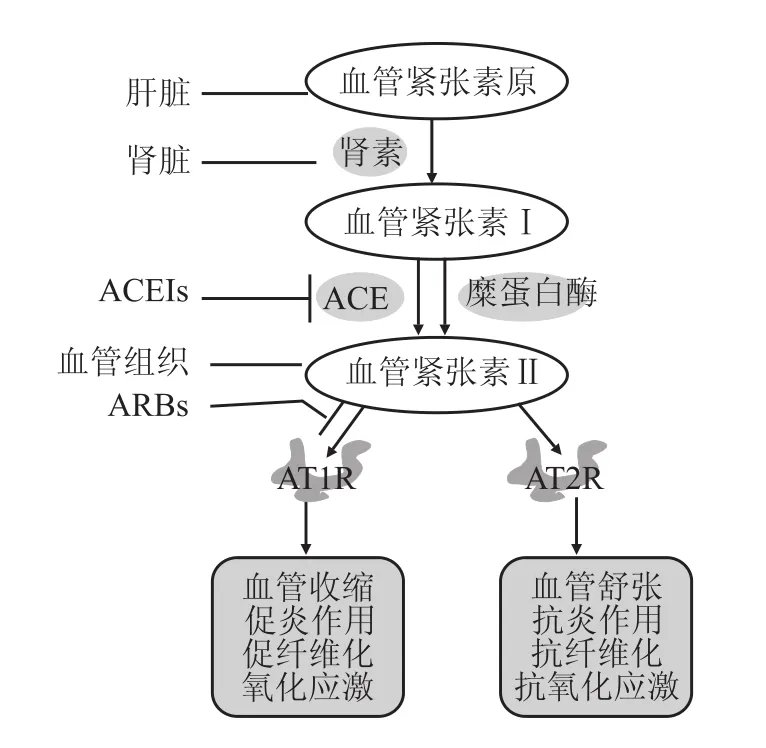
Fig 1 AngiotensinⅡ and receptors.Traditionally,the RASwas viewed as a circulating endocrine system,whereby renin released from the juxtaglomerular cells of the kidney cleaves the liver-derived macroglobulin precursor angiotensinogen,to produce the inactive decapeptide angiotensinⅠ,which is then converted to the active octapeptide angiotensinⅡthrough enzymatic cleavages by ACE within the pulmonary circulation.Furthermore,angiotensinⅡ production can also be regulated by chymase via non-ACE pathway within RAS.AngiotensinⅡ acts through AT1R and AT2R,respectively.ACEIs stop angiotensinⅠ translating into angiotensinⅡ by inhibiting ACE activity,ARBs prevent angiotensinⅡexerting its effects via AT1R.
近年来的研究表明,单核/巨噬细胞、树突状细胞和T淋巴细胞等炎症免疫细胞均拥有独立的肾素-血管紧张素系统[2]。血管紧张素Ⅱ以自分泌或旁分泌的形式与炎症免疫细胞上的AT1R作用,通过刺激单核细胞趋化移行、诱导树突状细胞分化成熟、促进T淋巴细胞活化增殖、增强Th1和Th17免疫功能,进而参与炎症免疫反应。血管紧张素Ⅱ可以通过刺激黏附分子的表达,促进炎症免疫细胞与血管内皮细胞的相互作用,维持血管内皮的炎症微环境,这在高血压和动脉粥样硬化的早期血管病变中发挥重要作用,提示血管紧张素Ⅱ和炎症免疫疾病可能具有重要联系[3]。一系列有关血管紧张素Ⅱ在自身免疫病中的研究发现,活性升高的血管紧张素Ⅱ-AT1R促进了自身免疫性肾炎狼疮样小鼠和实验性自身免疫脑脊髓炎(experimental autoimmune encephalomyelitis,EAE)小鼠的疾病表现,同时ACEIs和AT1R阻断剂对狼疮样小鼠和EAE小鼠自身免疫损伤和炎症反应的缓解作用也进一步证实了血管紧张素Ⅱ-AT1R在自身免疫病致病机制中的重要作用[4-5]。
2 AT1R促进RA的炎症免疫反应
有研究表明[6-7],RA病人的外周血单个核细胞(peripheral blood mononuclear cells,PBMCs)和炎症滑膜组织中血管紧张素Ⅱ水平和AT1R表达明显升高,提示血管紧张素Ⅱ-AT1R参与RA疾病进程;血管紧张素Ⅱ与AT1R作用后,通过激活下游核转录因子-κB(nuclear transcription factor-kappa B,NF-κB)信号途径,抑制体外培养的RA成纤维样滑膜细胞的凋亡,促进其对关节软骨的破坏[8]。在RA的实验动物模型中,血管紧张素Ⅱ-AT1R影响T淋巴细胞介导的细胞免疫,促进Th1和Th17免疫功能。有研究发现通过限制血管紧张素Ⅱ的产生可以降低胶原性关节炎(collagen-induced arthritis,CIA)小鼠体内Th1特异性的免疫球蛋白 IgG2a和TNF-α水平[9]。阻断血管紧张素Ⅱ与AT1R的作用可抑制CIA小鼠中Th1免疫反应,恢复Th1/Th2免疫平衡,缓解RA动物模型的关节炎表现[10]。
血管紧张素Ⅱ与T淋巴细胞上的AT1R作用后,激活AT1R下游的信号通路,升高胞内钙离子浓度,进而活化钙调磷酸酶,促进活化的T淋巴细胞核因子(nuclear factor of activated T cells,NFATs)去磷酸化,激活的NFATs转位至胞核内,促进T淋巴细胞有关活化和增殖的基因转录。研究发现,AT1R激活后还会引起信号转导子和转录激活子-4(signal transducer and activator of transcription 4,STAT-4)的活化,进而促进Th1和Th17的分化;ACEIs(赖诺普利)抑制STAT-4,诱导细胞因子信号转导抑制子-1(suppressors of cytokine signaling-1,SOCS-1),抑制经典的 NF-κB1信号复合物,激活选择性的NF-κB2途径,进而抑制Th1和Th17免疫反应,诱导调节性T细胞增多。
研究报道[11],RA病人使用AT1R阻断剂治疗后,可以有效改善体内炎症环境,降低外周血红细胞沉降率和C反应蛋白的水平。最近研究发现,甲氨蝶呤(methotrexate,MTX)和AT1R阻断剂联合治疗佐剂性关节炎(adjuvant-induced arthritis,AIA)大鼠不仅可以提高二者单独使用的疗效,还可以降低MTX对肝脏的毒性反应[12]。AT1R作为RA治疗的新靶点,目前一项有关AT1R阻断剂对RA临床疗效的随机、对照临床试验正在英国开展,但研究结果尚未公开发表[13]。一般认为AT1R阻断剂对RA的作用是通过阻断血管紧张素Ⅱ与炎症免疫细胞(T淋巴细胞、单核/巨噬细胞)、滑膜细胞或内皮细胞上AT1R的结合,抑制炎症免疫反应,缓解关节组织或血管内皮功能的破坏,达到治疗目的。
虽然目前还尚未见有关血管紧张素Ⅱ对RA中B淋巴细胞直接作用的研究报道,但血管紧张素Ⅱ-AT1R对自身免疫中T淋巴细胞功能的调节以及T、B淋巴细胞间的密切联系提示我们不容忽视。有研究在正常C57BL/6小鼠脾脏中分离的B淋巴细胞中检测到了AT1R的mRNA存在,提示血管紧张素Ⅱ可能与B淋巴细胞存在某种自分泌或旁分泌的关系,并且这种关系可能会在炎症免疫反应中发挥作用。也有研究发现,在小鼠CIA后期(分别在d 88和d 56),限制血管紧张素Ⅱ的产生和阻断其与AT1R的作用可以降低免疫球蛋白IgG2a的水平,这可能与抑制特异性B淋巴细胞介导的体液免疫反应有关。
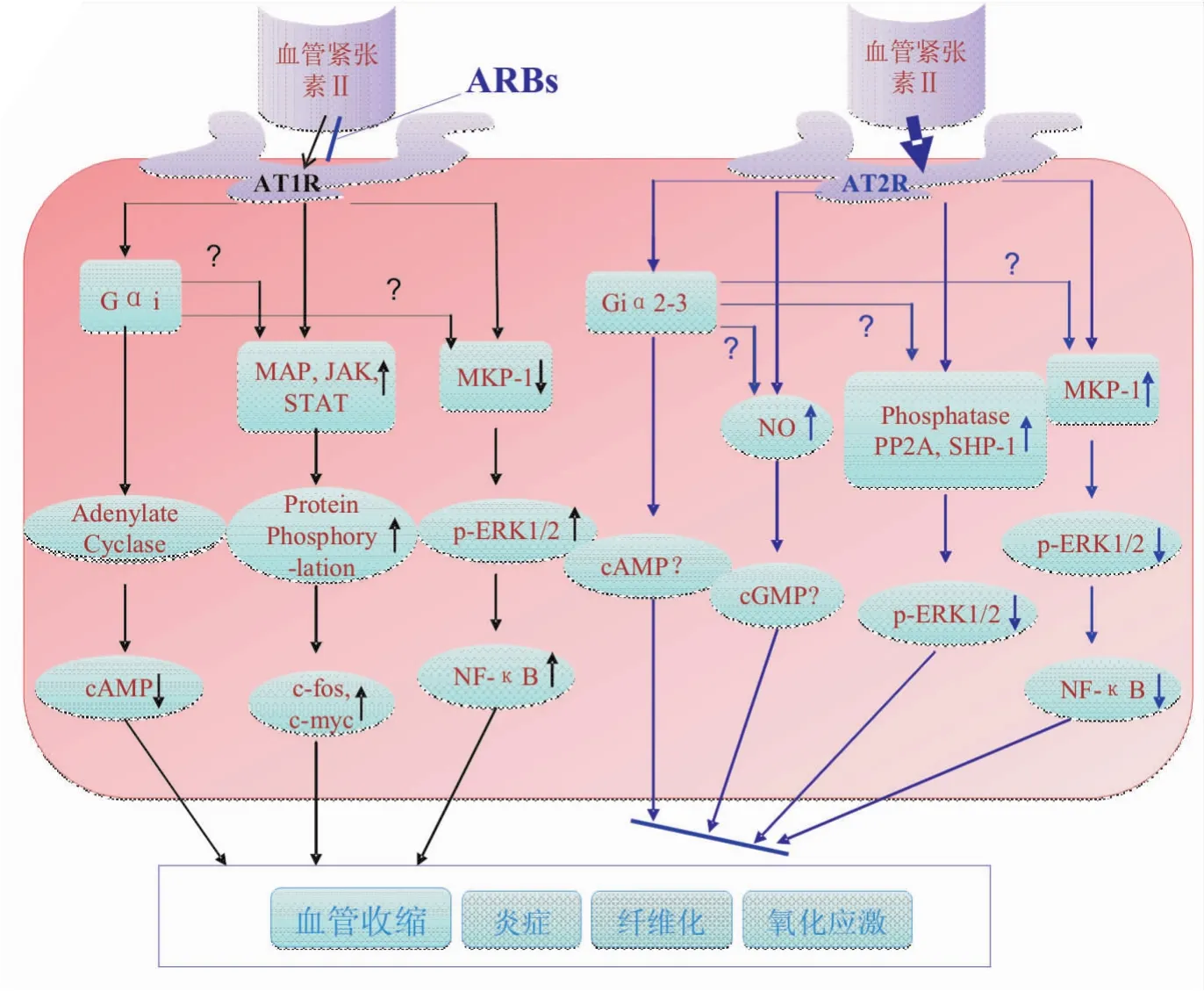
Fig 2 Possible signal transduction mechanism of AT1R and AT2R.The involved signalmoleculeswith AT1R/AT2R downstream signal transduction include Gαi/cAMP,NO/cGMP,mitogen activated protein kinase phosphatase 1(MKP-1),protein phosphatase2A(PP2A),SH-2-containing protein tyrosine phosphatase1(SHP-1),extracellular signal-regulated kinase(ERK1/2),NF-κB,mitogen activited protein(MAP)/protein tyrosine kinase(JAK)/signal transducers and activators of transcription(STAT),c-fos/c-myc,etc.
目前人们已经认识到RA患者体内长期处于慢性炎症刺激,RA患者发生高血压、动脉粥样硬化等心血管疾病与体内这种炎症环境密切相关。有流行病学研究表明,RA患者的心血管风险相较正常人要高出3.96倍,心血管疾病引起的残疾占到RA患者总致残率的35%~50%[14]。目前已经证明,血管紧张素Ⅱ和AT1R在RA患者心血管损伤的发生和发展中发挥重要作用。AIA大鼠主动脉中AT1R的蛋白和mRNA水平明显升高,且关节炎大鼠和正常大鼠在注射血管紧张素Ⅱ后,关节炎大鼠的高血压反应、血管内皮细胞损伤、血管肥大等异常相较于正常大鼠更加严重[15]。血管紧张素Ⅱ-AT1R通过刺激黏附分子的表达促进炎症免疫细胞与血管内皮细胞的相互作用,维持血管内皮的炎症微环境。AT1R阻断剂和ACEIs可有效缓解AIA大鼠和RA病人的心血管损伤,减轻血管内皮的氧化应激和炎症反应[15-16]。
3 AT2R缓解RA的炎症免疫反应
研究发现,在AT2R基因敲除小鼠上建立动脉粥样硬化、脑缺血/再灌注损伤、血管损伤重塑的疾病模型,相较于正常小鼠,AT2R的缺失会导致模型小鼠疾病的恶化。相反,AT2R转基因小鼠的心肌肥大、动脉粥样硬化等疾病表现得到了有效地缓解,提示AT2R可能在心血管病程中发挥保护性作用。利用药理学工具研究发现,AT2R激动剂CGP42112和C21具有舒张血管内皮、抑制炎症反应、修复组织损伤等心血管保护作用。一般而言,当阻断血管紧张素Ⅱ与AT1R作用时,游离的血管紧张素Ⅱ水平会随之增高,并且反馈性的与AT2R作用,激活AT2R下游信号转导途径,继而发挥AT2R的保护性作用(Fig 2),这个假设在氯沙坦治疗主动脉瘤和高血压肾病的研究中都被予以证实[17-18]。血管紧张素Ⅱ与AT2R、AT1R结合后的信号转导包括丝裂原活化的蛋白激酶磷酸酶-1(MKP-1)、磷酸化细胞外信号调节激酶(p-ERK1/2)、核因子NF-κB的变化。本课题组近期研究发现,RA患者PBMCs和AIA大鼠脾脏、滑膜组织中的AT2R表达明显增高,AIA大鼠脾脏、滑膜中AT2R表达增高与其多发性关节炎指数缓解正性相关[19]。课题组研究还发现,当关节腔注射AT2R激动剂CGP42112时,可以减轻AIA大鼠滑膜组织中炎症免疫细胞浸润,抑制滑膜细胞增殖,改善关节滑膜的病理学表现,有效缓解AIA大鼠的关节炎表现。
4 小结
RA患者体内血管紧张素Ⅱ与高表达的AT1R作用,通过刺激单核细胞趋化移行、促进T淋巴细胞活化增殖、增强Th1和Th17免疫反应、抑制关节滑膜细胞凋亡,促进RA的炎症免疫反应。RA及实验动物模型体内AT2R表达增高,激动AT2R可以缓解AIA大鼠炎症免疫反应。阻断AT1R或激动AT2R不仅可以缓解RA及其实验模型的关节滑膜炎,兼具改善RA患者体内长期炎症刺激造成的心血管损伤,降低心血管风险。因此将阻断血管紧张素Ⅱ-AT1R或者激动AT2R作为治疗RA的新靶点,特别是对患有高血压和心血管疾病的RA病人,不失为一项一举多得的治疗策略。
参考文献:
[1] Martin M F,Surrall K E,McKenna F,et al.Captopril:a new treatment for rheumatoid arthritis[J]?Lancet,1984,1(8390):1325-8.
[2] Benigni A,Cassis P,Remuzzi G.AngiotensinⅡ revisited:new roles in inflammation,immunology and aging[J].EMBO Mol Med,2010,2(7):247-57.
[3] Madhur M S,Lob H E,McCann L A,et al.Interleukin 17 promotes angiotensinⅡ-induced hypertension and vascular dysfunction[J].Hypertension,2010,55(2):500-7.
[4] Crowley SD,Vasievich M P,Ruiz P,etal.Glomerular type1 angiotensin receptors augment kidney injury and inflmmation in murine autoimmune nephritis[J].JClin Invest,2009,119(4):943-53.
[5] Stegbauer J,Lee D H,Seubert S,et al.Role of the renin-angiotensin system in autoimmune inflammation of the central nervous system[J].Proc Natl Acad Sci USA,2009,106(35):14942-7.
[6] Goto M,Fujisawa M,Yamada A,etal.Spontaneous release of angiotensin converting enzyme and interleukin 1 beta from peripheral blood monocytes from patientswith rheumatoid arthritis under a serum free condition[J].Ann Rheum Dis,1990,49(3):172-6.
[7] Walsh D A,Catravas J,Wharton J.Angiotensin converting enzyme in human synovium:increased stromal[(125)I]351A binding in rheumatoid arthritis[J].Ann Rheum Dis,2000,59(2):125-31.
[8] Pattacini L,Casali B,Boiardi L,etal.AngiotensinⅡ protects fibroblast-like synoviocytes from apoptosis via the AT1-NF-kappaB pathway[J].Rheumatology(Oxford),2007,46(8):1252-7.
[9] Dalbeth N,Edwards J,Fairchild S,etal.The non-thiol angiotensin-converting enzyme inhibitor quinapril suppresses inflammatory arthritis[J].Rheumatology(Oxford),2005,44(1):24-31.
[10]Sagawa K,Nagatani K,Komagata Y,et al.Angiotensin receptor blockers suppress antigen-specific T cell responses and ameliorate collagen-induced arthritis inmice[J].Arthritis Rheum,2005,52(6):1920-8.
[11]Perry M E,Chee M M,Ferrell W R,et al.Angiotensin receptor blockers reduce erythrocyte sedimentation rate levels in patients with rheumatoid arthritis[J].Ann Rheum Dis,2008,67(11):1646-7.
[12]Refaat R,Salama M,Abdel Meguid E,et al.Evaluation of the effect of losartan andmethotrexate combined therapy in adjuvant-induced arthritis in rats[J].Eur JPharmacol,2013,698(1-3):421-8.
[13]Price A,Lockhart JC,FerrellW R,et al.AngiotensinⅡ type 1 receptor as a novel therapeutic target in rheumatoid arthritis:in vivo analyses in rodentmodels of arthritis and ex vivo analyses in human inflammatory synovitis[J].Arthritis Rheum,2007,56(2):441-7.
[14]de Jong H J,Vandebriel R J,Saldi SR,et al.Angiotensin-converting enzyme inhibitors or angiotensinⅡreceptor blockers and the risk of developing rheumatoid arthritis in antihypertensive drug users[J].Pharmacoepidemiol Drug Saf,2012,21(8):835-43.
[15]Sakuta T,Morita Y,Satoh M,et al.Involvement of the reninangiotensin system in the development of vascular damage in a rat model of arthritis:effect of angiotensin receptor blockers[J].Arthritis Rheum,2010,62(5):1319-28.
[16]Flammer A J,Sudano I,Hermann F,et al.Angiotensin-converting enzyme inhibition improves vascular function in rheumatoid arthritis[J].Circulation,2008,117(17):2262-9.
[17]Habashi JP,Doyle JJ,Holm TM,et al.AngiotensinⅡ type 2 receptor signaling attenuates aortic aneurysm in mice through ERK antagonism[J].Science,2011,332(6027):361-5.
[18]Naito T,Ma L J,Yang H,et al.Angiotensin type 2 receptor actions contribute to angiotensin type 1 receptor blocker effects on kidney fibrosis[J].Am JPhysiol Renal Physiol,2010,298(3):F683-91.
[19]Wang D,Hu S S,Zhu J,et al.AngiotensinⅡ type 2 receptor correlateswith therapeutic effects of losartan in rats with adjuvantinduced arthritis[J].JCellMolMed,2013,17(12):1577-87.

