下调p21活化蛋白激酶2表达对人乳腺癌细胞增殖和凋亡的影响*
李 翔, 张晓艳, 赵继敏, 刘康栋, 赵明耀, 董子明
(郑州大学基础医学院病理生理学教研室,河南 郑州 450001)
p21活化蛋白激酶(p21-activated protein kinases,PAKs)是一类丝氨酸苏氨酸蛋白激酶家族,它们最早是作为Rho GTP酶Cdc42和Rac1的特异性结合物而被发现的[1]。研究表明,PAK家族在细胞生长、细胞分裂、细胞凋亡,细胞迁徙以及内分泌激素信号通路中起着重要的作用[2]。到目前为止,在哺乳类动物细胞中已经有6个PAK家族成员被确定,PAK1~3属于I类PAK家族,PAK4~6则属于II类PAK家族[3]。在PAK家族的众多成员中,PAK2的研究最为广泛,因为它不仅可以促进细胞生长,也可以引起细胞凋亡。PAK2可以通过活化Akt1和ERKs,从而促进细胞的生长[4-5];PAK2也可以在细胞凋亡信号的作用下被caspase-3、-8、-10切割并活化,产生一个活性片段PAK2-p34,这个片段进而从细胞浆转移到细胞核中,引起细胞凋亡的发生[6]。乳腺癌是女性最常见的恶性肿瘤之一。目前乳腺癌的治疗方法主要有:手术、放疗、化疗以及内分泌治疗,而在乳腺癌化疗中所面临的最大困难就是对化疗药物的耐药问题。研究表明,对化疗药物耐药的乳腺癌患者,其体内某些生长因子受体的表达高于对化疗药物敏感的患者,例如:人表皮生长因子受体2(human epidermal growth factor receptor 2, HER2)和胰岛素样生长因子1受体(insulin-like growth factor 1 receptor, IGF-1R)。这些生长因子受体的上调往往会引起其下游分子Akt、ERK、p38、PAK1等的激活或过表达,提示了这些生长因子受体以及其下游分子的过表达与修饰可能与乳腺癌患者对化疗药物的耐药有关,但是具体机制目前尚未阐明。短发卡RNA(short hairpin RNA,shRNA)是一种选择性沉默基因表达的有效工具,对此,我们构建了针对PAK2基因的shRNA表达质粒pLK0.1-sh-PAK2,下调人乳腺癌MCF-7细胞中PAK2的表达,并探讨其对MCF-7细胞增殖和凋亡的影响。
材 料 和 方 法
1 材料和主要试剂
大肠杆菌DH5α和人乳腺癌MCF-7细胞由本实验室保存;人乳腺正常上皮细胞MCF-10A和人乳腺癌SK-Br-3细胞购于ATCC;PAK2和α-actin抗体购于Santa Cruz;PAK1抗体购于Cell signaling;限制性内切酶AgeI和EcoR I购于NEB;T4 DNA连接酶购于大连TaKaRa; 去内毒素质粒抽提试剂盒和琼脂糖凝胶DNA回收试剂盒购于Tiangen;jetPEI转染试剂购于Polyplus;嘌呤霉素和Polybrene感染试剂购于Millipore;Annexin V/PI检测凋亡试剂盒购于Invitrogen;CellTiter 96 AQueous单溶液细胞增殖检测试剂盒购于Promega;DMEM培养基、BME培养基、胎牛血清和青、链霉素均购于Life Technologies。
2 方法
2.1shRNA靶序列的设计和合成 根据前期的实验结果,选取针对PAK2干扰效果最好的靶序列:5’-CCAATCACAGTTTGAAACCTT-3’,按照pLK0.1质粒的结构,设计含有AgeI和EcoR I酶切残端并能表达发卡结构的2条寡核苷酸序列:5’-CCGGCCAATCACAGTTTGAAACCTTCTCGAGAAGGTTTCAAACTGTG-ATTGGTTTTTG-3’,5’-AATTCAAAAACCAATCACAGT-TTGAAACCTTCTCGAGAAGGTTTCAAACTGTGATTG-G-3’。同时,设计1对阴性对照序列,经BLAST同源比对分析,此序列与所有人类基因编码序列无同源性。所有序列由苏州金唯智生物科技有限公司合成。
2.2pLK0.1-shRNA慢病毒表达质粒的构建 用限制性核酸内切酶AgeI和EcoR I将pLK0.1空质粒于37 ℃双酶切2 h,经0.8%琼脂糖凝胶电泳后,用琼脂糖凝胶DNA回收试剂盒回收酶切反应产物。将合成的shRNA模板单链进行退火处理形成双链,退火体系:20 μmol/L正、反义链模板各9 μL,10×Annealing Buffer 2 μL,加灭菌ddH2O至20 μL,置于95~100 ℃水浴中,自然冷却至25 ℃。将纯化后的线性载体与退火产物连接,构建重组质粒pLK0.1-shRNA-PAK2 (sh-PAK2)和阴性对照质粒pLK0.1-shRNA-mock (sh-mock)。转化感受态细菌DH5α,涂布于含氨苄青霉素的LB培养板中,37 ℃培养过夜。挑取单个克隆,在含有氨苄青霉素(100 mg/L)的LB培养基中扩大培养。提取质粒,用EcoRI和NcoI做双酶切鉴定。将酶切鉴定正确的质粒送苏州金唯智生物科技有限公司进行测序。测序引物为5’-CAAGGCTGTTAGAGAGATAATTGGA-3’。
2.3慢病毒颗粒的包装和嘌呤霉素最适浓度的筛选 HEK-293T细胞常规培养于含10%FBS的DMEM培养基中,以7×105cells/dish接种于60 mm培养皿中,37 ℃、5% CO2培养至70%~80%融合,使用jetPEI转染试剂进行sh-PAK2和sh-mock病毒颗粒的包装。包装体系:pLK0.1-sh-PAK2质粒1 μg,psPAX2质粒750 ng,pMD2.G质粒250 ng,加150 mmol/L NaCl至125 μL。转染后12~15 h,弃去含转染试剂的培养基,加入新鲜的培养基继续培养24 h,收集上清,离心,分装,-70 ℃保存。MCF-7细胞常规培养于含10%FBS的DMEM培养基中,以6×104cells/well接种于12孔板中,37 ℃、5%、CO2培养过夜。加入不同浓度的嘌呤霉素(1~10 mg/L)到MCF-7细胞培养基中,37 ℃、5% CO2继续培养,每天观察细胞状况并隔天换液。嘌呤霉素的最适浓度即培养3~5 d引起细胞死亡的最低浓度。
2.4病毒感染及稳定表达细胞株的筛选 MCF-7细胞常规培养于含10% FBS的DMEM培养基中,以1×106cells/dish接种于100 mm培养皿中,37 ℃、5% CO2培养过夜,使用Polybrene感染试剂进行sh-PAK2和sh-mock慢病毒的感染。慢病毒感染体系:含10% FBS的DMEM培养基9 mL,慢病毒颗粒1 mL,Polybrene 8 μL,加入到MCF-7细胞中。感染后24 h,换成含有最适嘌呤霉素的培养基继续培养,同时设正常培养的MCF-7细胞作为对照。当对照组细胞全部死亡,而被病毒感染过的细胞生长良好时,说明感染成功,即已得到稳定干扰PAK2的MCF-7细胞株。
2.5Western blotting免疫印迹法 裂解细胞并提取细胞总蛋白,用Bradford法检测蛋白溶液浓度。取待测样品40 μg进行SDS-PAGE,电泳后采用湿转法将凝胶中的蛋白转移至PVDF膜。经5%脱脂奶粉室温封闭1h后,加入相应的Ⅰ抗稀释液,4 ℃摇床孵育过夜。TBST缓冲液洗膜,5 min×4次,加入辣根过氧化物酶标记过的Ⅱ抗稀释液,室温孵育2 h,TBST缓冲液洗膜,5 min×4次。加入ECL进行发光反应,暗室曝光显影。使用ImageJ软件进行各蛋白条带灰度值的测定。
2.6CellTiter 96 AQueous法检测细胞体外增殖能力 取处于对数生长期的细胞,以1 000 cells/well种于96孔板中,每组设5个复孔并设不含细胞的空白对照。37 ℃、5% CO2连续培养4 d。每天于同一时点加入CellTiter 96 AQueous溶液20 μL,37 ℃继续培养1 h,使用多功能酶标仪检测492 nm波长处的吸光值(A492)并绘制生长曲线。
2.7软琼脂集落形成实验检测细胞克隆形成能力 将含有0.5%琼脂的BME培养基以3 mL/well平铺于6孔板中,待完全凝固后,取处于对数生长期的细胞,以8 000 cells/well重悬于含有0.33%琼脂的BME培养基中,平铺在已经凝固好的下层胶上面。每组设3个平行孔,37 ℃,5% CO2培养1~2周。待克隆形成后,使用显微镜观察克隆的大小并用Image-Pro Plus软件进行克隆计数。
2.8流式细胞术检测细胞凋亡 常规消化并收集各实验组细胞,用预冷的PBS洗涤2次,加入预冷的70%乙醇,4 ℃固定过夜。离心,收集细胞,用1 mL PBS洗涤细胞1次,加入100 μL 1 g/L的RNase A重悬细胞,置于37 ℃孵育30 min,再加入400 μL 50 mg/L的PI,4 ℃避光孵育10 min后上机检测。
3 统计学处理
应用SPSS 13.0统计软件进行统计学处理。数据用均数±标准差(mean±SD)表示,对计量资料,两样本均数比较采用t检验,多个样本均数比较采用单因素方差分析,以P<0.05为差异有统计学意义。
结 果
1 pLK0.1-shRNA重组质粒的鉴定
将重组质粒用EcoR I和NcoI进行双酶切鉴定。根据pLK0.1质粒的特点,双酶切后会产生5 kb和2 kb的2个片段。对酶切鉴定正确的重组质粒进一步测序,经过比对分析,4个重组质粒中均含有目的shRNA片段,说明重组质粒构建成功,见图1。
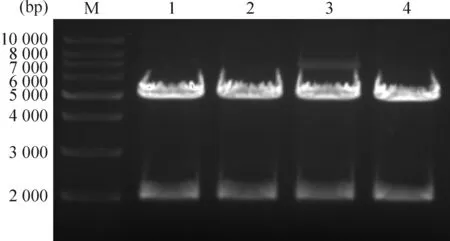
Figure 1. Double restriction endonuclease digestion of pLK0.1-sh-PAK2 (Lane 1~2) and pLK0.1-sh-mock (Lane 3~4) by EcoR I and Nco I. M: 1 kb DNA marker.
2 PAK2在人正常乳腺上皮细胞和乳腺癌细胞中的表达差异
Western blotting结果显示,乳腺癌细胞组PAK2/β-actin比值明显高于正常乳腺上皮细胞组(P<0.05),见图2。这说明PAK2在乳腺癌细胞中呈高表达状态。
3 稳定干扰PAK2的MCF-7细胞株的构建
根据上步结果,MCF-7细胞中的PAK2表达水平高于SK-Br-3细胞,所以我们选择MCF-7细胞作为稳定干扰PAK2的细胞株。结果显示,与sh-mock组相比,sh-PAK2组PAK2的蛋白表达水平明显下调,约为sh-mock组的31.3%,差异有统计学意义(P<0.01);另外,PAK1的表达没有明显改变(P<0.05),见图3。这说明设计的shRNA是针对PAK2的特异性RNA片段,对PAK1的表达没有影响。

Figure 2. The expression of PAK2 protein in breast cancer cell lines (MCF-7 and SK-Br-3) compared with a human non-tumorigenic mammary epithelial cell line (MCF-10A) detected by Western blotting. Mean±SD. n=3.**P<0.01 vs MCF-10A.
4 沉默PAK2基因对MCF-7细胞增殖的影响
在接种细胞后1~4 d,用CellTiter 96 AQueous法检测MCF-7细胞的体外增殖能力。与sh-mock组相比,sh-PAK2组从48h开始生长明显减缓,细胞倍增时间延长,差异有统计学意义(P<0.05),见图4。这说明沉默PAK2基因可明显抑制MCF-7细胞的增殖。
5 沉默PAK2基因对MCF-7细胞克隆形成能力的影响
结果显示,与sh-mock组相比,sh-PAK2细胞的集落形成数目及集落形成大小均明显减少,差异有统计学意义(P<0.01),见图5。这表明下调PAK2的表达可有效抑制MCF-7细胞的克隆形成能力。
6 沉默PAK2基因对MCF-7细胞凋亡的影响
我们用十字孢碱(staurosporine)来诱导MCF-7细胞的凋亡。流式细胞术结果显示,凋亡的发生呈浓度依赖性,而且与sh-mock组相比,sh-PAK2组凋亡的发生明显增多,差异有统计学意义(P<0.05),见图6。这说明下调PAK2的表达可以促进MCF-7细胞凋亡的发生。
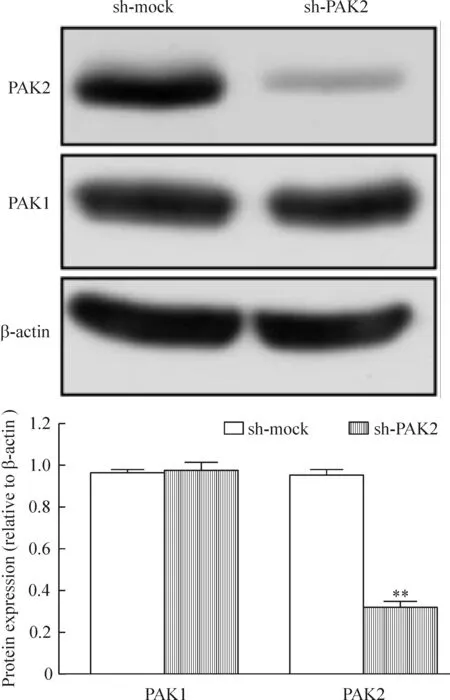
Figure 3. The expression of PAK2 protein in MCF-7 cells treated with shRNA targeting PAK2 (sh-PAK2) detected by Western blotting. Mean±SD. n=3.**P<0.01 vs sh-mock group.
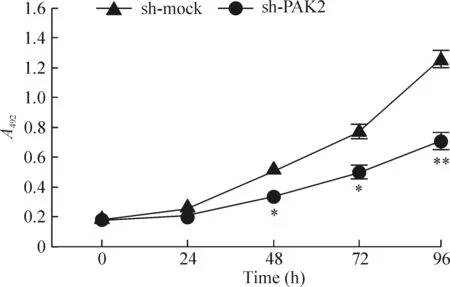
Figure 4. The effect of PAK2 knockdown on MCF-7 cell prolife-ration. Mean±SD. n=3. *P<0.05. **P<0.01 vs sh-mock group.
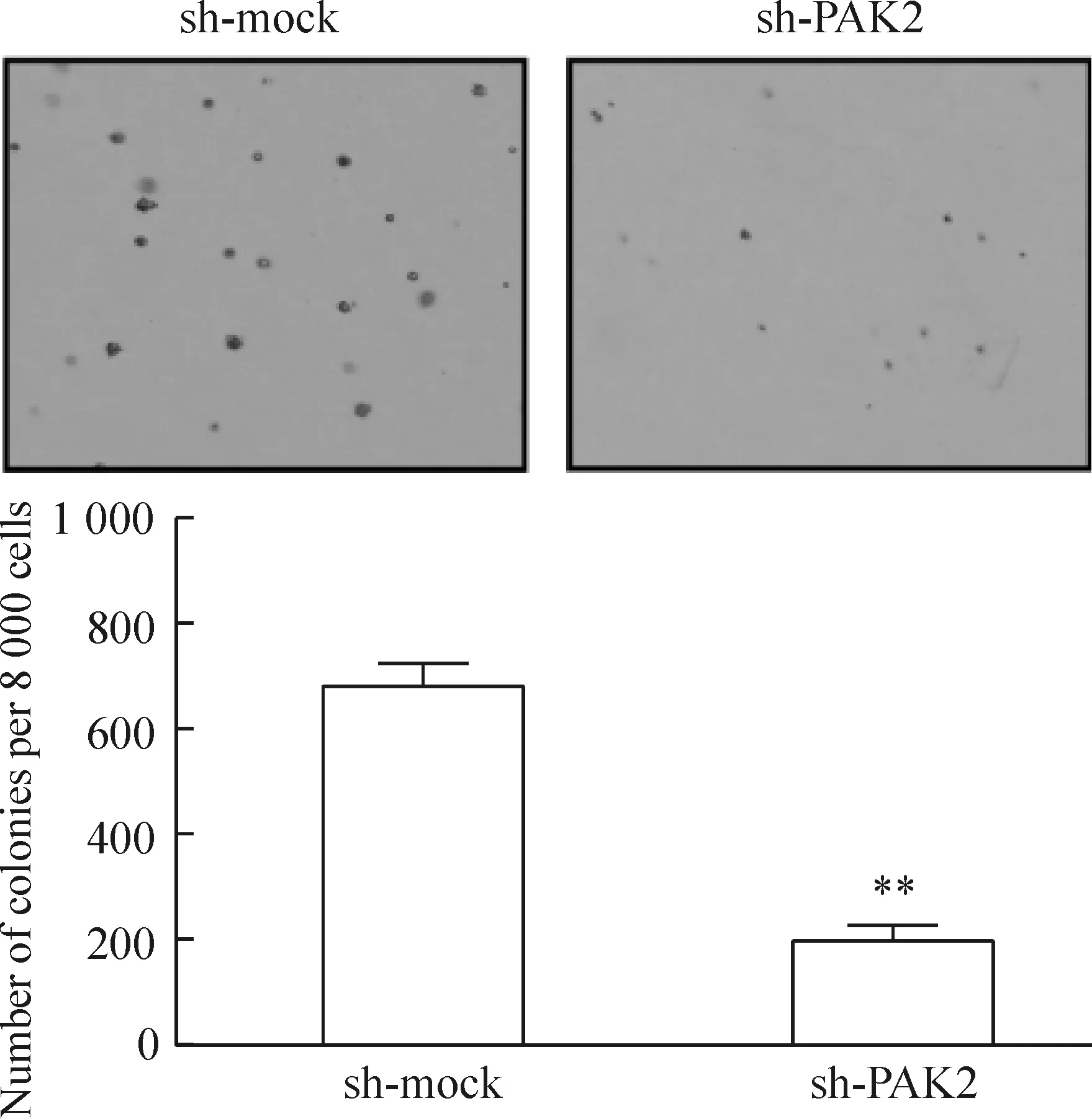
Figure 5. The effect of PAK2 knockdown on anchorage-indepen-dent growth of MCF-7 cells (×300). Mean±SD. n=3. **P<0.01 vs sh-mock group.
讨 论
Rho蛋白是Ras超家族中最早被克隆出来的蛋白家族,它们是一组相对分子质量在20~25 kD的GTP结合蛋白,具有GTP酶活性,因此,习惯被称为Rho GTP酶[7]。Rho GTP酶在细胞骨架重组调控方面起着重要的作用,参与了对正常细胞增殖、分化、凋亡的调节,并与肿瘤的发生和转移密切相关[8]。
PAKs是Rho GTP 酶家族的重要效应物。PAKs是在上世纪90年代中期首先在大鼠脑的胞质溶胶中被人们发现的[1]。通过筛选Rho GTP 酶的结合蛋白,人们发现了一组能特异性地结合Rac或 Cdc42的靶分子,后来被命名为PAK1 (α-PAK)、PAK3 (β-PAK)和 PAK2 (γ-PAK)。PAK1~3之间存在着严格的序列同源性, 它们均含有具有调节、黏附功能的N末端调节亚基, 和一个具有催化活性、进化上高度保守的C末端催化亚基。虽然PAK1~3在结构上极为相似,但却有着不同的组织分布:PAK1在脑、肌肉和脾脏中高表达,PAK3仅仅在脑组织中有所表达,而PAK2则在各组织器官中广泛存在。
PAK2在PAKs家族中的作用最为独特,因为它既可以促进细胞生长,也可以引起细胞凋亡。Men-ges等[5]的研究发现抑制PAK2的活性,可以引起Akt1和ERK1/2活性的下降,从而导致细胞生长的延缓。Jakobi等[4]发现活化的PAK2可以增加促凋亡蛋白Bad丝氨酸112和136位点的磷酸化,使其活性下降,从而抑制了细胞凋亡的发生,并且在肿瘤坏死因子α(tumor necrosis factor α, TNF-α)作用的早期,PAK2可以通过增强Akt、ERK和p38的活化来保护细胞免于死亡。然而,在细胞凋亡发生相对较晚的阶段, PAK2将作为caspases(主要是caspase-3)的底物出现,被caspase-3切割在Asp212 位点,形成一个28 kD的N端片段和一个34 kD的C端片段(PAK2-p34)[9]。PAK2-p34进一步转移到细胞核中,引起细胞凋亡的发生。由于Asp212位点在PAK3中是不存在的,在PAK1中又不被暴露,所以这个特性是PAK2 所特有的,而且这个过程的发生不仅可以促进PAK2的活化,而且为凋亡的发生提供了必要的形态学和生化学的改变。
近年来研究发现,PAKs在许多人类肿瘤中高表达,包括:乳腺癌、宫颈癌、胰腺癌、结肠癌和甲状腺癌[10]。其中,PAK6在非小细胞肺癌组织里高表达,并且通过细胞骨架的重组促进肺癌细胞的侵袭和转移[11]。我们的前期研究结果发现,PAK2 可以通过磷酸化c-Jun 的5个苏氨酸位点(苏氨酸2、8、89、93和286),促进EGF 诱导的小鼠JB6 C141细胞的增殖和转化[12]。Marlin等[13]的研究证实,PAK2 可以通过抑制caspase-3 的活性以及自身的被切割,使PAK2 活性较低的Hs578T 细胞相比较PAK2 表达较高的MDA-MB-468 细胞,对化疗药物诱导的细胞凋亡更加敏感,提示相比较诱导细胞凋亡的作用,PAK2更倾向于具有“癌基因”的效应。
本研究首先观察了PAK2在乳腺癌细胞中的表达情况,用正常乳腺上皮细胞MCF-10A作为对照,结果发现PAK2在乳腺癌细胞(尤其是MCF-7细胞)中高表达。在此基础上,利用shRNA技术干扰PAK2在MCF-7细胞里的表达,Western blotting结果显示PAK2的表达水平明显降低(P<0.01),证明合成的shRNA能有效沉默PAK2基因,下调PAK2的表达。由于PAK1和PAK2有着高度一致的序列同源性,Western blotting同时检测了PAK1的表达,结果显示,PAK1的表达水平与阴性对照组相比没有显著差异(P>0.05),说明合成的shRNA只能特异性地沉默PAK2基因,对PAK1的表达没有影响。接下来,采用CellTiter 96 AQueous法和软琼脂集落形成实验检测MCF-7细胞体外增殖能力的改变,结果显示sh-PAK2组的细胞增殖被显著抑制,生长速度明显减缓,与此同时,克隆形成的大小和数目均明显减少。十字孢碱是一种从链霉菌属分离出来的生物碱,对肿瘤细胞的生长具有很强的抑制作用。我们用不同浓度的十字孢碱来诱导MCF-7细胞的凋亡,结果显示,下调PAK2的表达能够引起明显的MCF-7细胞凋亡的增加,并且这种凋亡的增加呈浓度依赖性。综上所述,本研究提示PAK2作为正调控因子介导了MCF-7细胞的增殖和转化,干扰PAK2的表达可以增强MCF-7细胞对化疗药物的敏感性并促进细胞凋亡的发生。本研究表明PAK2有望成为乳腺癌治疗的新靶标,并为PAK2抑制剂的研发提供一定的实验依据。

Figure 6. The effect of PAK2 knockdown on apoptosis of MCF-7 cells detected by flow cytometry. Mean±SD. n=3.*P<0.05, **P<0.01 vs sh-PAK2 group.
[参 考 文 献]
[1] Manser E, Leung T, Salihuddin H, et al. A brain serine/threonine protein kinase activated by Cdc42 and Rac1 [J]. Nature, 1994, 367(6458):40-46.
[2] Ye DZ, Field J. PAK signaling in cancer [J]. Cell Logist, 2012, 2(2):105-116.
[3] Hofmann C, Shepelev M, Chernoff J. The genetics of Pak [J]. J Cell Sci, 2004, 117(Pt 19):4343-4354.
[4] Jakobi R, Moertl E, Koeppel MA. p21-activated protein kinase gamma-PAK suppresses programmed cell death of BALB3T3 fibroblasts [J]. J Biol Chem, 2001, 276(20):16624-16634.
[5] Menges CW, Sementino E, Talarchek J, et al. Group I p21-activated kinases (PAKs) promote tumor cell prolife-ration and survival through the AKT1 and Raf-MAPK pathways [J]. Mol Cancer Res, 2012, 10(9):1178-1188.
[6] Jakobi R, McCarthy CC, Koeppel MA, et al. Caspase-activated PAK-2 is regulated by subcellular targeting and proteasomal degradation [J]. J Biol Chem, 2003, 278(40):38675-38685.
[7] Wennerberg K, Rossman KL, Der CJ. The Ras superfamily at a glance [J]. J Cell Sci, 2005, 118(Pt 5):843-846.
[8] Rossman KL, Der CJ, Sondek J. GEF means go: turning on RHO GTPases with guanine nucleotide-exchange factors [J]. Nat Rev Mol Cell Biol, 2005, 6(2):167-180.
[9] Rudel T, Bokoch GM. Membrane and morphological changes in apoptotic cells regulated by caspase-mediated activation of PAK2 [J]. Science, 1997, 276(5318):1571-1574.
[10] Kumar R, Gururaj AE, Barnes CJ. p21-activated kinases in cancer [J]. Nat Rev Cancer, 2006, 6(6):459-471.
[11] 蔡松旺, 谢迭来, 翁毅敏, 等. p21活化激酶6对人非小细胞肺癌A549细胞侵袭及迁移能力的影响[J]. 中国病理生理杂志, 2013, 29(9):1637-1640.
[12] Li T, Zhang J, Zhu F, et al. P21-activated protein kinase (PAK2)-mediated c-Jun phosphorylation at 5 threonine sites promotes cell transformation [J]. Carcinogenesis, 2011, 32(5):659-666.
[13] Marlin JW, Eaton A, Montano GT, et al. Elevated p21-activated kinase 2 activity results in anchorage-independent growth and resistance to anticancer drug-induced cell death [J]. Neoplasia, 2009, 11(3):286-297.

