姜黄素对阿尔茨海默病大鼠学习记忆及HMGB1和JNK表达的影响*
叶莉莎, 韩 园, 刘启星, 张占琴, 梅虹霞, 曹 红, 连庆泉, 李 军
(温州医科大学附属第二医院麻醉科,浙江 温州 325027)
阿尔茨海默病(Alzheimer disease,AD)又称老年性痴呆,是以进行性痴呆为主要临床表现的大脑变性疾病。海马和学习记忆密切相关,AD发病时海马往往最先受累。c-Jun氨基末端激酶(c-Jun N-terminal kinase, JNK)作为一应激活化蛋白激酶,各种胞外刺激后其在AD的脑内表达增强。高迁移率族框蛋白1(high mobility group box protien 1,HMGBl)是一种核因子和DNA结合蛋白,在炎症和非炎症性刺激时便大量合成和释放到胞外,加速脑疾病的进程[1-2]。已发现AD患者脑内HMGB1表达升高,可加重认知功能障碍及记忆力减退[3]。姜黄素作为一种多元酚,具有抗氧化、抗炎和亲脂活性,已被用于AD和其它慢性疾病的治疗。本实验旨在探讨姜黄素对AD大鼠学习记忆能力、海马HMGB1、JNK表达的影响,为姜黄素的临床应用提供实验基础。
材 料 和 方 法
1 材料
1.1动物与分组 清洁级雄性Sprague-Dawley(SD)大鼠36只,体重250~270 g,由温州医学院实验动物中心提供。实验动物于实验开始前1周,饲养于昼夜节律 12/12 h(8Am~8Pm)通风良好的动物房,室温控制在(22±2)℃,相对湿度50%~70%。采用随机数字表法将其随机分为空白对照组(A组)、模型组(B组)、姜黄素治疗组(C组)和玉米油溶剂对照组(D组),每组9只。
1.2试剂和仪器 鹅膏蕈氨酸(ibotenic acid,IBO)、姜黄素和玉米油(Sigma);兔抗SAPK/JNK单克隆抗体(Cell Signaling Technology);兔抗HMGB1 单克隆抗体(Abcam);兔抗GAPDH抗体和兔超敏二步法检测试剂盒(北京中杉金桥生物技术有限公司)。大鼠标准型脑立体定位仪(深圳瑞沃德公司),Morris 水迷宫分析系统(北京硕林苑科技公司)。
2 方法
2.1AD模型制备及分组处理 大鼠腹腔注射5%水合氯醛7 mL/kg麻醉,头部依靠两耳杆和切牙钩3点固定,根据大脑立体定位图谱,计算出基底核前后向(AP)、左右侧(L)、垂直轴(V)3个方向的坐标(前囟后1.0 mm、中线旁2.6 mm、硬脊膜下7.8 mm)[4]。用2 mL注射器的针头在靶点上钻孔,微量注射器对准靶点,缓慢进针至颅骨下7.8 mm处注入IBO 8 μg,注射时间持续5 min并留针5 min,缓慢退针。术后缝合皮肤并肌注青霉素2×105U预防感染,置于保温毯至清醒。造模24 h后,A组和B组大鼠不给予任何药物,C组大鼠连续腹腔注射100 mg/kg 姜黄素6 d,D组大鼠连续腹腔注射4 mL/kg玉米油6 d。各组大鼠常规饲养。
2.2行为学测试 术后第7天开始为期7 d的Morris水迷宫定位航行实验。实验第1天让大鼠熟悉水迷宫环境,将其放入撤除平台的池中游泳60 s。从第2天进行正式实验,以4个象限轮流作为入水点,将大鼠头部背向平台贴壁入水,记录找到平台的时间,即逃避潜伏期,设定120 s为最长逃避潜伏期。如果大鼠首次未搜索到平台,将其引至平台上停留30 s,引导学习记忆,这时潜伏期记为120 s,之后开始下一象限实验。若首次找到平台,亦放置30 s。记录4次潜伏期的均数即平均逃避潜伏期(average escape latency,AEL)进行统计分析以判断大鼠的学习记忆能力。
2.3免疫组化检测 行为学实验测试结束后,开胸经左心室插管至主动脉,分别灌注4 ℃生理盐水和4%多聚甲醛各200 mL。断头取海马并固定于4%多聚甲醛中,石蜡包埋。切片,片厚4 μm。切片置二甲苯、乙醇梯度脱蜡, PBS 冲洗2次,每次3 min,0.01 mol /L 枸橼酸盐缓冲液(pH 6.0) 中高压修复,自然冷却至室温,PBS 冲洗2次,每次3 min;3% H2O2室温10 min;兔抗HMGB1抗体(1∶750)4 ℃孵育过夜,加聚合物增强剂,室温孵育20 min;加酶标抗兔聚合物,室温孵育20 min; DAB 显色,苏木精复染,封片。取每只大鼠海马区脑切片6张(部位相同),观察光镜(×400)下海马组织 CA1、CA3 区图像,利用Image-Pro Plus 6.0图像分析软件对CA1和 CA3 区HMGB1行半定量分析,计算每组36张切片上HMGB1的积分吸光度值(integrated value,IA)。
2.4Western blotting检测 取新鲜海马组织,-70 ℃保存。行免疫印迹检测时,从低温冰箱中取出海马组织。按15 μL上样总体积30 μg蛋白配置,加上样缓冲液后变性。上样后,样品在浓缩胶内的电压为60 V、分离胶为100 V进行电泳,溴酚蓝接近凝胶底部时停止电泳。300 mA电流湿转1 h。5%脱脂奶粉常温封闭1.5 h。兔抗HMGB1抗体稀释度为1∶10 000,兔抗SAPK/JNK抗体稀释度为1∶1 000,兔抗GAPDH抗体稀释度为1∶2 000,将目的蛋白放置在相应的抗体中4 ℃过夜。辣根过氧化酶标记的山羊抗兔II抗(HMGB1对应的II抗稀释为1∶2 000,JNK和GAPDH对应的II抗稀释为1∶10 000)室温孵育1 h。ECL显影,采用AlphaEase FC凝胶图像分析软件进行曝光和半定量分析,将目的蛋白/GAPDH的灰度值作为目的蛋白表达的相对强度。
3 统计学处理
采用SPSS 19.0统计软件分析。数据用均数±标准差(mean±SD)表示,水迷宫潜伏期数据采用重复测量方差分析,免疫组化和Western blotting数据进行正态性检验,多组样本均数比较行方差齐性检验,组间比较采用单因素方差分析,方差齐者采用LSD法,方差不齐者采用Tamhane’s T2检验。以P<0.05为差异有统计学意义。
结 果
1 行为学测试
定位航行实验中,与A组大鼠相比,B和D组大鼠各时点AEL明显延长(P<0.05),C组大鼠第5天和第6天 AEL明显短于B组(P<0.05),见表1。

表1 各组大鼠Morris水迷宫实验AEL的比较
2 免疫组化
A、C组大鼠海马CA1区及CA3区HMGB1阳性细胞较少,B、D组HMGB1阳性表达增多,且大多数位于胞浆及胞外。IA比较发现,B组和D组CA1区及CA3区HMGB1释放量明显多于A组(P<0.05),而2组间比较差异无统计学意义(P>0.05);C组CA1区及CA3区HMGB1释放量与A组比较差异无统计学意义(P>0.05),但均明显低于B组和D组(P<0.05),见图1、2和表2。

Figure 1. Expression of HMGB1 in hippocampal CA1 region in each group(immunohistochemical staining, ×400).A: blank control group; B: model group; C: curcumin treatment group; D: solvent control group.
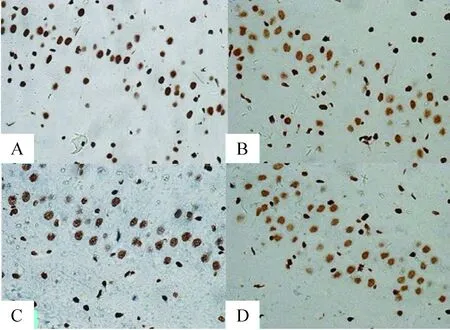
Figure 2. Expression of HMGB1 in hippocampal CA3 region in each group(immunohistochemical staining, ×400).A: blank control group; B: model group; C: curcumin treatment group; D: solvent control group.

表2 4组大鼠海马各区HMGB1积分吸光度的比较
3 Western blotting
4组大鼠海马HMGB1表达水平差异无统计学意义(P>0.05),但B组和D组JNK表达水平明显高于A组,C组JNK表达水平与A组相近,均明显低于B组和D组(P<0.05),见图3。

Figure 3. Expression of HMGB1 and JNK proteins in each group.A: blank control group; B: model group; C: curcumin treatment group; D: solvent control group. Mean±SD. n=3. *P<0.05 vs group A;#P<0.05 vs group B.
讨 论
AD主要表现为认知功能障碍和记忆损害,因此实验中均以记忆功能下降作为AD动物模型建立的标准,以记忆能力改善作为判断药物有效性的条件之一。基底前脑胆碱能神经元、海马和大脑皮质为胆碱酯酶传递和学习记忆能力的主要位点,将兴奋性氨基酸IBO注入 Meynert基底核,通过谷氨酸受体特异激动胆碱能神经元引起神经元损伤,信号通路随之调节异常,学习记忆状况变差[5]。
流行病学调查显示印度AD患者较美国低4~5倍[6],推测原因与印度人常食用含有姜黄素成分的物质(如咖喱)有关。研究表明,姜黄素对炎症相关性神经退行性疾病具有保护作用[7]。本实验采用腹腔注射姜黄素对AD大鼠进行干预,发现姜黄素能够改善AD大鼠的学习记忆能力,但其防治AD的机制尚不清楚。本研究之所以选择Morris 水迷宫测试作为行为学检测的方法是因为研究发现它比其它设备(T迷宫、八臂迷宫等)的设计更为合理[8]。
HMGB1是一种核因子和DNA结合蛋白,当体内内环境处于稳态的状态下,以不同的水平存在于大多数细胞核,脑内主要集中于大脑皮质、海马、尾状核等处,表达于神经元和星形胶质细胞,起到稳定核小体、参与DNA重组和修复、调节基因转录和细胞分化等作用[9-10],但当炎症和非炎症刺激时,HMGB1便大量合成和释放到胞外,作为一重要的晚期炎症因子而加速疾病的进程[3]。HMGB1 可维持和延长炎症, 还是决定细胞选择凋亡或坏死的一个关键信号[11]。尽管目前机制尚不是十分明确,但衰老绝对是包括AD在内的许多神经退行性病变的风险因素。近来发现HMGB1在AD发病中起到了促进作用,随着年龄增加,HMGB1在大脑不同区域的表达水平有所改变,神经元中 HMGB1的胞外释放增加,且此时神经元中 DNA双链断裂明显增加[12]。本研究组前期研究发现姜黄素能抑制全脑缺血再灌注大鼠海马HMGB1的合成与释放,减轻再灌注损伤而起到脑保护作用[13]。本研究试图进一步探索姜黄素能否通过抑制 HMGB1的表达而对 AD起到有益作用,评估 HMGB1在 IBO诱导AD大鼠中的作用,结果发现AD模型组大鼠 CA1和 CA3区海马神经元锥体细胞大量减少,大量 HMGB1释放到胞浆及胞外,而 姜黄素C组大鼠胞浆、胞外释放减少,证实姜黄素可以抑制HMGB1胞浆、胞外释放的作用。
JNK为保守的苏氨酸、丝氨酸蛋白激酶,作为重要的信号转导分子参与细胞的适应、增殖和老化;JNK 通路的激活可增加大鼠脑缺血再灌注后海马神经元caspase-3 的表达,促进海马神经元凋亡[14]。若抑制JNK的表达,可减少凋亡发生,改善大鼠的学习记忆能力[15]。本实验 A和 C组大鼠海马 JNK表达减少,AEL缩短,学习记忆能力增强;而B和D组大鼠JNK表达增高,AEL则明显延长,学习记忆能力能力得到毁损。 姜黄素可抑制JNK的表达,说明AD的发病可能和JNK通路有关。姜黄素能够减少 HMGB1的胞浆、胞外释放,然而海马区 HMGB1的蛋白含量检测并未明显变化,提示AD大鼠大脑损伤主要和胞浆、胞外释放的 HMGB1有关。
总之,姜黄素能够改善AD大鼠的学习记忆能力,其机制可能与抑制HMGB1的胞浆、胞外释放及JNK的表达下调有关。
[参 考 文 献]
[1] Candolfi M, Yagiz K, Foulad D, et al. Release of HMGB1 in response to pro-apoptotic glioma killing strategies: efficacy and neurotoxicity [J]. Clin Cancer Res, 2009,15(13):4401-4414.
[2] Gao HM, Zhou H, Zhang F, et al. HMGB1 acts on microglia Mac1 to mediate chronic neuroinflammation that drives progressive neurodegeneration [J]. J Neurosci,2011,31(3): 1081-1092.
[3] Mazarati A, Maroso M, Iori V,et al. High-mobility group box-1 impairs memory in mice through both toll-like receptor 4 and receptor for advanced glycation end products [J]. Exp Neurol, 2011,232(2):143-148.
[4] Ahmed MM, Hoshino H, Chikuma T, et al. Effect of memantine on the levels of glial cells, neuropeptides, and peptide-degrading enzymes in rat brain regions of ibotenic acid-treated Alzheimer’s disease model [J]. Neuroscience,2004,126(3):639-649.
[5] Csernansk JG, Bardgett ME, Sheline YI, et al. CSF excitatory amino acids and severity of illness in Alzheimer’s disease [J]. Neurology ,1996,46(6):1715-1720.
[6] Chandra V, Pandav R, Dodge HH, et al. Incidence of Alzheimer’s disease in a rural community in India: the Indo-US study [J]. Neurology, 2001,57(6):985-989.
[7] 杨丽娟,董 军,陆大祥,等. 姜黄素对LPS激活小胶质细胞条件培养基诱导损伤的海马神经元保护作用及机制[J]. 中国病理生理杂志,2010,26(4):742-747.
[8] D’Hooge R, De Deyn PP. Applications of the Morris water maze in the study of learning and memory [J]. Brain Res Rev, 2001,36(1):60-90.
[9] Lange SS, Vasquez KM. HMGB1:the jack-of-all-trades protein is a master DNA repair mechanic [J]. Mol Carcinog, 2009,48(7):571-580.
[10] Liu Y, Prasad R, Wilson SH. HMGB1: roles in base excision repair and related function [J]. Biochim Biophys Acta, 2010, 1799(1-2):119-130.
[11] 刘旺华,李 花,肖献忠 .高迁移率族蛋白B-1与炎症关系的研究进展[J]. 中国病理生理杂志,2008,24(8):1656-1660.
[12] Enokido Y, Yoshitake A, Ito H, et al. Age-dependent change of HMGB1 and DNA double-strand break accumulation in mouse brain[J]. Biochem Biophys Res Commun, 2008,376(1):128-133.
[13] 黄 晟,王 斌,张占琴,等. 姜黄素对全脑缺血再灌注大鼠海马高迁移率族蛋白1表达及凋亡的影响 [J]. 中华医学杂志,2011,91(19):1340-1343.
[14] 张 霞,钱 涛,高维娟,等. JNK通路促进大鼠脑缺血再灌注海马神经元凋亡[J]. 中国病理生理杂志,2012,28(8):1431-1435.
[15] Ramin M, Azizi P, Motamedi F, et al. Inhibition of JNK phosphorylation reverses memory deficit induced by β-amyloid (1-42) associated with decrease of apoptotic factors [J]. Behav Brain Res,2011,217(2): 424-431.

