过度内质网应激在慢性环孢素A肾毒性细胞凋亡中的作用机制*
全文淑, 金英顺, 金吉哲, 朴尚国, 崔镇花, 金海峰, 郑海兰, 李锦姬, 姜玉姬, 金 华, 李 灿
(延边大学附属医院肾脏内科,吉林 延吉 133000)
长期服用免疫抑制剂环孢素A(cyclosporine A, CsA)可导致慢性CsA肾毒性, 其病理特点为肾小管间质炎症和纤维化。慢性CsA肾毒性的发病机制还不十分清楚,但与炎性趋化因子[1]、转化生长因子β1[2]、肾素-血管紧张素系统 (renin-angiotensin system, RAS)[3]、细胞凋亡[4]等有关。其中,细胞凋亡扮演着重要的角色,因为肾小管上皮细胞凋亡使肾实质细胞大量缺失,是纤维化形成的根本所在。临床和动物实验证实,CsA可激活凋亡前基因引起肾实质细胞凋亡,利用TUNEL技术可以观察到凋亡的细胞小体。
内质网应激(endoplasmic reticulum stress, ERS)是真核细胞的一种保护性应激反应,通过ERS细胞降低胞内未折叠蛋白的浓度,阻碍未折叠蛋白发生凝集。然而过度的ERS可启动细胞凋亡,是一条新的不同于经典细胞凋亡的信号转导通路,这一信号转导通路包括非折叠蛋白反应和钙离子起始信号等机制。ERS介导的细胞凋亡与定位于内质网的半胱氨酸天冬氨酸蛋白酶 12 (caspase-12)、ERS标志分子免疫球蛋白结合蛋白(immunoglobulin-binding protein,BiP)和ERS相关促凋亡分子生长阻滞及DNA损伤诱导蛋白153(growth arrest and DNA damage-inducible protein 153, GADD153)的激活有关[5]。大量研究表明,过度ERS诱导的细胞凋亡参与了很多肾脏疾病的发生发展。本研究以慢性CsA肾毒性大鼠为模型, 观察过度ERS在慢性CsA肾毒性细胞凋亡中的作用机制。
材 料 和 方 法
1 材料
雄性Sprague-Dawley 大鼠(Charles River Technology)32只, 体重200~220 g,喂饲低盐饲料(0.05% 钠盐,Teklad Premier), 随机分为2组:对照组 (vehicle,VH;n=16):皮下注射橄榄油 (1 mL·kg-1·d-1, Sigma);毒性组 (CsA,n=16): 皮下注射 CsA (15 mg·kg-1·d-1, Novartis Pharma)。2组大鼠注射1周或4周后分别处死, 留取肾组织标本。
2 肾脏病理
肾脏病理及其损伤程度判定:肾组织由过碘酸-赖氨酸-多聚甲醛液固定, 石蜡包埋后切片(厚4 μm)。脱蜡后行三色(Masson trichrome) 染色,观察肾小管间质纤维化。肾小管间质纤维化程度利用数字化显微镜分析仪(TDI Scope EyeTMVersion 3.0 for Windows,Olympus),在100倍显微镜下,每张切片上至少观察非重叠20个不同区域,获取图像,利用 Polygon Program定量计算肾皮质受损部位的百分比(%/0.5 mm2)。由2个观察者对每个样本随机进行盲法评分,取平均值。
3 免疫组织化学染色
石蜡包埋切片置二甲苯脱蜡和梯度乙醇中脱水, 室温下(37 ℃) 0.3%过氧化氢/甲醛30 min处理后, PBS液洗3次。置微波炉中加热行波炉抗原修复(98 ℃ 5 min),PBS液洗3次。滴加非免疫性血清封闭液, 室温下进行20 min。PBS液洗3次,在4 ℃下滴加BipⅠ抗 (Santa Cruz Biotechnology Inc.)孵育12~16 h。PBS液洗3次后滴加Ⅱ抗, 室温孵育2 h。以DAB为底物显色, 呈棕黄色为止(视具体情况调节时间)。自来水流水洗涤,复染苏木素,常规树脂封片。
4 免疫印迹法
提取的肾组织用蛋白质溶解缓冲液[10 mmol/L Tris-HCl(pH 7.6)、150 mmol/L NaCl、1%脱氧胆酸钠、1% Triton X-100、0.1% 十二烷基硫酸钠、1% 抑肽酶、2 mmol/L Na3VO4、1 mg/L leupeptin和1 mmol/L 苯甲基磺酰氟(phenylmethanesulfonyl fluoride,PMSF)]制成匀浆,4 ℃下离心(1 500 r/min) 后, 取上清液测定蛋白浓度 (Bio-Rad); 20 μg 标本在十二烷基磺酸钠-聚丙烯酰胺凝胶电泳; 电转膜 (90 V) 2 h后, 4 ℃下 置BiP抗体于非脂牛乳中以1∶1 000 浓度孵育12~16 h; 室温下缓冲液液洗3次,加辣根过氧化物酶标记的驴抗兔IgG (Amersham) 1 h; 室温下缓冲液液洗3次,增强发光 (ECLTM, Amersham) 和曝光。磷酸化的真核细胞翻译起始因子2α(euka-ryotic initiation factor 2α,eIF2α)、GADD153、caspase-12和caspase-3的免疫印迹步骤与BiP类似。以β-actin为内参照进行条带分析。
5 统计学处理
数据以均数±标准差(mean±SD)表示,多组间比较采用SPSS 12.0 软件进行单因素方差分析 (One-way ANOVA),Bonferroni进行校正。以P<0.05为差异有统计学意义。
结 果
1 慢性CsA肾毒性肾脏病理变化
CsA注射1周观察不到明显的肾脏病理改变,而CsA注射4周观察到肾小管间质带状纤维化和大量TUNEL阳性细胞,见图1。
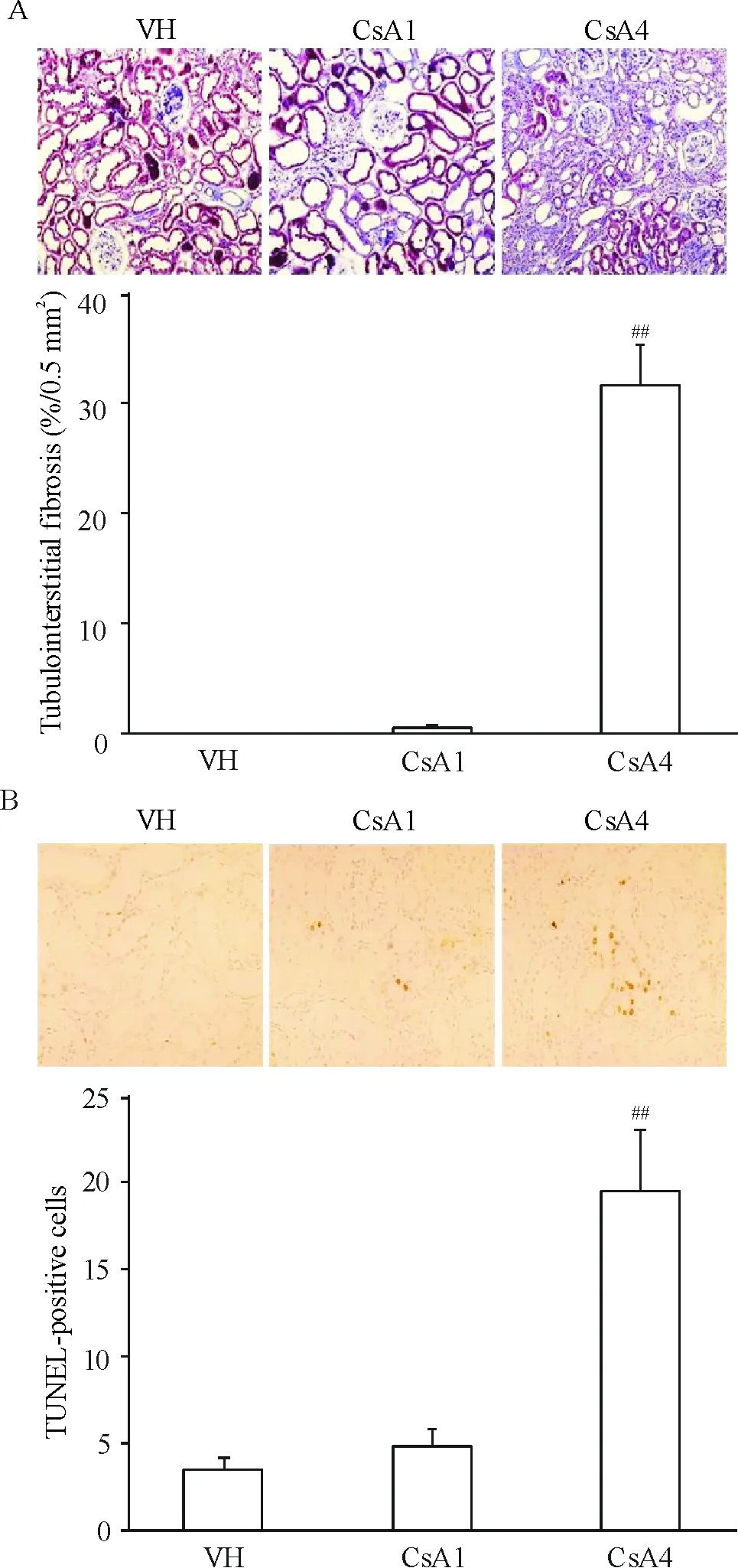
Figure 1. Trichrome staining (A) and TUNEL assay (B) of the renal tissues (×100). VH: vehicle group; CsA1: CsA treatment for 1 week; CsA4: CsA treatment for 4 weeks. Mean±SD. n=8.##P<0.01 vs VH.
2 内质网应激分子伴侣BiP蛋白的表达
结果显示,对照组观察到BiP蛋白在肾小管上皮细胞的表达;CsA 注射1周后其表达显著增加,尤其是在肾小管间质纤维化区域;CsA 注射4周后其表达下降,见图2A。免疫印迹进一步证实BiP蛋白表达与免疫组化一致的趋势,见图2B。
3 eIF2α蛋白的表达
结果显示,与对照组相比,CsA组eIF2α蛋白的表达明显增加,呈时间依赖性 [1周: (135±18)%vs(105±8)%; 4周: (445±35)%vs(135±18)%,P<0.01],见图3。
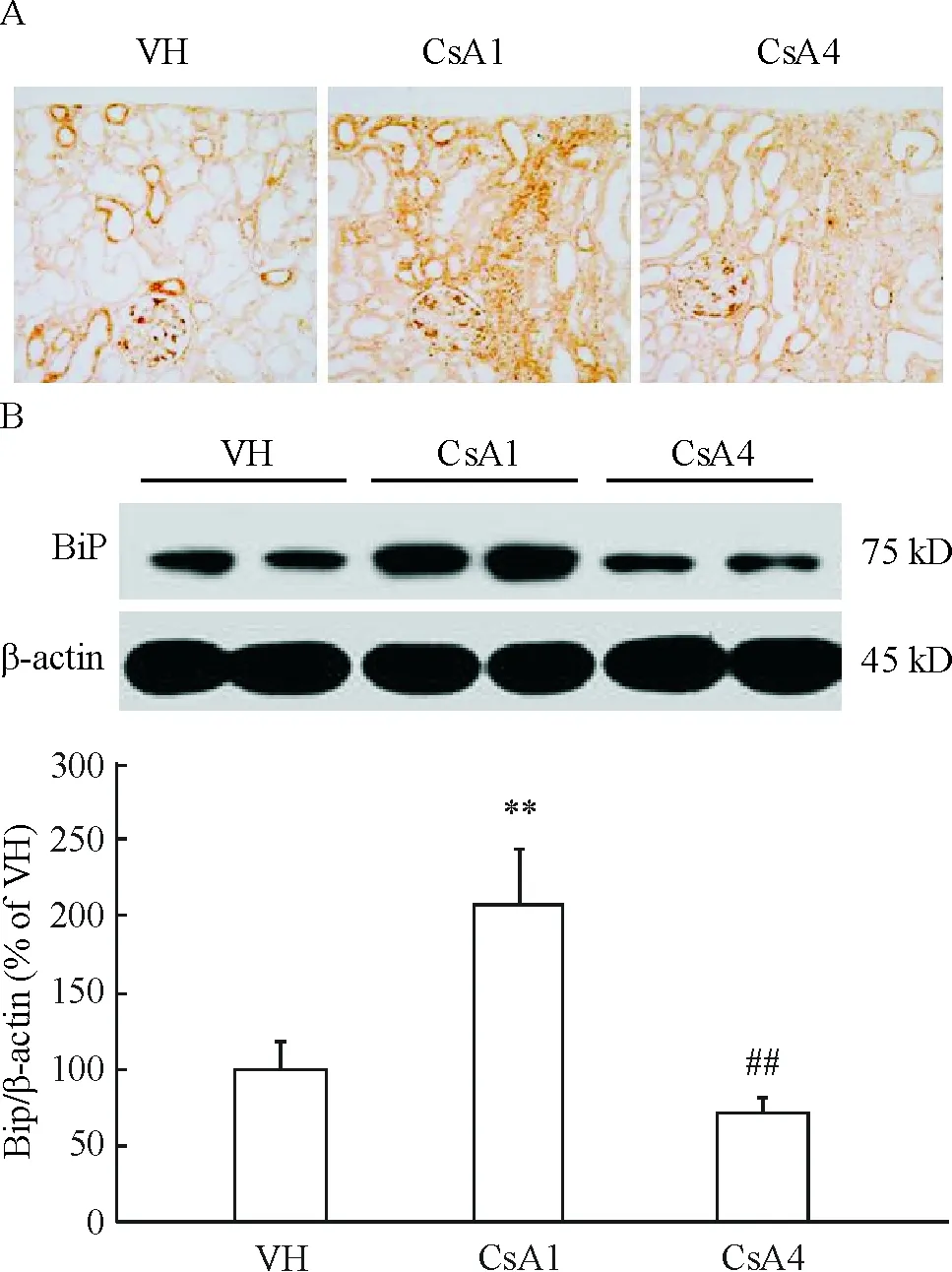
Figure 2. BiP expression detected by immunohistochemistry (A) and Western blotting (B). VH: vehicle group; CsA1: CsA treatment for 1 week; CsA4: CsA treatment for 4 weeks. Mean±SD. n=8. **P<0.01 vs VH; ##P<0.01 vs CsA1.

Figure 3. eIF2α expression detected by Western blotting. VH: vehicle group; CsA1: CsA treatment for 1 week; CsA4: CsA treatment for 4 weeks. Mean±SD. n=8. **P<0.01 vs VH; ##P<0.01 vs CsA1.
4 细胞凋亡相关基因的表达
结果表明,CsA 组caspase-12蛋白的表达1周达到高峰,4周降至正常水平,见图4。与之相反,GADD153和caspase-3蛋白的表达随CsA给药时间逐渐递增,见图5、6。
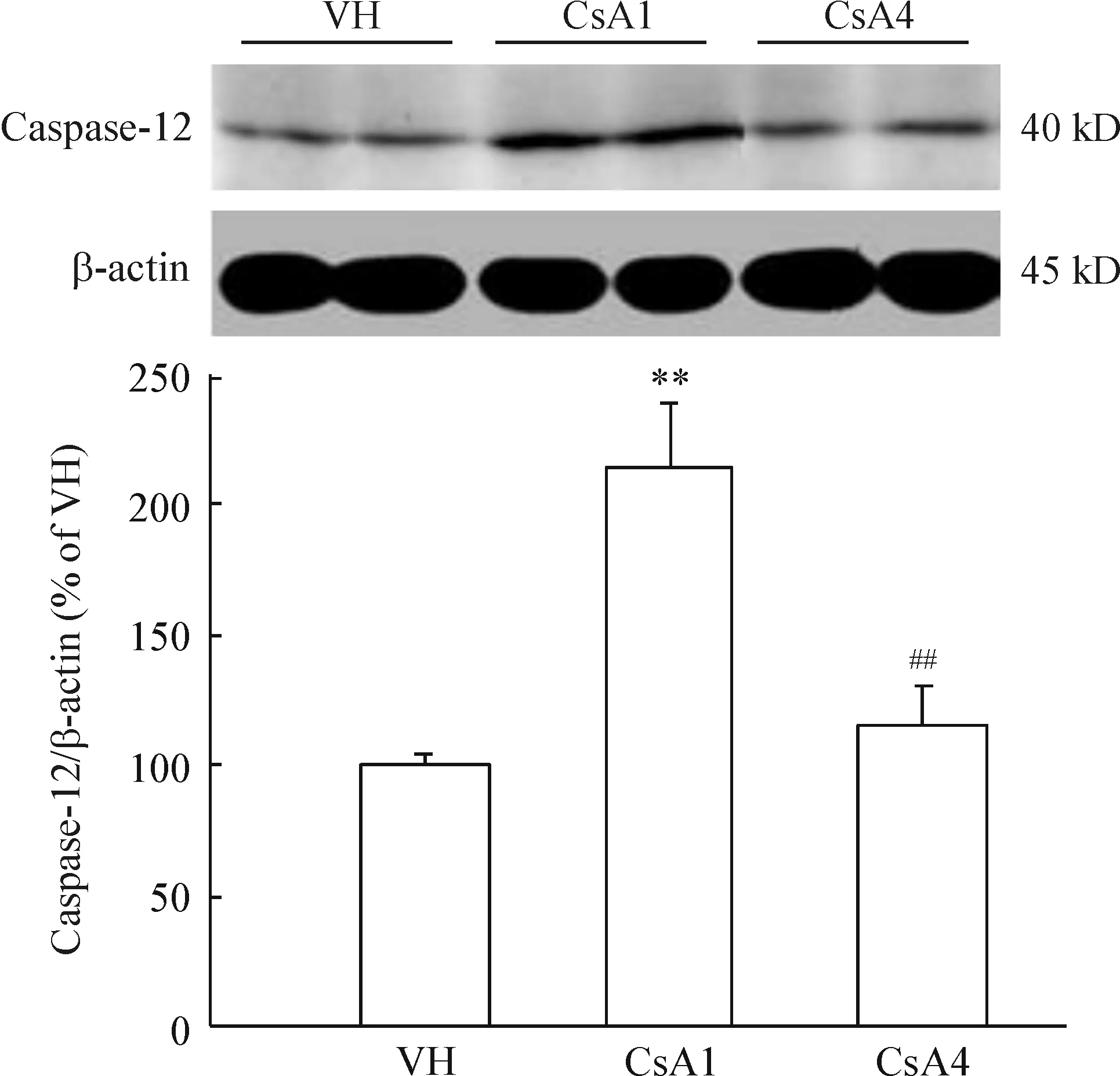
Figure 4. Caspase-12 expression tested by Western blotting. VH: vehicle group; CsA1: CsA treatment for 1 week; CsA4: CsA treatment for 4 week. Mean±SD. n=8. **P<0.01 vs VH; ##P<0.01 vs CsA1.

Figure 5. GADD153 expression measured by Western blotting. VH: vehicle group; CsA1: CsA treatment for 1 week; CsA4: CsA treatment for 4 weeks. Mean±SD. n= 8. **P<0.01 vs VH; ##P<0.01 vs CsA1.

Figure 6. Caspase-3 expression determined by Western blotting. VH: vehicle group; CsA1: CsA treatment for 1 week; CsA4: CsA treatment for 4 weeks. Mean±SD. n= 8. **P<0.01 vs VH; ##P<0.01 vs CsA1.
讨 论
因细胞凋亡而大量缺失肾实质细胞最终形成肾脏纤维化或硬化是诸多肾脏疾病的发病机制之一。本研究利用慢性CsA肾毒性大鼠模型,观察ERS与细胞凋亡在肾小管间质纤维化中的作用。结果表明,ERS启动了caspase-12依赖的细胞凋亡程序,通过eIF2α磷酸化以及细胞凋亡蛋白GADD153和caspase-3的激活,导致肾小管上皮细胞凋亡和纤维化形成,提示CsA所致的ERS反应和凋亡反应失衡有助于肾实质细胞凋亡,从而参与慢性CsA肾毒性的发病。
机体内环境需要动态平衡,一旦失去平衡即造成疾病的发生。物理、化学、遗传、病理等因素导致内质网内环境失衡, 形成ERS。ERS时其分子伴侣BiP分离而激活,此时已活化的蛋白激酶R样内质网激酶(protein kinase R-like endoplasmic reticulum kinase,PERK)特异性地磷酸化eIF2α第51位丝氨酸,eIF2α磷酸化则失去起始蛋白质翻译的活性,进而蛋白质合成受到抑制。eIF2α是一种参与真核翻译起始的重要蛋白质,是与细胞生存紧密相关的真核起始因子[6-7]。 在单侧输尿管梗阻大鼠肾间质纤维化模型或高糖诱导的人类近端肾小管上皮细胞培养实验中,Chiang 等[8]和Lim等[9]分别报道,ERS分子伴侣BiP与激活的eIF2α在过度的ERS所诱导的肾小管细胞凋亡中扮演重要角色。在本实验中,CsA诱导的ERS反应是双向的,给大鼠CsA注射1周显著上调内质网伴侣蛋白BiP蛋白的表达,而4周注射后其表达降至正常水平。免疫组化结果进一步证实BiP蛋白在肾小管上皮细胞中高表达,该区域正是CsA损伤的靶部位。反之,eIF2α蛋白的表达明显增加,4周时达到高峰,呈时间依赖性。以上结果表明CsA所致的过度ERS持续激活eIF2α磷酸化,从而极度消耗了肾小管细胞的内质网分子伴侣蛋白BiP,最后导致慢性CsA肾毒性肾小管细胞内环境受到损伤。
慢性CsA肾毒性以肾小管间质带状纤维化为病理特征,肾实质细胞凋亡是其分子发病机制之一。我们以往研究表明,CsA使肾入球动脉收缩导致缺血缺氧,从而激活肾内肾素-血管紧张素系统、上调致纤因子转化生长因子β1,以上因素均可调控促凋亡蛋白(Fas、Bax、caspase-3)和抗凋亡蛋白(Bcl-2、EGF),有效控制肾实质细胞凋亡。正常情况下,ERS反应可以成功地维持内质网内环境稳定。但是,过度的、过长的ERS可激活caspase-12依赖的细胞凋亡信号转导途径诱导细胞死亡。已知caspase-12属于特异性的内质网半胱氨酸蛋白酶,它是由ERS所激活继而引起线粒体非依赖的caspase-3裂解。本实验中,我们观察到CsA 1周致caspase-12蛋白的高表达而后下降,而促凋亡蛋白GADD153和caspase-3的表达随CsA给药时间递增,4周后达到顶峰。在肾脏病理组织中,CsA 1周观察不到TUNEL阳性细胞,而4周后肾小管上皮细胞显现出大量的TUNEL阳性细胞。这些结果提示凋亡前信号先于细胞凋亡,过度的ERS反应通过调控凋亡蛋白GADD153和caspase-3的表达导致细胞程序性死亡。
CsA诱导过度ERS和细胞凋亡的机制还不清楚,一种解释是CsA发挥药物毒性可直接引起ERS。有趣的是,Justo等[10]的体外实验报道,CsA可诱导ERS相关性促凋亡分子CHOP,但不能激活ERS特异性的caspase-12凋亡经典途径。这些不同结果暗示CsA本身不足以引起细胞凋亡,尚需一些介质协助完成凋亡程序,如活性氧自由基[11]、肾素血管紧张素系统[5]、 一氧化氮合酶[12]及天然免疫系统[13]等,因为这些都是ERS和细胞凋亡的诱发因素。基于以上理论,我们推测在慢性CsA肾毒性中,CsA本身协同其它介质共同完成ERS相关的细胞凋亡。
在临床实践中,肾移植早期移植肾对CsA所致的ERS有较好的适应能力,因为体内产生内质网分子伴侣。然而,由于对ERS反应的下降和细胞凋亡前途径的激活,使得移植肾很难长期适应CsA的服用。因此,本实验结果为临床药物减量或停用CsA以达到预防慢性CsA肾毒性之目的提供了分子理论基础。
[参 考 文 献]
[1] Li C, Yang CW, Park JH, et al. Pravastatin treatment attenuates interstitial inflammation and fibrosis in a rat model of chronic cyclosporine-induced nephropathy[J].Am J Physiol Renal Physiol, 2004, 286(1):F46-F57.
[2] Li C, Sun BK, Lim SW, et al. Combined effects of losartan and pravastatin on interstitial inflammation and fibrosis in chronic cyclosporine-induced nephropathy[J]. Transplantation, 2005, 79(11):1522-1529.
[3] Li C, Lim SW, Choi BS, et al. Inhibitory effect of pravastatin on transforming growth factor β1-inducible geneh3 expression in a rat model of chronic cyclosporine nephropathy[J]. Am J Nephrol, 2005, 25(6):611-620.
[4] Li C, Lim SW, Sun BK, et al. Expression of apoptosis-related factors in chronic cyclosporine nephrotoxicity after cyclosporine withdrawal[J]. Acta Pharmacol Sin, 2004,25(4):401-411.
[5] 李 进,袁 莉,李 新,等. 替米沙坦通过抑制胰岛内质网应激减少 STZ 致长期高脂喂养大鼠糖尿病的发生[J]. 中国病理生理杂志, 2010, 26(1): 17-22.
[6] Mori K. Tripartite management of unfolded proteins in the endoplasmic reticulum[J]. Cell, 2000,101(5):451-454.
[7] 刘春蕾, 李 鑫, 李蕊君,等. PERK 通路参与了缺氧心肌细胞的内质网应激及凋亡[J]. 中国病理生理杂志, 2012, 28(8): 1392-1398.
[8] Chiang CK, Hsu SP, Wu CT, et al. Endoplasmic reticulum stress implicated in the development of renal fibrosis[J]. Mol Med, 2011,17(11-12):1295-1305.
[9] Lim JC, Lim SK, Han HJ, et al. Cannabinoid receptor 1 mediates palmitic acid-induced apoptosis via endoplasmic reticulum stress in human renal proximal tubular cells[J]. J Cell Physiol, 2010,225(3):654-663.
[10] Justo P, Lorz C, Sanz A, et al. Intracellular mechanisms of cyclosporin A-induced tubular cell apoptosis[J]. J Am Soc Nephrol, 2003, 14(12):3072-3080.
[11] Cummings BS, Gelasco AK, Kinsey GR, et al. Inactivation of endoplasmic reticulum bound Ca2+-independent phospholipase A2in renal cells during oxidative stress[J]. J Am Soc Nephrol, 2004,15(6):1441-1451.
[12] Gotoh T, Mori M. Nitric oxide and endoplasmic reticulum stress[J]. Arterioscler Thromb Vasc Biol, 2006,26(7):1439-1446.
[13] 洪英礼,金英顺,崔镇花,等. TLR 活化参与环孢素 A 诱发的慢性肾小管间质损伤[J].中国病理生理杂志,2011,27(3): 555-559.
——疾病防治的新靶标

