鸡血藤中黄酮类化合物与环氧合酶-2 对接研究
蒋延超,蒋世云,傅凤鸣,黄 凯,康星欣,徐 丹
广西科技大学生物与化学工程学院,柳州 545006
大量临床并发症是由炎症导致的,因此开发高效、副作用低的抗炎药物对于人类健康十分重要。前列腺素是炎症反应中最主要的炎症介质之一,环氧合酶(cyclooxygenase,COX)是前列腺素生物合成的关键酶。环氧合酶被证实存在两种亚型[1],即结构型环氧合酶-1(COX-1)、诱导型环氧合酶-2(COX-2)。由COX-1 催化合成的前列腺素具有保护胃肠道黏膜免受外界刺激,维持正常的肾功能和凝血功能等作用,而由COX-2 催化合成的各种前列腺素(PGE2、PGI2)则具有致炎效应[2]。
目前应用的非甾体抗炎药存在严重的胃肠道、心血管等副作用,因此开发副作用低的新型抗炎药物势在必行。世界卫生组织报道,发达国家超过80%的人们更相信从植物中提取的药物。最近,国内外十分重视从传统植物药中研究开发新型选择性抑制COX-2 的抗炎药物,以降低非甾体抗炎药对胃和肾脏等的副作用。鸡血藤为豆科植物密花豆属密花豆(Spatholobus suberectus Dunn)的干燥藤茎,已被证明具有抗炎作用[3,4]。该草药化学成分稳定,提取工艺简单,临床应用广泛,是一个很有医用价值和开发前景的中药。鸡血藤中大量黄酮类化合物已被鉴定出来。本研究旨在筛选鸡血藤中对COX-2 有选择性抑制活性的黄酮类化合物,并从分子角度出发深入研究黄酮类化合物与COX-2 的作用机制。
本研究应用大分子对接软件包Autodock 4.2 对鸡血藤中黄酮类化合物与COX 进行模拟对接,筛选鸡血藤中具有COX-2 选择性抑制活性的黄酮类化合物,从分子水平研究黄酮类化合物对COX-2 的抑制机理,为阐明黄酮类化合物的抗炎机制提供依据。

图1 7 种抗COX-2 黄酮类抑制剂的化学结构式Fig.1 The structure of seven flavonoids inhibitors with COX-2
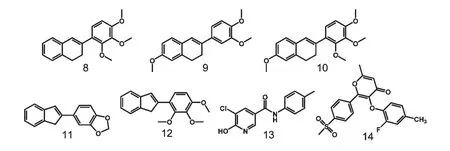
图2 7 种抗COX-1 多环类抑制剂的化学结构式Fig.2 The structure of seven polycyclics inhibitors with COX-1

图3 鸡血藤中黄酮类搜集物的二维结构式Fig.3 The structure of flavonoids of S.suberectus
1 材料与方法
对接研究使用Autodock 4.2 软件,数据处理使用origin 8.0 软件。
1.1 配体的构建
本研究考察了两种类型的配体,阳性抑制剂及鸡血藤中的黄酮类化合物。阳性抑制剂根据对接的酶分为与COX-2 对接的7 种黄酮类抑制剂和与COX-1 对接的7 种多环抑制剂。7 种黄酮类抑制剂命名为1-7,其相应的半抑制浓度分别为28.6、2.5、0.365、0.269、1.26、0.517 和25.5 μmol/L[5-8]。7 种多环类抑制剂命名为8-14,其相应的半抑制浓度分别为0.015、0.38、0.48、1.33、12.8、18.8、100 μmol/L[9-11]。7 种黄酮类抑制剂相应的化学结构如图1,7种多环抑制剂相应的化学结构如图2,鸡血藤中黄酮类搜集物的二维结构如图3[12-14]。化合物的二维结构通过化学软件Chemoffice 构建并利用MM2 立场将分子的三维结构进行能量最优化。
1.2 配体结构的预处理
在进行分子对接实验之前,合并配体中的非极性氢原子,并加上Gasteiger 电荷。配体中可旋转键通过Autodock-Tools 1.5.4 软件中的Ligand 子程序包自动检测,且在构象搜索过程中这些可旋转键全部设置为活性的旋转键。
1.3 受体结构的预处理
对接所用的COX-1 和COX-2 的三维结构从美国布鲁克海文(Brookhaven)国家实验室运作的蛋白质数据库(Protein Data Bank)中下载获得,PDB 代码分别为1CQE 和6COX。在进行分子对接实验之前,应用Autodock Tools 1.5.4 软件给蛋白加氢并计算Gasteiger 电荷,合并非极性氢原子,确定原子类型,纠正COX 中氨基酸残基上非整数的电荷。
1.4 对接参数的设置
本研究对接过程采用半柔性对接,即配体设置为柔性,受体设置为刚性。在格点盒子中,x 维、y 维和z 维格点的数目依次设为80、80、80。该格点盒子的空间大小设为0.375 Å。该格点盒子的中心设为27.678、29.495、40.113。配体构象搜索过程使用拉马克遗传算法(Lamarckian Genetic Algotithm,LGA),拉马克遗传算法对接的轮数设为100,能量评估的最大数目设为250 万。其他没有提及的参数都使用该软件的默认参数。对于与COX-2 结合自由能较低的鸡血藤中黄酮类小分子,进一步将其与COX-1 对接,对接过程参数设置与COX-2 相同。
2 实验结果
2.1 复合物SC-558-COX-2 分子结构的晶体重现
为考察Autodock 4.2 参数设置是否合理,将抑制剂SC-558 与COX-2 按上述参数设置进行分子对接,然后与晶体结构(ID:6COX)相比较。如图4 所示,分子对接结果与复合物SC-558-COX-2 晶体结构非常一致。两个结构的均方根偏差(RMSD)为0.68,表明Autodock 4.2 可以很好的重现原晶体结构,完全适用于该体系的研究。

图4 复合物SC-558-COX-2 分子结构的晶体重现Fig.4 Repeat the crystal structure of complex SC-558-COX-2
2.2 Autodock 4.2 软件对接的结果
在用Origin 8.0 软件对用Autodock 4.2 软件计算的结合自由能与实验的抑制活性作图之前,抑制剂半抑制浓度单位μmol/L 被转化为mol/L,并取负对数,将其化为pIC50。由Autodock 4.2 软件预测的黄酮类抑制剂与COX-2 之间的结合自由能、多环类抑制剂与COX-1 之间的结合自由能以及鸡血藤中黄酮类化合物与COX 之间的结合自由能见表1、表2、表3。线性回归分析得到预测的结合自由能(△G)与COX-2、COX-1 的阳性抑制剂抑制活性之间的关系为:△G=2.21404-2.42926 ×(pIC50),R2=0.96997 (图5a);△G=-5.64046-0.48574 ×(pIC50),R2=0.84171(图5b)。由线性回归分析可知,用Autodock 4.2 软件预测的结合自由能与实验获得的半抑制浓度的负对数之间存在良好的相关性,因为决定系数R2高达0.96997 和0.84171,P 值分别为0.00003 和0.00226,这些数值都是可以接受的值,进而也可以说明通过Autodock 4.2 软件预测的半抑制浓度接近于实验获得的半抑制浓度。

表1 黄酮类抑制剂与COX-2 预测的结合自由能及其pIC50Table 1 The binding energy and pIC50 of flavonoids inhibitors with COX-2

表2 多环类抑制剂与COX-1 预测的结合自由能及其pIC50Table 2 The binding energy and pIC50 of polycyclics inhibitors with COX-1

图5 黄酮类抑制剂与COX-2(a)、多环类抑制剂与COX-1(b)预测的结合自能与抑制活性之间的相关性Fig.5 Correlation between the binding energy calculated and the pIC50of positive inhibitors

表3 鸡血藤中黄酮类化合物与COX 的结合能及选择性Table 3 The binding energy and selectivity of flavonoids of S.suberectus with COX
2.3 筛选结果
通过与COX-1 和COX-2 的对接研究(表3)可得,3',4',7-三羟基黄酮(3',4',7-Trihydroxyflavone)、圣草酚(Eriodictyol)、儿茶素(Catechin)、紫铆素(Butin)、没食子儿茶素(Gallocatechin)、表儿茶素(Epicatechin)、毛蕊异黄酮(Calycosin)具有较强的抗COX-2 活性,其中,没食子儿茶素(Gallocatechin)、儿茶素(Catechin)、表儿茶素(Epicatechin)、3',4',7-三羟基黄酮(3',4',7-Trihydroxyflavone)对COX-2 有较好的选择性抑制活性。
2.4 分子结合模式
COX-2 的活性位点由三部分组成:一是由Tyr385、Trp387、Phe381、Ser530、Met522、Leu384 等残基组成的体积较大的疏水口袋,二是由Arg120、Glu524、Tyr355 等亲水残基组成的底物入口,三是由His90、Arg513、Val523、Gln192 等残基组成的体积较小的侧面口袋。对接研究表明,黄酮类抑制剂与COX-2 有多种结合模式。
7 种黄酮类抑制剂中活性最强和最弱的化合物4 和1 与COX-2 受体活性部位对接后的分子结合模型见图6,筛选得到的鸡血藤中具有较强抗COX-2活性的各类黄酮类化合物与COX-2 的结合模式见图7,结合模式中配体的构象是基于与COX-2 对接时容量最大的簇中结合自由能最低时的构象。

图6 抑制剂4(a)、1(b)与受体COX-2 活性位点的相互作用模式Fig.6 The binding mode of inhibitor 4 (a)and 1 (b)against COX-2
由图6 可知,抑制剂4 的B 环占据了COX-2 的侧面口袋,D 环朝向疏水口袋,与Ala516、Val349、Trp387、Leu359、Leu352、Ala527、Tyr355、Phe518、Val523 等疏水残基发生疏水相互作用。抑制剂4与COX-2 之间没有氢键形成,这可能意味着抑制剂4 对COX-2 的抑制活性不是由氢键作用产生的,而是通过与酶活中心处残基的范德华力及溶剂化作用等产生的。抑制剂1 的A 环占据COX-2 的侧面口袋,B 环临近疏水口袋,其3'、5 和7 位羟基分别与Ser530、Ser353 和Gln192 形成了一个长2.178、2.023、1.88 Å 的氢键,并与Phe518、Ala516、Tyr355、Val523、Leu352、Tyr385、Val349 等疏水残基存在疏水相互作用。
本课题研究的鸡血藤中15 种黄酮类化合物由黄酮化合物、异黄酮、黄烷酮和黄烷-3-醇组成。从图7 可以看出,各类化合物与COX-2 的结合模式基本一致。黄酮化合物3',4',7-Trihydroxyflavone 的A环位于疏水口袋中,B 环占据侧面口袋,其3'、4'位羟基分别和His90、Ser353 形成了一个长1.991、2.191Å 的 氢 键,并 与 Trp387、Tyr355、Phe518、Val523、Ala527、Met522、Leu352 等残基具有疏水相互作用。异黄酮化合物Calycosin 的B 环占据侧面口袋,A 环朝向疏水口袋,其3'、7 位羟基分别和Gln192 和Gly526 形成了一个长1.984、2.073Å 的氢键,并与Tyr385、Phe518、Val523、Ala516、Met522、Leu352、Gly526 等残基具有疏水相互作用。黄烷酮化合物的A 环占据疏水口袋,B 环朝向侧面口袋。其中,Butin 的4'、7 位羟基分别和His90、Met522 形成了一个长1.991、2.148Å 的氢键。黄烷-3 醇化合物的A 环朝向疏水口袋,B 环占据侧面口袋。其中,Gallocatechin 的3'、4'、5、7 位羟基分别和Gln192、His90、Ser530、Met522 形成了一个2.083、1.764、2.231、2.132 Å 的 氢 键,并 与Tyr385、Phe518、Val349、Ala516、Met522、Leu352、Gly526 等疏水残基发生疏水相互作用。
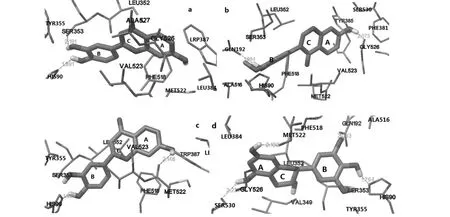
图7 配体3',4',7-三羟基黄酮(a)、毛蕊异黄酮(b)、紫铆素(c)和没食子儿茶素(d)与受体COX-2 活性位点的相互作用模式Fig.7 The binding mode of 3',4',7-trihydroxyflavone (a),calycosin (b),butin (c)and gallocatechin catechin (d)against COX-2
3 讨论
通过从图6 中比较黄酮、异黄酮、黄烷酮和黄烷-3-醇与COX-2 的分子理论结合模式可以看出:位于A、B 环上的取代基羟基,一类强极性基团,能够与受体分子COX-2 活性部位中的极性氨基酸残基之间形成分子间的氢键而发生相互作用。形成的分子之间的氢键在决定配体化合物在受体COX-2 活性部位中的取向时起到很大的作用。配体化合物中疏水性主体A、B 环能够与受体COX-2 活性部位中的疏水性氨基酸残基如Trp387、Tyr355、Phe518、Val523、Ala527、Met522、Leu352 等通过疏水作用力而发生相互作用。因此,位于两端的分子之间的氢键有助于稳定疏水性相互作用力。
筛选得到的7 种对COX-2 有较强抑制活性的黄酮类化合物中黄酮3',4',7-Trihydroxyflavone、黄烷酮Eriodictyol 和Butin 以及黄烷-3-醇Catechin 和Epicatechin 的结构中均包含一个邻苯二酚结构,这说明邻苯二酚结构对黄酮类化合物的抗COX-2 活性可能十分重要。对于黄烷酮化合物来说,Butin 和Eriodictyol 与COX-2 的结合自由能要比其他配体小分子与COX-2 的结合自由能大得多,且Butin 与COX-2 的结合自由能大于Eriodictyol 与COX-2 的结合自由能,这有可能意味着A 环上的5、6 位的羟基和C 环的3 位的羟基能够降低配体小分子对COX-2的抑制活性,且降低对COX-2 的抑制活性的能力依次为3 位羟基>6 位羟基>5 位羟基。对于黄酮化合物来说,Butin 与COX-2 的结合自由能要比3',4',7-Trihydroxyflavone 与COX-2 的结合自由能大得多,这可能意味着C 环的碳碳双键不利于抗炎。对于黄烷-3-醇化合物来说,与2S 构型的化合物相比,2R构型的化合物似乎有利于配体与5-脂氧合酶的结合,即2R 构型的化合物对5-脂氧合酶的抑制活性要比2S 构型的化合物强。没食子儿茶素与COX-2的结合自由能要比儿茶素和表儿茶素与COX-2 的结合自由能大得多,这有可能意味着B 环上的3'、5'羟基能够增强配体小分子与COX-2 亲和能力。这些结果提供了黄酮类化合物与COX-2 作用的基本原理,可能对新型COX-2 抑制剂的合理设计有所帮助。此外,本课题组曾筛选过鸡血藤中黄酮类化合物抗5-脂氧合酶(5-LOX)活性,其中圣草酚(Eriodictyol)、儿茶素(Catechin)、紫铆素(Butin)具有较强的抗5-LOX 活性。因此,圣草酚(Eriodictyol)、儿茶素(Catechin)、紫铆素(Butin)具有较好的COX-2 和5-LOX 双重抑制活性,儿茶素(Catechin)既具有较好的COX-2 和5-LOX 双重抑制活性,又对COX-2具有较好的选择性抑制活性。
4 结论
COX-1 和COX-2 均具有分叉结合口袋,侧面口袋和疏水口袋。COX-1 的侧面口袋结合位点中第523 号残基由COX-2 中的Val 变成了体积较大的Ile,使得COX-1 的侧面口袋小于COX-2,这一差异可能成为设计选择性COX-2 的关键。通过将鸡血藤中黄酮类化合物与COX-1 和COX-2 的对接研究发现,3',4',7-三羟基黄酮、圣草酚、儿茶素、紫铆素、没食子儿茶素、表儿茶素、毛蕊异黄酮具有较强的抗COX-2 活性。其中,没食子儿茶素、儿茶素、表儿茶素、3',4',7-三羟基黄酮对COX-2 有较好的选择性抑制活性,圣草酚、儿茶素、紫铆素具有较好的COX-2 和5-LOX 双重抑制活性。
1 Kalgutkar AS,Crews BC,Rowlinson SW,et al.Biochemically based design of cyclooxygenase-2 (COX-2)inhibitors:facile conversion of nonsteroidal anti-inflammatory drugs to potent and highly selective COX-2 inhibitors.Proc Nat Acad Sci USA,2000,97:925-930.
2 Khan Z,Khan N,Tiwari PR,et al.Biology of Cox-2:an application in cancer therapeutics.Curr Drug Targets,2011,12:1082-1093.
3 Li RW,Ling GD,Myers SP,et al.Anti-inflammatory activity of Chinese medicinal vine plants.J Ethnopharmacol,2003,85:61-67.
4 Yang M,Xiao CH,Wu QF,et al.Anti-inflammatory effect of Sanshuibaihu decoction may be associated with nuclear factor-kB and p38 MAPKa in collagen-induced arthritis in rat.J Ethnopharmacol,2010,127:264-273.
5 Jan H,Milan B,Stanislav C,et al.Natural compound cudraflavone B shows promising anti-inflammatory properties in vitro.J Nat Prod,2011,74:614-619.
6 Deng SX,Afa KP,Brett JW,et al.Lipoxygenase inhibitory constituents of the fruits of Noni (Morinda citrifolia)collected in Tahiti.J Nat Prod,2007,70:859-862.
7 Yung HJ,Jin KK,Seon HK,et al.2,3-Diarylbenzopyran derivatives as a novel class of selective cyclooxygenase-2 inhibitors.Bioorg Med Chem Lett,2003,13:413-417.
8 Khemraj B,Ishwari NS,Somendu KR,et al.Rotenoids from Boerhaavia diffusa as potential anti-inflammatory agents.J Nat Prod,2013,76:1393-1398.
9 Bhaskar B,Sivaram H,Darshit BS,et al.Discovery of potential and selective COX-1 inhibitory leads using pharmacop hore mode lling,in silico screening and in vitro evaluation.Eur J Med Chem,2014,86:469-480.
10 Lei S,Li ZL,Ying Y,et al.Design of novel N-phenylnicotinamides as selective cyclooxygenase-1 inhibitors.Bioorg Med Chem Lett,2011,21:121-124.
11 Francisco C,Jimenez JM,Nuria G,et al.Synthesis and biological evaluation of 2-phenylpyran-4-ones:A new class of orally active cyclooxygenase-2 inhibitors.J Med Chem,2004,47:3874-3886.
12 Lee MH,Lin YP,Hsu FL,et al.Bioactive constituents of Spatholobus suberectus in regulating tyrosinase-related proteins and mRNA in HEMn cells.Phytochemistry,2006,67:1262-1269.
13 Cui YJ(崔艳君),Liu P(刘屏),Chen RY(陈若芸).Caulis spatholobi active ingredients research.Chin J Chin Mat Mid(中国中药杂志),2005,30:121-123.
14 Yoon JS,Sung SH,Park JH,et al.Flavonoids from Spatholobus suberectus.Arch Pharm Res,2004,27:589-592.

