超临界CO2萃取法提取棘托竹荪中的活性物质及其抑菌效果研究
蓝蔚青,曹 奕,陈 燕,潘迎捷,孙晓红
上海海洋大学食品学院 上海水产品加工及贮藏工程技术研究中心,上海 201306
棘托竹荪(Dictyophora echinovolvata)为担子菌亚门、腹菌纲、鬼笔目、鬼笔科、竹荪属的一类药食两用真菌[1],主要分布于云南、贵州、四川、湖南等地,其中以四川绵阳出产的棘托竹荪质量最好。竹荪首次见于历史文献记载是唐代孟诜撰写的《食疗本草》,当时被称为“蓐”。同时代的笔记小说《酉阳杂俎》在其编录的植物卷中,首次对其子实体形态作了具体描述。棘托竹荪营养丰富、滋味鲜美、香味浓郁,长期以来作为我国的珍贵特产之一,价等黄金,其子实体所含的粗蛋白比例达17.67%,人体所必需氨基酸总量达5.4 mg/100 g,约占氨基酸总量的1/3,且具有抗氧化、抗菌及抗肿瘤等多种功效[2]。此外,棘托竹荪中还富含多种维生素与微量元素,营养价值远远高于日常所食用的蔬菜[3]。
近年来,国内相关科研工作者对棘托竹荪中活性物质的提取与抑菌活性开展了部分研究工作。檀东飞等[4-6]通过石油醚、乙酸乙酯与正己烷对棘托竹荪子实体浸提,采用水蒸气蒸馏法对棘托竹荪挥发油进行提取,用牛津杯法测定其抑菌活性,并分析了多种提取物的化学成分。梁鸣等[7]在研究棘托竹荪丙酮提取物化学组成的同时,还比较了丙酮、乙醇与蒸馏水等溶剂获得提取物的抑菌活性。卢惠妮等[8]采用水提法获得棘托竹荪的抑菌物质,并通过琼脂平板打孔法测定其抑菌活性。结果得出,棘托竹荪提取物在中性至偏碱性条件下能保持其抑菌活性,且热稳定性好。国外在棘托竹荪中活性物质的提取与抑菌研究方面还鲜有研究。
目前,国内主要采用溶剂萃取与水蒸气蒸馏法提取竹荪中的抑菌物质。通常情况下,溶剂提取法所得提取物抑菌效果不佳,水蒸气蒸馏法所得的挥发油抑菌效果虽好,但萃取时间过长,且得率偏低。超临界CO2萃取技术作为一种新型提取技术,相对于传统提取工艺,其具有萃取工艺简单易行,且有大工业生产的设备,生产周期短等优点,现已被证明能提取出多种植物中的抑菌物质[9,10],但用于提取竹荪中抑菌物质的研究还未有文献报道。本文通过L16(43)正交实验,选取萃取压力、萃取温度与萃取时间为主要影响因素,通过超临界CO2萃取法,以活性物质对单增李斯特菌和副溶血性弧菌的最小抑菌浓度(MIC)与抑菌率作为提取效果指标,设计棘托竹荪抑菌活性物质的最佳提取条件,为今后开展竹荪等天然产物提取与利用研究提供理论参考。
1 材料与方法
1.1 实验原料
棘托竹荪子实体,购自四川绵阳食用菌所,保存于干燥避光处;单增李斯特菌(Listeria monocytogenes,菌株编号:ATCC19115),副溶血性弧菌(Vibrio parahaemolyticus,菌株编号:ATCC33847)均购自中国普通微生物菌种保藏管理中心。
1.2 实验试剂
胰蛋白胨大豆琼脂(TSA),胰蛋白胨大豆肉汤(TSB),NaCl 等均购自北京陆桥有限责任公司。
1.3 主要仪器设备
SB-02 多功能粉碎机(上海市普恒信息科技有限公司),超临界CO2萃取装置(美国FOSS 公司),Bio-Tek 酶标仪(美国伯腾仪器有限公司),QB9006微孔板快速振荡器(江苏省金坛市医疗仪器厂),ESCO 超净工作台(美国Airstream 公司),3799 型96微孔板(美国康宁公司)。
1.4 实验方法
1.4.1 超临界CO2提取抑菌物质的正交实验设计
将供试棘托竹荪子实体烘干(37 ℃烘箱中静置20 min),用多功能粉碎机粉碎2 min,将粉碎后的竹荪过40 目筛,装入萃取釜内,等待萃取。通过预实验,设计三因素四水平L16(43)的正交实验,以萃取压力、萃取温度和萃取时间等因素对所得物质的抑菌效果进行研究,正交实验因素水平表见表1。
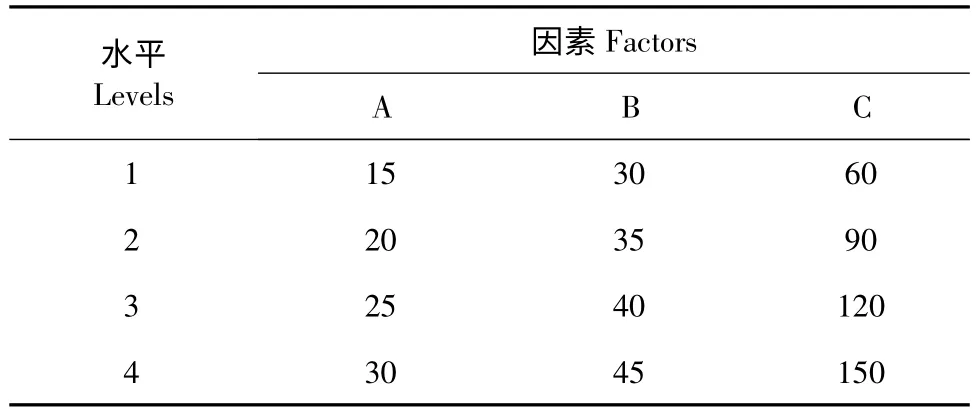
表1 正交实验因素水平表Table 1 Factors and levels of orthogonal experiments
1.4.2 棘托竹荪活性物质的提取工艺
开启机器,安放装有50.0 g 竹荪的萃取釜,外加密封圈。打开加热开关、设定所需的萃取温度,打开进气阀,使CO2压进萃取釜内。开启高压泵,设定所需的萃取压力,进行静态萃取过程60 min。随后动态萃取,并将收集管放在馏出口收集萃取物质。到达所需萃取时间后,取下收集管,调节高压泵,使萃取装置中的压力降低,关闭进气阀,打开出气阀。取下萃取釜清洗,并关闭机器,最终获得棘托竹荪活性物质。
1.4.3 棘托竹荪提取物对两种菌的MIC
取甘油管保藏的两种菌株,其中分别用灭菌后的TSB 进行两种菌的活化(副溶血性弧菌用含3%NaCl 的TSB)。取10 μL 菌液加入10 mL TSB 中稀释(副溶血性弧菌用含3% NaCl 的TSB),使菌液浓度达106CFU/mL,作为供试菌液备用。该过程与活性物质提取实验同步进行。采用微量孔板法,通过倍比稀释法用无菌水对棘托竹荪提取物依次进行梯度稀释。其中
实验组:100μL 106CFU/mL 菌液+100μL 倍比稀释提取液
对照组1:100μL 倍比稀释的提取液+100μL TSB
对照组2:100μL 106CFU/mL 菌液+100μL TSB
阴性对照组:200μL TSB
加样前先涂布平板确认两种菌的初始菌液浓度,加样后于微孔板振荡器37 ℃培养24h,取出观察浊度变化,判定其MIC 值,继而进行平板计数实验验证结果精确性。每个处理样2 个平行,每次实验重复3 次。当活菌数在106CFU/mL,细菌生长受到明显抑制的棘托竹荪提取物最低浓度为其MIC值。
1.4.4 微孔板法测定棘托竹荪对两种菌的抑菌率
向96 微孔板中每孔加入100 μL 制备的菌液,将所得各组提取物质用0.1% Tween-20 增溶稀释,将其浓度稀释至两种菌的MIC。取100 μL 加入孔中与菌液充分混合,将加有单增李斯特菌和副溶血性弧菌菌液的微孔板置于37 ℃微孔板振荡器中培养12 h 后,放入酶标仪测定其OD600,由公式1[11]得其抑菌率。

式中:ODR为对照孔吸光值;OD 为样品孔吸光值;ODB为空白孔吸光值
1.5 数据处理
实验数据均为3 次重复实验的均值,数据用Excel2010 进行处理,使用Origin 8.0 进行绘图,均值间的差异显著性通过统计软件SPSS17.0 进行检验。
2 结果与讨论
2.1 超临界CO2萃取法所得棘托竹荪提取物对两种菌的MIC
由微量孔板法结合平板计数法得到棘托竹荪提取物对单增李斯特菌与副溶血性弧菌的最小抑菌浓度为15.0 mg/mL。卢惠妮等[8]采用琼脂平板打孔法进行长裙竹荪子实体的抑菌活性研究,得到棘托竹荪浸提液对单增李斯特菌的MIC 为25.0 mg/mL,对副溶血性弧菌的MIC 为12.5 mg/mL。罗胜莲等[12]对棘托竹荪乙酸乙酯浸膏水溶液采用滤纸片扩散法进行了抑菌作用研究,得出棘托竹荪提取物对细菌的抑制作用效果明显,其对各类细菌的MIC 在50~100 mg/mL。杨威等[13]研究了不同辅助手段获得棘托竹荪菌丝体提取物对6 种常见食品腐败菌的效果,结果发现酶解水提法效果最佳,其对大肠杆菌与金黄色葡萄球菌等的MIC 为3.125 mg/mL。
由此可见,虽然对棘托竹荪提取物MIC 的测定方法不同,但其对同类细菌的MIC 值基本相近。然而,棘托竹荪的提取部位与提取方法不同,其对不同种类细菌的抑制效果也存在着一定差异。
2.2 不同提取条件下棘托竹荪提取物抑菌正交实验结果
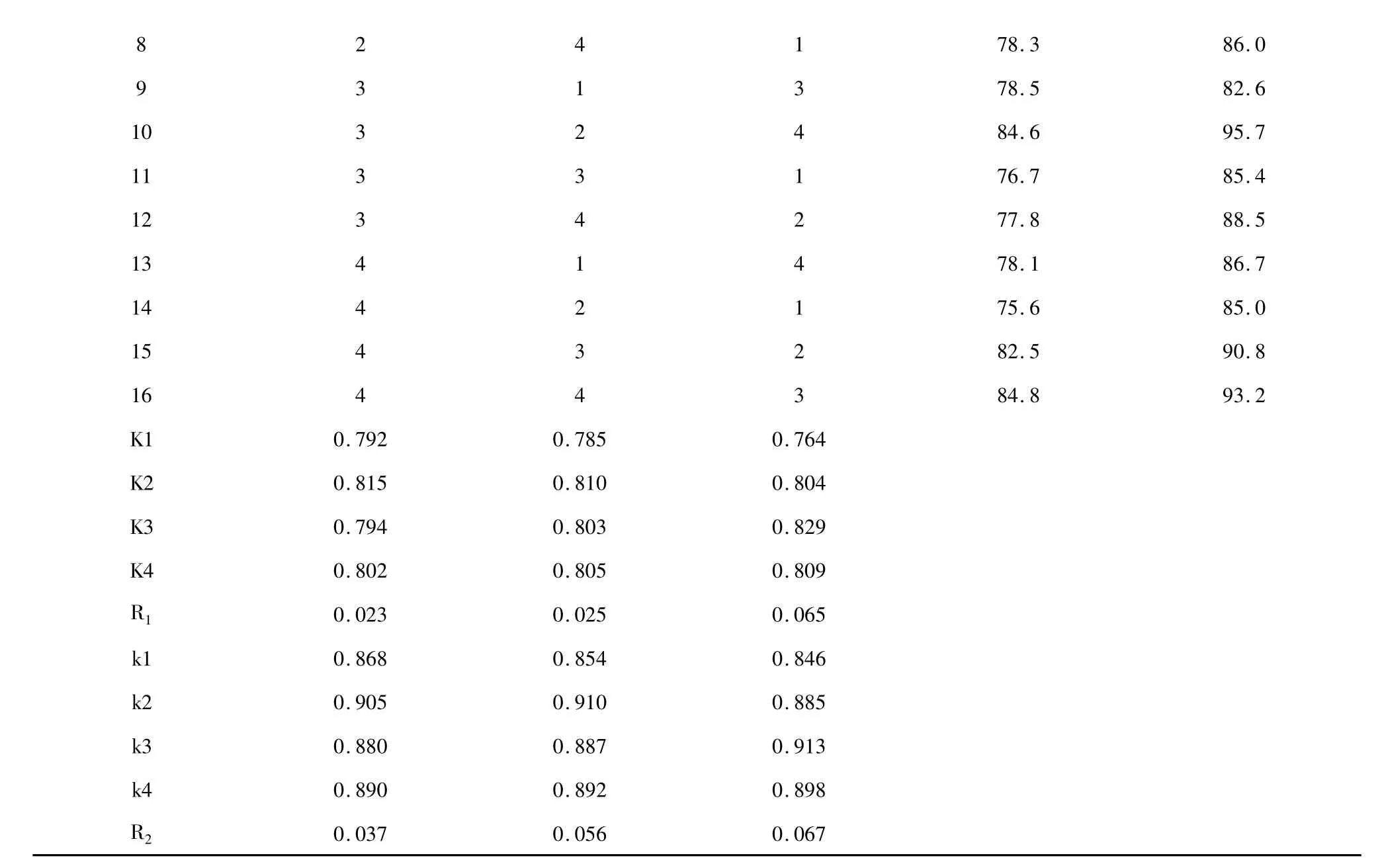
采用超临界CO2萃取法,通过改变不同提取条件获得棘托竹荪子实体提取物,并对提取物浓度在MIC 时对单增李斯特菌和副溶血性弧菌的抑制效果进行分析。同时,还进行不同组别样品在37 ℃24 h 条件下作微孔振荡培养处理,由平板计数加以验证,结果如表2 所示。
根据对上表结果的综合分析,得出对单增李斯特菌与副溶血性弧菌抑菌效果的最优组合均为A2B2C3,各影响因子的强弱依次为是RC> RB>RA。即得提取因素对两种菌抑菌效果的影响程度顺序依次为:萃取时间>萃取温度>萃取压力。范巧宁等[14]通过响应面法优化了热水浸提法提取棘托竹荪菌盖多糖的提取工艺,结果得出因素的显著性影响排序为:料液比>提取次数>提取时间>提取温度。田甜[15]采用响应面法优化了棘托竹荪的菌盖多糖分离制备工艺,结果发现料液比、提取次数与提取时间均达到极显著,提取温度为显著。在对菌盖多糖的生物活性研究中,发现棘托竹荪多糖具有良好的还原能力和自由基清除能力,对细菌、酵母菌与霉菌具有一定的抑制作用。可见,棘托竹荪多糖提取率的高低对提取物的抑菌效果好坏有直接影响。本次研究结果的显著性分析与上述结论基本相似,萃取时间与萃取温度对棘托竹荪提取物抑菌率的影响高于萃取压力。
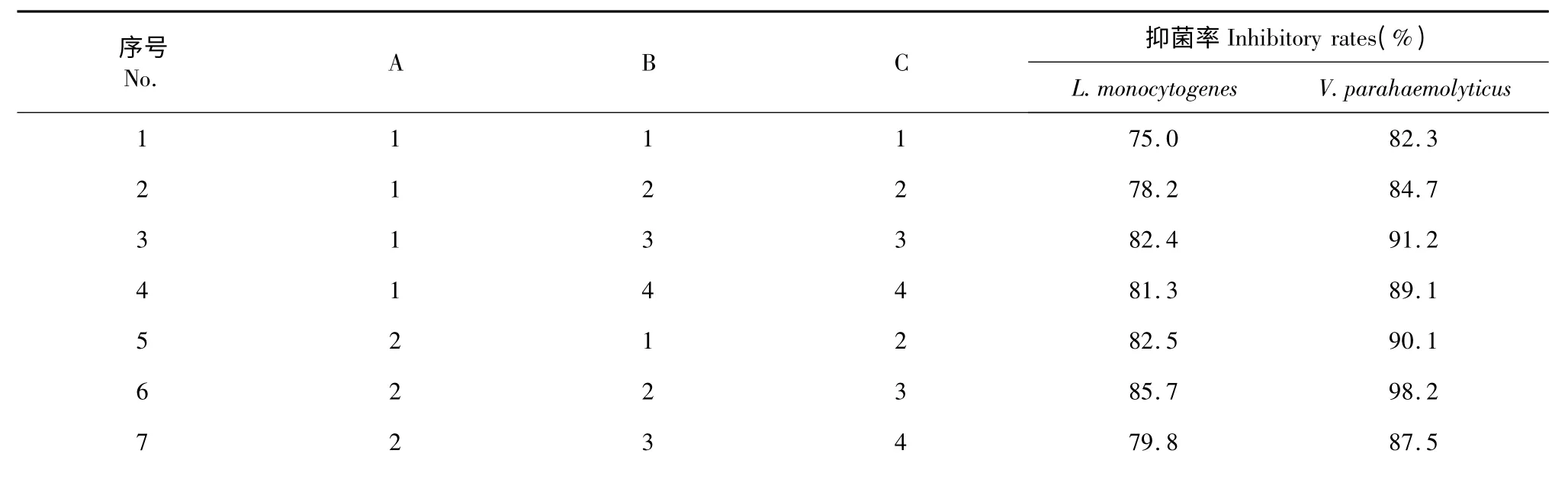
表2 不同提取条件下所得棘托竹荪提取物对单增李斯特菌与副溶血性弧菌的抑菌率Table 2 Inhibitory rates of different D.echinovolvata extracts on L.monocytogenes and V.parahaemolyticus
2.3 不同提取条件对所得物质抑菌效果的比较分析
通过对所得数据的方差分析,以抑菌率为单因变量,以工艺参数为多因素。方差分析结果如表3与表4 所示。

表3 活性物质对单增李斯特菌抑菌率的方差分析Table 3 Analysis of variance with the results of inhibitory rates on L.monocytogenes

表4 活性物质对副溶血性弧菌抑菌率的方差分析Table 4 Analysis of variance with the results of inhibitory rates on V.parahaemolyticus

结果表明:棘托竹荪提取物对单增李斯特菌与副溶血性弧菌抑菌率的重复数据无显著性差异。A因素(萃取压力)与B 因素(萃取温度)间的差异不显著,说明其对单增李斯特菌的抑菌率影响虽不明显,但其重要程度要高于C 因素(萃取时间),萃取时间才是决定对两种菌抑菌率高低的关键因素。该结果与极差法所得结论保持一致。
2.4 最佳提取条件的筛选
通过对数据多因素多水平的比较分析,获得竹荪提取物对单增李斯特菌与副溶血性弧菌抑菌率的边际均值图(图1a 与图1b)。通过对边际均值的多重比较,可衡量不同组合对两种菌的抑菌率高低。从图1a 可以看出,A2与C3对单增李斯特菌的抑菌效果好,而B2至B4的边际均值较为相近。通过在A2B3C3和A2B4C3工艺参数下进行提取实验,结果测得两种条件的提取率分别为83.8%与84.7%,均低于正交实验所得的最优组合A2B2C3的85.7%,故确定A2B2C3为最优组合。从图1b 中可看出A2B2C3为最优组合,抑菌率为98.2%。因此,超临界CO2萃取法提取棘托竹荪活性物质的最优提取工艺参数为:20MPa,35 ℃,120min。

图1 棘托竹荪提取物抑菌率的多重比较图Fig.1 Multiple comparisons with the results of inhibitory rates for active substances from D.echinovolvata
3 结论
本文尝试应用超临界CO2萃取技术提取棘托竹荪中的抑菌物质,根据抑菌率高低衡量其提取效果,并优化了提取工艺参数。结果得出:超临界CO2萃取法所得的棘托竹荪提取物对单增李斯特菌和副溶血性弧菌均具较好的抑制作用。抑菌物质提取的最佳工艺参数为:萃取压力20 MPa,萃取温度35℃,萃取时间120 min。棘托竹荪活性物质对两种菌的最小抑菌浓度(MIC)均为15.0 mg/mL。处理后24 h 后,其对单增李斯特菌与副溶血性弧菌的最佳抑菌率分别为85.7%和98.2%。
1 Liu ZX(刘振祥),Zhang S(张胜).Edible Fungus Cultivation Technology.Beijing:Chemical Industry Press,2007,07:122-127.
2 Cao M (曹萌),Lin CQ (林陈强),Lin RB (林戎斌),et al.Study on extraction and analysis of protein from Dictyophora echinovolvata Pileus.Nat Prod Res Dev(天然产物研究与开发),2014,26:475-479.
3 Sun YM(孙远明),Yu QL(余群力).Food Nutrition.Beijing:China Agricultural University Press,2005.67-69.
4 Tang DF(檀东飞),Liang M(梁鸣),Wu RJ(吴若菁),et al.Chemical compositions of Dictyophora echinovolvata extracted with ethyl acetate.Nat Prod Res Dev(天然产物研究与开发),2003,15:34-37.
5 Tang DF(檀东飞),Du ZH(杜峥辉),Wu RJ(吴若菁),et al.Studies on antimicrobial activity of Dictyophora echinovolvata extracted with N-hexane.Strait Pharm J(海峡药物),2003,15:61-63.
6 Tang DF(檀东飞),Huang RZ(黄儒珠),Lu Z(卢真),et al.Chemical compositions and antimicrobial activity of the volatile oil and petroleum ether extract from the fresh carpophore of Dictyophora echinovolvata.J Fujian Norm Univ,Nat Sci(福建师范大学学报,自科版),2010,26:100-105.
7 Liang M(梁鸣),Tang DF(檀东飞).Chemical compositions in Dictyophora echinovolvata extracted with acetone and the antibacterial activity extracted with acetone,ethanol and water.Mycosystema(菌物学报),2005,24:197-201.
8 Lu HN(卢惠妮),Pan YJ(潘迎捷),Sun XH(孙晓红),et al.Antibacterial activity of water extract of Dictyophora echinovolvata Fruitbod.Food Sci (食品科学),2009,30:120-123.
9 Al-Burtamani SK,Fatope MO,Marwah RG et al.Chemical composition,antibacterial and antifungal activities of the essential oil of Haplophyllum tuberculatum from Oman.J Ethnopharmacol,2005,96:107-112.
10 Zhang QP(张庆平).Study on the flavone in Sophora flavescens with supercritical CO2extraction and its antimicrobial effect.Strait Pharm J(海峡药物),2009 21(7):46-48.
11 Luo JM(骆健美),Wang M(王敏),Liu F(刘峰),et al.A method that micro plate bioassay method for rapidly detecting the antibacterial activity,China,invention,200810153179.9,2009.4.22
12 Luo SL(罗胜莲),You X(游霞),Ding CC(丁聪聪),et al.Antimicrobial activities and chemical compositions of Dictyophora indusia fisscher and Dictyophora echinovolvata.Sci Tech Food Ind (食品工业科技),2012,21:70-73.
13 Yang W(杨威),Wu SR(吴素蕊),Fan J(樊建),et al.Study on the antimicrobial effect of Dictyophora echinovolvata Mycelium.Edible Fungi China (中国食用菌),2008,27(6):34-37.
14 Fan QN (范巧宁),Zhang WG (张伟刚),Zhao P (赵珮),et al.Extraction and antioxidant activity in vitro of polysaccharides from Pileus of Dictyophora echinovolvata.Sci Tech Food Ind (食品工业科技),2013,23:112-117.
15 Tian T(田甜).Separation preparation and biological activity research of polysaccharide from Dicyophora echinovolvata volva.Xi’an:Shaanxi Normal University (陕西师范大学),MSc.2012.

