天花粉中总黄酮提取工艺研究
杨申明,王振吉,韦 薇,何明华
1楚雄师范学院化学与生命科学院;2云南省高校应用生物学重点实验室,楚雄 675000
天花粉是葫芦科植物栝楼(Trichosanthes kirilowii Maxim)的干燥块根[1],它是一种药食同源的植物,广泛分布于云南各地。天花粉又称瑞雪(《本草纲目》),栝楼粉、楼粉(《药材学》),屎瓜粉(《四川中药学》),性味苦、甘、酸、凉,它是临床中常用的中草药,具有清热生津,消肿排脓,抗癌之功效[2]。天花粉药用价值很高,常用于治疗热病烦渴,肺热燥咳,内热消渴等病证,具有很好的疗效。据文献报道,栝楼属植物的化学成分主要有油脂和有机酸类、黄酮类、三萜、甾体类及甾醇、蛋白质等[3]。
黄酮类化合物具有清除自由基、抗氧化、抗癌、抗菌、抗过敏、抗病毒等[4]多种生物活性及药理作用,很可能是天花粉抗癌作用的有效成分之一。目前,有关天花粉中总黄酮含量测定方面的研究未见报道。本研究对天花粉中总黄酮进行提取、定性鉴定和含量测定,并对提取工艺进行优化,旨在为天花粉的综合利用提供参考。
1 材料与仪器
天花粉,采自云南省双柏县妥甸镇,经楚雄师范学院化学与生命科学系王振吉博士鉴定为葫芦科植物栝楼的块根;芦丁对照品(纯度>98%),由成都思科华生物技术有限公司生产;无水乙醇、甲醇、硝酸铝、氢氧化钠、镁粉、亚硝酸钠、三氯化铝、浓盐酸、浓硫酸等均为分析纯;实验用水为蒸馏水;所用仪器均经自来水,蒸馏水清洗备用。
722S 可见分光光度计(上海青华科技仪器有限公司生产),CP214C 电子天平(奥豪斯仪器有限公司制造),HH-S2 恒温水浴锅(金坛市大地自动化仪器厂制造),摇摆式植物粉碎机,202-00 型电热恒温干燥箱(上海市崇明实验仪器厂制造),格兰仕G823YL-V1 型微波炉,SHZ-ⅢA 型循环水式真空泵(巩义市予华仪器有限责任公司生产)等。
2 试验方法
2.1 试验材料的处理
将采集到的天花粉依次用自来水、蒸馏水洗净后切成小片,置于50 ℃恒温干燥箱中烘干至恒重,用摇摆式植物粉碎机研碎后过60 目筛,得天花粉干粉。将天花粉干粉用折叠成筒状的滤纸装好,加入150 mL 石油醚冷浸48 h,然后将其置于75 ℃水浴中,使其微沸回流反复提取,直至提取液澄清为止,取出冷却至室温。减压抽滤,滤渣用石油醚充分洗涤后,风干至石油醚全部挥发,得到去除色素和油脂的天花粉密封保存,备用。
2.2 总黄酮的提取
准确称取2.0 g 去除色素和油脂的天花粉干粉,用30 mL 50%(体积分数,下同)甲醇,在70 ℃水浴中加热回流90 min,过滤,滤液用50%甲醇定容至50 mL 容量瓶中,摇匀,得天花粉黄酮提取液(供试品溶液)。
2.3 总黄酮的定性鉴定[5]
各取1 mL 供试品溶液4 份于试管中,分别加4%(质量分数,下同)NaOH,1%(质量分数)AlCl3甲醇溶液,盐酸-镁粉,浓硫酸进行显色反应,观察实验现象。
2.4 总黄酮含量测定[6]
以芦丁为标准品,采用Al(NO3)3-NaNO2比色法测定总黄酮含量。
2.4.1 芦丁标准曲线制备
准确称取在105 ℃干燥至恒重的芦丁标准品10.00 mg,用50%甲醇溶解,定容至50 mL 容量瓶中,摇匀,即得0.20 mg/mL 的芦丁对照品溶液。准确吸取对照品溶液0.0、0.5、1.0、1.5、2.0、2.5、3.0 mL,分别置于25 mL 比色管中,分别加50% 甲醇3.0、2.5、2.0、1.5、1.0、0.5、0.0 mL,各加5%(质量分数,下同)亚硝酸钠溶液0.30 mL,摇匀,放置6 min;加10% (质量分数,下同)硝酸铝溶液0.30 mL,摇匀,放置6 min;加4% 氢氧化钠溶液4.00 mL,用50%甲醇定容至10 mL 刻度线,摇匀,放置10 min。以相应的试剂空白作参比,在440~560 nm波长处测定络合物吸光度。结果表明,对照品液在510 nm 波长处有最大吸光度,因此选择510 nm 作为测定波长。在510 nm 波长处测定体系的吸光度,以吸光度为纵坐标,芦丁浓度为横坐标,绘制标准曲线。得回归线性方程为A=-0.00404 +11.95357C,R=0.9998。结果表明,芦丁对照品在所试浓度0.00~0.06 mg/mL 范围内呈良好的线性关系。
2.4.2 天花粉总黄酮含量测定
取供试品溶液1 mL,置于25 mL 比色管中,加50%甲醇3.0 mL,加5%亚硝酸钠溶液0.30 mL,摇匀,放置6 min;加10%硝酸铝溶液0.30 mL,摇匀,放置6 min;加4%氢氧化钠溶液4.0 mL,用50%甲醇定容至10 mL 刻度线,摇匀,放置10 min,以相应的试剂空白作参比,在510 nm 波长处测定吸光度,根据标准曲线计算总黄酮含量。
样品中总黄酮含量(mg/g)=(C ×50 ×10)/W,式中C 为提取液中总黄酮浓度;W 为样品质量(g)。
2.5 提取溶剂的考察
准确称取去除色素和油脂的天花粉2.0 g 样品3 份,分别加入60% (体积分数,下同)甲醇、60%(体积分数,下同)乙醇、水各50 mL,置于索氏提取器中,提取180 min,过滤,滤液移至50 mL 容量瓶中,用相应的溶剂定容至刻度,摇匀。分别精密吸取以上提取液1.0 mL,置于25 mL 比色管中,按标准曲线操作方法显色后分别以相应溶剂定容至10 mL刻度,摇匀,放置10 min,再分别以相应的溶剂为空白对照,在510 nm 处测定其吸光度,计算天花粉中总黄酮含量。
2.6 提取方法的考察
准确称取去除色素和油脂的天花粉2.0 g 样品4 份,分别用50 mL 60%甲醇索氏提取3 h、50 mL 60%甲醇回流提取3 h、50 mL 60%甲醇微波提取5 min、50 mL 60%甲醇冷浸提取24 h,过滤,将滤液移至50 mL 容量瓶中,分别用60%甲醇定容至刻度线,摇匀。分别精密吸取以上制备液1.0 mL 置于25 mL 比色管中,按标准曲线项操作显色后,分别以相应溶剂定容至10 mL 刻度,摇匀,放置10 min,再分别以相应的溶剂为空白对照,在510 nm 处测定其吸光度,计算天花粉中总黄酮含量。
2.7 提取工艺单因素试验[7]
按照上述提取方法,分别考察以下单因素影响:l)选择甲醇体积分数分别为40%、50%、60%、70%、80%作为提取溶剂进行比较,回流温度为70℃,回流时间为90 min,料液比为1∶15;2)确定50%甲醇提取效果较好后,以50%甲醇作为提取溶剂,分别在料液比为1∶10、1∶15、1∶20、1∶25、1∶30 的条件下进行回流提取,回流温度为70 ℃,回流时间为90 min;3)确定了料液比为1∶15 提取效果较好后,用料液比为1∶15,50%甲醇作为提取溶剂,分别在50、60、70、80、90 ℃温度条件下进行回流提取,回流时间为90 min;4)确定了回流温度为70 ℃提取效果较好后,以50%甲醇作为提取溶剂,料液比为1∶15,回流时间分别为60、90、120、150、180 min 的条件下进行回流提取,从而确定各因素的影响作用。
2.8 最佳提取工艺优化
在单因素试验基础上,结合药材性质以及实际生产要求,以甲醇体积分数、料液比、提取温度、提取时间为试验考察因素,以天花粉中总黄酮含量为评价指标,设计L9(34)正交试验探索最优化条件。因素及水平见表1。
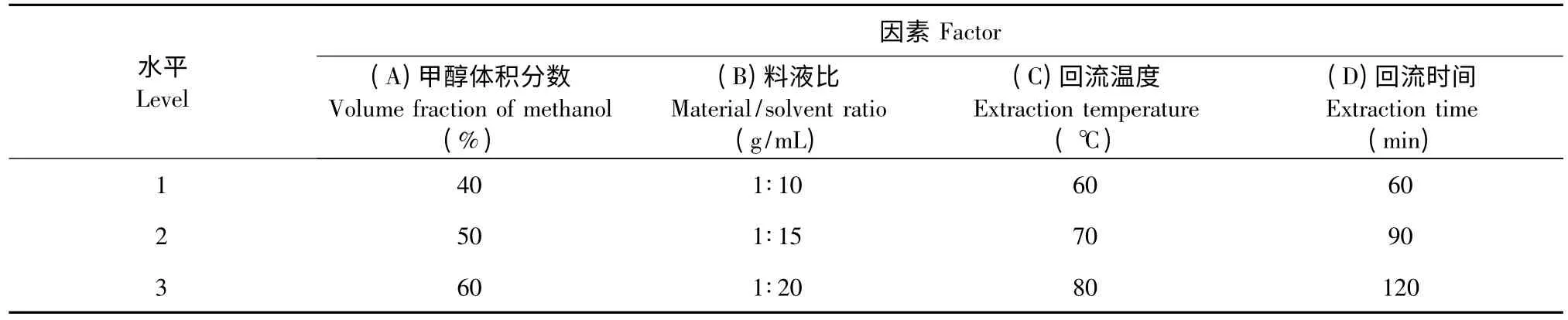
表1 正交试验因素水平Table 1 Factors and levels of orthogonal design
3 结果与分析
3.1 黄酮类化合物的鉴定
加4% NaOH 的溶液显橙红色,说明可能有二氢黄酮、橙酮或查耳酮存在;加1% AlCl3甲醇溶液显橙黄色,说明可能有查耳酮存在;加盐酸-镁粉的溶液由黄色变成红色,说明可能有黄酮、黄酮醇或二氢黄酮存在;加浓硫酸的溶液由黄色变成橙色,说明提取液中可能有黄酮、黄酮醇、异黄酮存在。通过显色反应,说明天花粉的提取液中含有黄酮类化合物。
3.2 提取溶剂的考察结果
提取溶剂分别为60%乙醇、60%甲醇、水,总黄酮含量分别为0.0858、0.1234、0.0488 mg/g。结果表明,甲醇的提取效果明显高于乙醇和水的提取效果,这是因为天花粉中黄酮类化合物的极性较强,总黄酮的提取率随溶剂亲水性的增强而增大[8]。因此在后续优化试验中选择甲醇作为提取溶剂。
3.3 提取方法的考察结果
提取方法分别为索氏提取、回流提取、微波提取、冷浸24 h 提取,总黄酮含量分别为0.0670、0.1172、0.0774、0.0774 mg/g。结果表明,回流提取法提取的天花粉提取液中总黄酮含量最高,因此在后续优化试验中选择回流法提取。
3.4 单因素试验的结果
3.4.1 甲醇体积分数对总黄酮提取效果的影响
如图1A 所示。在相同条件下,天花粉中总黄酮的提取率随甲醇浓度的增大而随之提高,但当甲醇浓度达到50%以后,提取率有所下降。可能是由于高浓度甲醇使细胞内蛋白质凝固,影响总黄酮的溶出[9]。故选择甲醇体积分数为50%。
3.4.2 料液比对总黄酮提取效果的影响
如图1B 所示。在相同条件下,天花粉中总黄酮的提取率随着料液比的增大而提高。当料液比达到1∶15 时,提取率最高,之后随着料液比的增大提取率呈下降趋势。故选择料液比为1∶15。
3.4.3 提取温度对总黄酮提取效果的影响
如图1C 所示。在相同条件下,天花粉中总黄酮的提取率开始时随着温度的升高,总黄酮提取率增加,当温度达到70 ℃时提取率最高,之后随着提取温度的继续增加,总黄酮提取率呈下降趋势。这可能是随着温度的升高,分子运动加快,黄酮更容易从细胞中转移到溶质中。但温度过高,使蛋白质凝固,黄酮不易溶出,同时天花粉中有效成分会受到破坏。故选择提取温度为70 ℃。
3.4.4 提取时间对总黄酮提取效果的影响
如图1D 所示。在相同条件下,天花粉中总黄酮的提取率开如时随着提取时间的增加,总黄酮提取率提高,提取90 min 时提取率最高,之后随提取时间的增加,总黄酮提取率呈下降趋势,可能是长时间高温使蛋白质凝固,造成黄酮不易溶出。故选择提取时间为90 min。

图1 甲醇体积分数(A)、料液比(B)、提取温度(C)、提取时间(D)对总黄酮提取效果的影响Fig.1 Effect of the volume fraction of methanol (A),solid/liquid ratio (B),extraction temperature (C)and extraction time (D)on the extraction yield of total flavonoids
3.5 天花粉总黄酮提取工艺参数优化
正交试验结果见2。从表2 分析可知:各因素对天花粉总黄酮提取率的影响程度不同,其影响的主次顺序为C >D >A >B,即提取温度>提取时间>甲醇体积分数>料液比。由试验数据可以得出:提取温度为显著影响因素,极差分析最优组合是A2B2C2D2(即最佳实验条件是:甲醇体积分数50%,料液比1∶15,浸提温度70 ℃,回流时间90 min)。
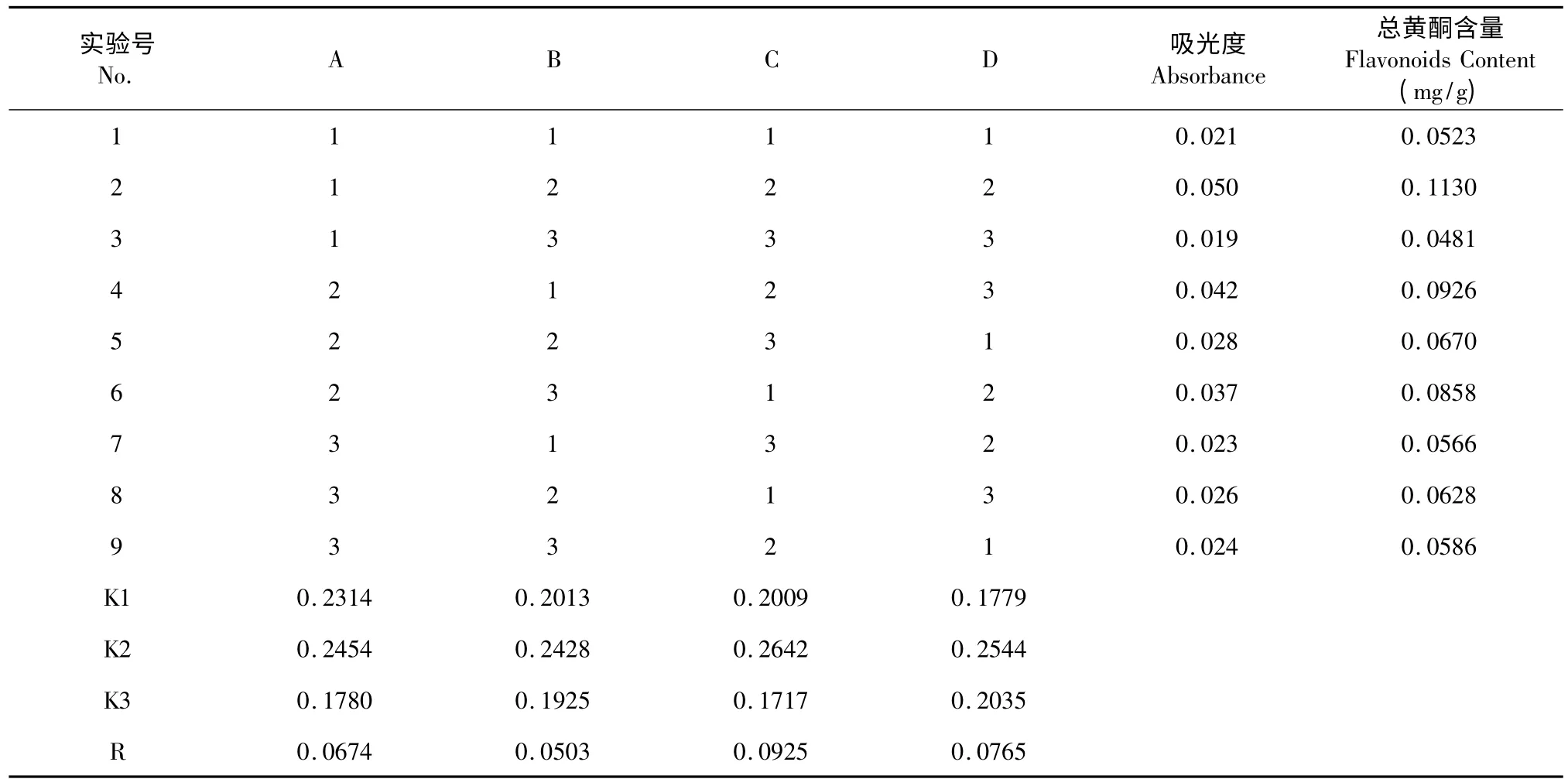
表2 正交试验结果Table 2 Results of the orthogonal experiment
3.6 验证试验
准确称取2.0 g 去除色素和油脂的天花粉样品共5 份,在最优工艺条件下进行提取后,将所得溶液分别过滤于50 mL 容量瓶中,用相应溶剂定容至刻度,摇匀。精密吸取供试品溶液1.0 mL 5 份,分别置于25 mL 比色管中,按2.4.1 标准曲线绘制操作方法显色后,以相应的溶液为空白对照,在510 nm波长处测定其吸光度,计算提取液中总黄酮的含量,结果平均总黄酮含量为0.1184 mg/g,RSD 为0.28%(n=5),表明该方法重现性好。
3.7 稳定性实验
精密吸取2.2 项操作中制备的供试品液1.0 mL 于25 mL 比色管中,按2.4.1 操作方法显色后,以相应的溶液为空白对照,分别在0、10、20、30、40、50、60 min,在510 nm 波长处测定其吸光度,结果得RSD=0.302 %(n=7)。说明天花粉总黄酮提取液经显色后在60 min 内稳定。
4 讨论
一般情况下,游离黄酮类化合物难溶于水或不溶于水,易溶于甲醇、乙醇等有机溶剂中,本试验分别对甲醇、乙醇和水三种提取溶剂进行考察,发现甲醇提取天花粉中总黄酮的提取率明显比乙醇和水的提取率大,故本试验选择甲醇作为提取溶剂。通过对索氏提取、回流提取、微波提取和冷浸提取四种提取方法的考察,发现回流法提取天花粉中总黄酮的的提取率明显比其他三种方法的提取率大,故本试验选择回流法提取。
正交试验结果表明,各因素对天花粉总黄酮提取率的影响程度不同,在趋于提取平衡的条件下,其影响的主次顺序为提取温度>提取时间>甲醇浓度>料液比。通过正交试验结果以及最优参数的验证试验,最佳提取工艺条件为A2B2C2D2(即甲醇体积分数50%,料液比1∶15,提取温度70 ℃,提取时间90 min)。在此条件下进行验证试验,测得天花粉中总黄酮平均含量为0.1184 mg/g,RSD 为0.28%(n=5)。该方法提取天花粉中的总黄酮准确度高,操作简单,稳定性和重复性好,适合于天花粉中总黄酮的提取和含量测定。
目前,尚未见有关天花粉中总黄酮的相关研究报道,本试验用甲醇回流法从天花粉中提取总黄酮,对提取物进行定性鉴定,并用Al(NO3)3-NaNO2比色法测定测定了总黄酮含量,为天花粉的药学价值和进一步综合开发利用提供参考数据,此研究报告具有一定的参考价值。但天花粉中总黄酮的提取影响因素复杂,包括提取温度、料液比、提取时间、提取剂浓度、提取剂种类、提取方法、提取次数和粉碎粒度等。该研究仅对前6 个常规影响因素进行了研究,其他因素的影响效果还有待进一步深入研究。
1 Chinese Pharmacopoeia Commission.Pharmacopoeia of the People’s Republic of China(中华人民共和国药典).Beijing:Chemical Industry Press,2005.38.
2 Gao J(高捷),Fang L(方琳),Wo LQ(沃联群),et al.Identify Radix Trichosanthis and its confused substance Trichosanthes Laceribratea by UV spectra.Study J Tradit Chin Med(中医药学刊),2005,23:1496-1497.
3 Chen SF(陈胜发),Huang SW(黄时伟),Wang CL(王昌利).Research progress on chemical constituents of genus Trichosanthes kirilowii.Chin Tradit Patent Med(中成药),2006,28:1187-1192.
4 Xing GX(邢国秀),Li N(李楠),Wang T(王童),et al.Research progress on chemical constituents of flavonoids in licorice.China J Chin Mater Med(中国中药杂志),2003,28:593-597.
5 He L(何兰),Jiang ZH(姜志宏).Resources Chemistry of Natural Products(天然产物资源化学).Beijing:Science Press,2008.356.
6 Xaiyimaerdan G(古丽娜尔·夏衣马尔旦),Abudurexit M(麦尔布哈·阿布都热西提).Determination and extraction study on content of total flavones in dodder.J Xinjiang Normal Univ,Nat Sci(新疆师范大学学报,自科版),2010,29:87-91.
7 Li Y(李燕),Zeng QH(曾庆华).The extraction technology of total flavonoids from perilla leaf by orthogonal test.Farm Machinery(农业机械),2011,17:148-150.
8 Sun ZM(孙智敏),Yin R(殷蓉),Li J(李静).Study on extraction of flavonoids from orange peel.Hebei J Ind Sci Technol(河北工业科技),2006,23:228-230.
9 Chen W(陈伟),Liu QM(刘青梅),Yang XM(杨性民),et al.Study on application of microwave technology in the process of Eucommia ulmoides extract.Food Sci(食品科学),2006,27:285-288.

