紫球藻共生真菌产物中紫红色色素的稳定性及抗氧化性研究
程 文,许 伟,邵 荣,*
1常州大学石油化工学院,常州 213164;2 盐城工学院化学与生物工程学院,盐城 224051
与人工合成色素相比,天然色素因其无毒、安全性高、色泽自然,且具有很高的营养价值和药理功能而日益受到重视[1]。天然色素一般来源于资源有限的动植物[2-5]。研究表明,微生物也可作为天然色素的来源[6-8]。微生物生长繁殖迅速,不受时间与空间的限制,可大规模生产,克服了动植物资源有限的问题[6]。色素的稳定性是色素在应用中的一个重要指标,色素稳定性的好坏将直接影响着色物质的色泽和品质[9]。但天然色素的稳定性差,从而影响其应用[10-12]。本课题组前期从紫球藻共生真菌中筛选获得一株产天然紫红色色素的菌株,该菌株通过液体发酵、提取、分离后得到紫红色色素,初步研究表明该色素具有一定的开发与利用价值。因此,本文对紫红色色素的稳定性和抗氧化性进行了研究,为该色素的进一步开发利用提供一定的依据。
1 材料与方法
1.1 材料、试剂与仪器
1.1.1 材料
共生真菌,从紫球藻(Porphyridium purpureum)中筛选获得。该菌株于2013 年9 月保藏于中国微生物保藏中心(北京),保藏号为8168,经鉴定为刀孢蜡蚧菌(Lecanicillium psalliotae)[13]。采用该菌进行液体发酵,所得发酵液产物经浓缩、提取分离后获得紫红色色素。
1.1.2 试剂
乙醇、正丁醇、葡萄糖、蔗糖、麦芽糖、淀粉、抗坏血酸、柠檬酸、亚硫酸钠、30%双氧水(均为分析纯,购自江苏彤晟化学试剂有限公司);ABTS[>98%色谱纯,购自Sigma-aldrich(上海)贸易有限公司];邻菲啰啉(分析纯,购自上海山浦化工有限公司);其它试剂均为分析纯,并用蒸馏水配制溶液。
1.1.3 仪器
UV2310II 紫外/可见分光光度计(上海天美科学仪器有限公司);DZF-6050 真空干燥箱、DK-BD电热恒温水槽(上海精宏实验设备公司);SHZ-IID循环水式真空泵、RE-2000B 旋转蒸发仪(上海雅荣生化设备仪器有限公司);AUY220 电子天平[岛津国际贸易(上海)有限公司];TGLL-18K 离心机(太仓市华美生化仪器厂);PHS-3C 精密pH 计(上海精密科学仪器有限公司)。
1.2 实验方法
1.2.1 色素的提取
菌株接种在马铃薯葡萄糖液体培养基中,于28℃静置培养7~9 d。将发酵液抽滤,滤液旋转蒸发,浓缩至原体积的1/5。向浓缩液中加入3 倍体积的无水乙醇,4 ℃冷藏过夜,抽滤除去多糖、蛋白等不溶物;将滤液旋转蒸发至原体积的1/10,用2 倍体积的乙酸乙酯进行萃取,此过程重复三次,将萃取的乙酸乙酯合并,加入无水硫酸钠去除水分,过滤,将滤液真空旋转蒸发至干,于真空干燥箱中干燥备用。
1.2.2 光谱扫描
取上述样品溶于蒸馏水,以蒸馏水为对照,置于UV2310II 紫外/可见分光光度计下,在200~800 nm范围内进行光谱扫描,检测最大吸收波长,测得结果为520 nm,将其作为测定波长。
1.2.3 温度对色素稳定性的影响
将色素溶解于蒸馏水中进行稳定性研究,使对照组的吸光度在0.4~0.7 之间。
分别取样品溶液5 mL 置于20、40、60、80、100℃的温度下恒温水浴处理1~3 h,每隔1 h 取出样品,冷却至室温,测定其在520 nm 处的吸光度,计算色素残存率,并分析不同温度对色素稳定性的影响。
1.2.4 pH 对色素稳定性的影响
将样品溶于pH 为2、4、6、8、10、12 的缓冲溶液中,室温条件下,每隔1 h 测定其在520 nm 处的吸光度,计算色素残存率,分析不同pH 对色素稳定性的影响。
1.2.5 光照对色素稳定性的影响
分别取样品溶液5 mL,置于室外日光、室内散射光、紫外光及暗室条件下处理,每隔12 h 测定其在520 nm 处的吸光度,计算色素残存率,分析不同光照条件对色素稳定性的影响。
1.2.6 H2O2对色素稳定性的影响
将氧化剂H2O2分别配成终浓度为0.10%、0.25%、0.50%、1.00%的紫红色色素溶液,以不加H2O2为对照(0.00%),每隔2 h 测定其在520 nm处的吸光度,计算色素残存率,分析氧化剂对色素稳定性的影响。
1.2.7 Na2SO3对色素稳定性的影响
将还原剂Na2SO3配成终浓度为1.0、2.5、5.0、25.0、50.0 μg/mL 的色素溶液,以不加Na2SO3为对照,每隔2 h 测定其在520 nm 处的吸光度,计算色素残存率,分析还原剂对色素稳定性的影响。
1.2.8 金属离子对色素稳定性的影响
分别将金属离子Na+、Ca2+、Cu2+、Fe2+、Fe3+、Zn2+、Mg2+、K+配成终浓度为1.0、2.5、5.0 mmol/L的色素溶液,并以不添加金属离子为对照,观察色素颜色变化,室温静置每隔2 h 测定其在520 nm 处的吸光度,计算色素残存率。
1.2.9 常用食品添加剂对色素稳定性的影响
分别将氯化钠、氯化钾、葡萄糖、蔗糖、麦芽糖、淀粉、抗坏血酸、柠檬酸配成浓度为5.0 mmol/L 的色素溶液,并以不添加添加剂为对照,室温静置每隔2 h 测定其在520 nm 处的吸光度,计算色素残存率,分析不同食品添加剂对色素稳定性的影响。
1.2.10 色素对ABTS 自由基的清除能力
参照Cao 等[14]的方法并作略微修改来测定色素对ABTS 自由基的清除能力。将2.45 mmol/L 的过硫酸钾加入到7.00 mmol/L 的ABTS 水溶液中,黑暗处理16 h,形成稳定溶液。取适量上述溶液加水,调节溶液使其在734 nm 处的吸光度为0.700 ±0.01。取不同浓度的色素提取液150 μL,加入3 mL的ABTS 溶液,室温下反应6 min,测定734 nm 处的吸光度,以水作对照。ABTS·清除率的计算公式如下:

A0是以蒸馏水代替色素的吸光度,A1是加色素的吸光度。
1.2.11 色素对羟基自由基的清除能力
采用邻二氮菲法对色素清除羟基自由基的能力进行测定。1.0 mL 的邻菲啰啉(2 mmol/L),4.0 mL磷酸盐缓冲液(pH 6.0,0.2 mol/L),1.0 mL 蒸馏水,1.0 mL 的FeSO4(2 mmol/L),1.0 mL 的H2O2(2 mmol/L,现配现用),振荡混匀,在37 ℃水浴60 min,记作Bb;以1.0 mL 蒸馏水代替1.0 mL H2O2,其它条件同Bb处理,记作Bc;以1.0 mL 不同浓度的提取液代替1.0 mL 蒸馏水,其它条件同Bb处理,记作Bs。Bb、Bc、Bs的吸光度在510 nm 处测定。·OH 清除率的计算公式如下:

上述所有实验均重复三次(n=3),并且标准偏差(RSD)小于5% 。
2 结果与分析
2.1 温度对色素稳定性的影响
天然色素的热稳定性是其在工业中潜在应用的重要指标。该色素在20~100 ℃条件下吸光度值的变化如图1 所示。由图1 可知,色素在20~60 ℃条件下,溶液吸光度随着时间的延长而略有上升;80~100 ℃下,溶液吸光度值随着时间的延长而降低。加热3 h 后,在20、30、60、80 ℃条件下损失低于1.0%,在100 ℃条件下损失率为8.9%。由此可知,该紫红色色素具有良好的热稳定性。

图1 温度对紫红色色素稳定性的影响Fig.1 Effect of temperature on the stability of the amaranth pigments
2.3 pH 对色素稳定性的影响
图2 显示了在不同pH 溶液中色素吸光度的变化。由结果可知,中性和弱酸性的条件下,该色素表现出良好的稳定性,色素在碱性条件下颜色由紫红色变为浅灰色,残留率低于50%。该研究结果为紫红色色素在食品加工以其他应用中提供一定的理论依据。
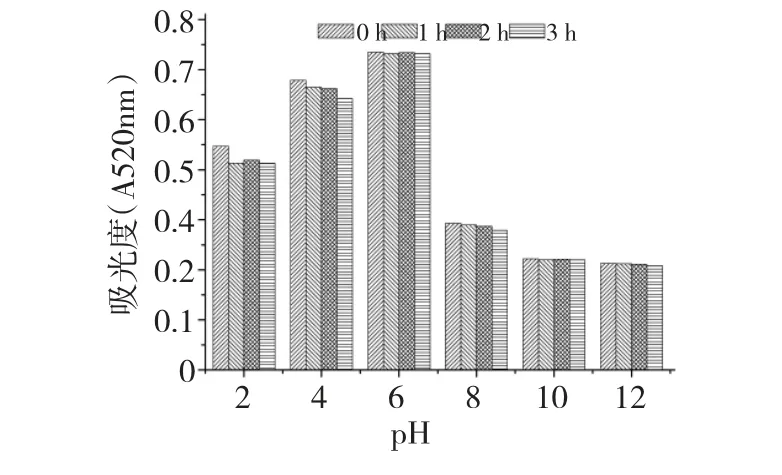
图2 pH 对紫红色色素稳定性的影响Fig.2 Effect of pH on the stability of the amaranth pigments
2.4 光照对色素稳定性的影响
如图3 所示,考察了色素在不同光照条件下的稳定性。在室内自然光、紫外光和避光条件下色素损失较小,96 h 后残留率均高于85.00%;而在室外直射光照射24 h 后,色素有效成分损失显著,残留率仅为33.60%,96 h 后色素颜色褪去为无色。结果显示,室内散射光、紫外光和避光对色素稳定性无明显影响,而太阳光对色素的稳定性有显著影响。因此,该色素在应用保存过程中应避免太阳光的直射。

图3 光照对紫红色色素稳定性的影响Fig.3 Effect of light on the stability of the amaranth pigments
2.5 H2O2对色素稳定性的影响

图4 H2O2对紫红色色素稳定性的影响Fig.4 Effect of H2O2on the stability of the amaranth pigments
天然色素通常可以被氧化或还原成另一种化学结构[15]。氧化剂H2O2对紫红色色素的影响,结果如图4 所示。随着H2O2浓度的增加,色素的残存率降低,且在2 h 内色素有效成分明显减少,处理时间越长,色素残留量越少。结果表明,氧化剂H2O2对色素的稳定性有显著影响。
2.6 Na2SO3对色素稳定性的影响
由图5 可知,随着还原剂Na2SO3浓度、反应时间的增加,紫红色色素吸光度增加。当浓度低于10 μg/mL 时,增色作用明显;浓度高于10 μg/mL 时,增色作用趋于平缓。结果显示,还原剂Na2SO3对色素具有增色作用。

图5 Na2SO3对紫红色色素稳定性的影响Fig.5 Effect of Na2SO3on the stability of the amaranth pigments

表1 金属离子对紫红色素稳定性的影响Table 1 Effect of metal ions on the stability of the amaranth pigments
2.7 金属离子对色素稳定性的影响
由表1 可知,不同浓度的金属离子Na+、K+、Ca2+、Mg2+对紫红色色素稳定性影响不大,而加入Zn2+使色素颜色明显变浅,Cu2+、Fe3+使色素颜色变为棕色。由结果可知,该色素对Zn2+、Cu2+、Fe3+敏感,对其他多种常见金属离子稳定性良好。
2.8 常用食品添加剂对色素稳定性的影响
如图6 所示,在溶液中分别加入氯化钠、氯化钾、葡萄糖、蔗糖、麦芽糖和淀粉,色素吸光度无明显变化;而加入柠檬酸或抗坏血酸后,溶液吸光度明显减小,这可能是因为加入酸性物质时溶液酸性增强,从而使色素不稳定,这与pH 对色素的影响相一致。结果表明盐类和糖类食品添加剂对色素具有护色作用,酸性添加剂不利于色素的稳定。

图6 食品添加剂对紫红色素稳定性的影响Fig.6 Effect of food additives on the stability of the amaranth pigments
2.9 色素清除ABTS 自由基的能力
ABTS 试验是基于抗氧化剂清除稳定的ABTS自由基能力的测定。如图7 所示,随着色素浓度(0.8~12.5 mg/mL)的增加,清除ABTS 自由基的能力增强。在浓度为12.5 mg/mL 时,色素对ABTS自由基的清除率达到99.69%。由此可知,该色素明显含有抗氧化剂,并显示了很强的清除ABTS 自由基的能力。

图7 紫红色素对ABTS 自由基的清除能力Fig.7 ABTS radical scavenging activity of the amaranth pigments
2.10 色素清除羟基自由基的能力
如图8 所示,随着色素浓度(2.5~12.5 mg/mL)的增加,对羟基自由基的清除能力增强。当达到12.5 mg/mL 时,其清除率达到80.95%。结果显示,该色素具有一定清除羟基自由基的能力。

图8 色素对羟基自由基的清除能力Fig.8 Hydroxyl radical scavenging activity of the amaranth pigments
3 结论
本文通过分光光度法考察了紫球藻共生真菌发酵产物中紫红色色素的稳定性,并进一步研究了该色素抗氧化能力。此色素具有一定的耐热性,可高温(80 ℃)加热,色素在中性和弱酸性条件下稳定,盐类、糖类食品添加剂以及金属离子K+、Na+、Ca2+、Mg2+对色素稳定性无明显影响。而太阳光、氧化剂会使色素褪色,Cu2+、Fe3+使色素变色,影响其稳定性,在加工应用中应避免这些因素。同时,该色素还具有抗氧化能力,色素能显著地清除ABTS和羟基自由基,清除率分别达到99.69% 和80.95%。该紫红色色素含有多种成分,需进一步分离、鉴定;另外可对该菌产色素的条件进行优化,为该菌应用于工业生产提供依据。
1 Gunasekaran S,Poorniammal R.Optimization of fermentation conditions for red pigment production from Penicillium sp.under submerged cultivation.Afr J Bio-technol,2008,7:1894-1898.
2 Aberoumand A.A review article on edible pigments properties and sources as natural biocolorants in food stuff and food industry.World J Dairy Food Sci,2011,6:71-78.
3 Buckow R,Kastell A,Terefe NS,et al.Pressure and temperature effects on degradation kinetics and storage stability of total anthocyanins in blueberry juice.J Agric Food Chem,2010,58:10076-10084.
4 Murthy pushpa S,Manjunatha MR,Sulochannama G,et al.Extraction,characterization and bioactivity of coffee anthocyanins.Eu J Biol Sci,2012,4:13-19.
5 Cai ZX,Wu JL,Chen L,et al.Purification and characterization of aquamarine blue pigment from the shells of abalone(Haliotisdiscus hannai Ino).Food Chem,2011,128:129-133.
6 Malik K,Tokkas J,Goyal S.Microbial pigment:A review.Int J Microbial Res Technol,2012,1:361-365.
7 Meinicke RM,Vendruscolo F,Moritz DE,et al.Potential use of glycerol as substrate for the production of red pigments by Monascus ruberin submerged fermentation.Biocat Agric Biochem,2012,1:238-242.
8 Daniel JD,Silvana TS,Plinho FH,et al.Production of extracellular b-glucosidase by Monascus purpureus on different growth substrates.Process Biochem,2007,42:904-908.
9 Tan YL(谭友莉),Ma YT(马云桐),Yan ZY(严铸云),et al.Study on the stability of red pigments produced by endophytic fungi in coptis deltoidea C.Y.Cheng et Hsiao.Nat Prod Res Dev(天然产物研究与开发),2013,25:1101-1106.
10 Qiu WF(邱伟芬),Wang HF(汪海峰).Stability of natural lycopene under different conditions.J Food Sci(食品科学),2004,25(2):56-60.
11 Ouyang J(欧阳杰),Zhao JL(赵佳丽),Chen XH(陈旭华).Advances in stabilization technology for natural pigments.Food Sci Tech(食品科技),2006,31:182-184.
12 Lu XH(卢雪华),Cheng J(成坚),Bai WD(白卫东).Present situation and countermeasures of the food pigment Industry in our country.China Condiment(中国调味品),2010,5(35):35-39.
13 Wu X(武侠),Liu AH(刘爱华),Cao JZ(曹君正),et al.A kind of Lecanicillium psalliotae strains(一种刀孢蜡蚧菌菌株).CN102417886 B,2013-5-22.
14 Cao JG,Xia X,Chen XF,et al.Characterization of flavonoids from Dryopteris erthrosora and evaluation of their antioxidant,anticancer and acetylcholinesterase inhibition activities.Food Chem Toxicol,2013,51:242-250.
15 Kannan P,Ganjewala D.Preliminary characterization of melanin isolated from fruits and seeds of Nyctanthes arbortristis.J Sci Res,2009,1:655-661.

