丹皮酚及其结构类似物的修饰与抗炎活性研究
姜玉才,彭永练,陈莉敏
福建医科大学药学院,福州 350004
丹皮酚(paeonol)又称牡丹酚,化学名2-羟基-4-甲氧基-苯乙酮,主要是从萝藦科植物徐长卿干燥根或全草和毛茛科植物牡丹根皮中提取分离出来的一种小分子的酚类化合物[1]。现代医学研究证明,丹皮酚具有广泛的生物活性,例如抑菌抗炎[2]、抗氧化[3]、降压利尿[4]、抗凝血[5]、抗过敏[6]、抗肿瘤[7]、增加巨噬细胞吞噬细胞的活性[8]等作用。同时关于丹皮酚及丹皮酚结构类似物例如2-羟基-5-甲氧基-苯乙酮、3-羟基苯乙酮、2-羟基苯乙酮和3-甲氧基苯酚等这些物质均有类似的生物活性[9]。非甾体抗炎药(NSAIDs)是全世界范围内处方量最大的药物之一,但长期大剂量服用NSAIDs 会引起许多不良反应,特别是消化道损伤[10]。本文利用拼合原理将临床上常用的NSAIDs 布洛芬与丹皮酚及结构类似物偶联制成孪药(其中四个为新化合物),期望偶联物能增强其解热镇痛抗炎的活性,减少布洛芬的羧基对消化道的直接刺激作用,或利用丹皮酚及结构类似物的抗氧自由基作用减少胃溃疡的产生;增加脂溶性,减少药物在消化道的停留时间。
1 材料与方法
1.1 仪器与试剂
AVATR330FT-IR 红外光谱仪(美国Thermo Nicolet 公司),KBr 压片法;三重串联四级杆质谱仪(美国G6410B);核磁共振波谱仪(BRUKER,BIOSPIN,AVANCE Ⅲ),TMS 为内标,CDCl3为溶剂;WRS-1B 数字熔点仪(上海精密科学仪器有限公司)。
布洛芬(99%,国药集团化学试剂有限公司);丹皮酚(99%)、2-羟基苯乙酮(99%)、3-羟基苯乙酮(98%)、2-羟基5-甲氧基苯乙酮(99%)、4-二甲氨基吡啶(DMAP,99%);二环己基碳二亚胺(DCC,99%)均购自上海晶纯生化科技股份有限公司;其余试剂均为分析纯。
1.2 实验方法
1.2.1 丹皮酚及结构类似物与布洛芬的缩合
以五种不同的丹皮酚及结构类似物为原料,与布洛芬反应合成种目标产物(A~E),合成路线如图1 所示:
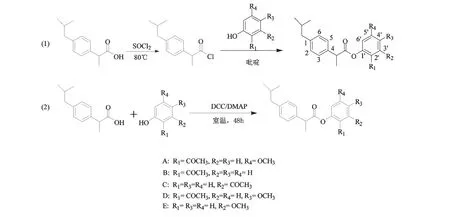
图1 丹皮酚及结构类似物修饰的合成路线Fig.1 Synthetic routes of paeonol analogues
路线(1)为酰氯法:参考文献[11]并作适当改进,将5.0 mmol 布洛芬溶于10 mL 氯仿,置于50 mL 单颈瓶中,加入氯化亚砜1.5 mL,搅拌回流3 h,减压蒸去氯化亚砜。残留物溶解在氯仿中,冰浴冷却至0℃,缓慢滴加丹皮酚或2-羟基苯乙酮、3-羟基苯乙酮、2-羟基-5-甲氧基-苯乙酮、3-甲氧基苯酚5.0 mmol 和吡啶0.8 mL 的混合溶液,冰浴下搅拌2 h,室温反应过夜,加入10 mL 蒸馏水,二氯甲烷萃取(10 mL ×3),合并有机相,依次用饱和碳酸氢钠溶液、蒸馏水和饱和食盐水溶液洗涤,用无水硫酸镁干燥过夜。过滤,滤液浓缩,进行柱层析,洗脱液蒸去溶剂,油泵抽干,用少量的石油醚溶解,放置-20℃冰箱中过夜后,油泵抽去石油醚,得到目标化合物。
路线(2)为DCC 法[12]:将5.0 mmol 布洛芬溶于10 mL 氯仿,置于50 mL 单颈瓶中,加入DCC 5 mmol,室温搅拌0.5 h,加入DMAP 100 mg,搅拌至溶解。室温继续搅拌0.5 h,分别加入丹皮酚或2-羟基苯乙酮、3-羟基苯乙酮、2-羟基-5-甲氧基-苯乙酮、3-甲氧基苯酚5mmol,反应48 h,过滤,滤液浓缩,进行柱层析,洗脱液蒸去溶剂,油泵抽干,得到目标化合物。
1.2.2 抗炎活性的测定[13]
采用二甲苯致小鼠耳廓肿胀法:受试化合物A、B、C、D、E 和布洛芬均用0.5% CMC-Na 溶液配制成1.59 ×10-3mol/L 的混悬液,油状物溶于总体积5%的二甲亚砜后混悬于0.5% CMC-Na 溶液中。取健康ICR 小鼠60 只,体重20 ±2 g,雌雄各半,随机分为6 组,每组10 只,分别为模型组,阳性药组(布洛芬),受试化合物组。给药前禁食12 h,自由饮水。小鼠灌胃给药,给药容量为0.2 mL/10g。给药1 h后将小鼠右耳廓两侧用微量进样器均匀涂布二甲苯20 μL 致炎,左耳廓做对照。致炎1 h 后将小鼠脱颈椎处死,沿耳廓基线取下两耳,用7 mm 打孔器于同一部位各取下一耳片用电子天平称重,致炎耳片重量减去对照侧耳片重量即为肿胀度。将各组数据进行t 检验,比较组间差异的显著性。并将对照组与给药组进行统计学分析处理。按下式计算抑制率(%):
抑制率%=(对照组平均肿胀度-给药组平均肿胀度)/对照组平均肿胀度×100%
2 结果与讨论
2.1 合成路线的选择
酚羟基与羧基的缩合方式有很多,较常用的有酰氯法和DCC 法。其中酰氯法产物除了酰氯外均为气体,往往不需提纯即可应用,纯度好,产率高。但是如果所生成酰氯的沸点与氯化亚砜的沸点相近,则与氯化亚砜不易分离;另外此方法氯化亚砜对设备腐蚀严重,生成的酸对环境污染大。而采用DCC 法,用DCC 为脱水剂,DMAP 为催化剂,可以直接与酚制备得到酯,条件温和,简单方便,产率高。而且生成产物除了酯外,即为双环己基脲,它以固体状态析出,经过滤即可除去。本文前期试验中分别采用此2 种方法合成了目标化合物,发现用酰氯法制备,产率较高,但操作步骤复杂,对环境污染较大;而采用DCC 法,虽然产率相对较低,但操作步骤简单,更加环保。经综合比较,最终选用DCC 法。
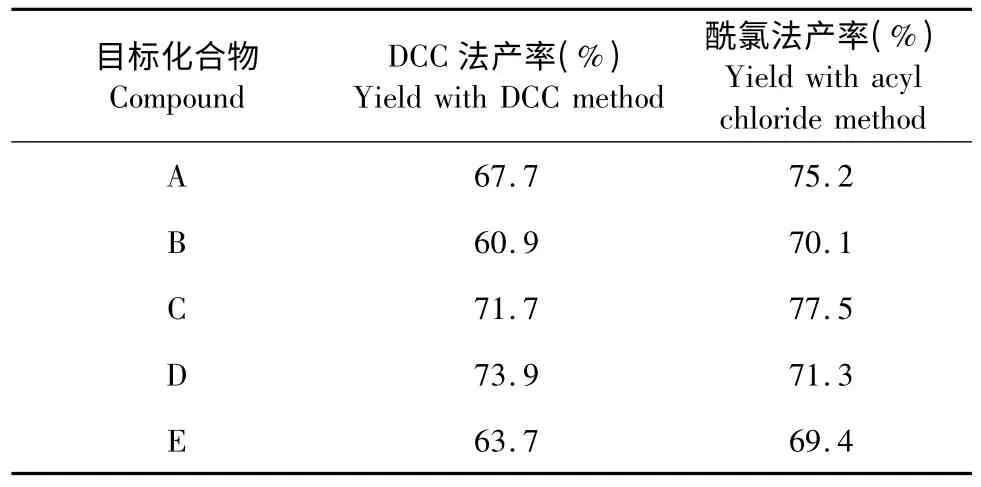
表1 DCC 法和酰氯法目标化合物的产率的比较Table 1 Comparison of the yield of targeted compounds synthesized by DCC and acyl chloride method
2.2 目标化合物A~E 的结构表征:
化合物A 白色结晶;mp.37.1~37.6 ℃;IR(KBr)νmax1683.77(-C=O),1756.43(-C=O)cm–1;1H NMR (400 MHz,CDCl3)δ:7.83 (1H,d,J=8.8 Hz,H-3'),7.33 (2H,d,J=8.1 Hz,H-3,H-5),7.15 (2H,d,J=8.1 Hz,H-2,H-6),6.81 (1H,dd,J=2.5 Hz,J=8.8 Hz,H-4'),6.47 (1H,d,J=2.5 Hz,H-6'),4.04 [1H,m,-CH(CH3)COO-],3.83 (3H,s,-OCH3),2.49 [2H,d,J=7.2 Hz,-CH2CH(CH3)2],2.36 (s,3H,-COCH3),1.88[1H,m,-CH(CH3)2],1.67 (3H,d,J=7.2 Hz,-CH3),0.92[6H,d,J=6.6 Hz,-(CH3)2];ESI-MS[M +Na]+m/z 377.2 (calcd for C22H26O4,354.4)。
化合物B 白色固体;mp.36.5~37.5℃;IR(KBr)νmax1686.80(-C=O),1756.43(-C=O)cm–1;1H-NMR (400 MHz,CDCl3)δ:7.81 (1H,d,J=7.7 Hz,H-3'),7.61 (1H,d,J=8.2 Hz,H-5'),7.46 (1H,t,J=7.9 Hz,H-6'),7.33 (2H,d,J=7.9 Hz,H-3,H-5),7.23 (1H,dd,J=2.0 Hz,J=8.0,H-4'),7.18 (2H,d,J=7.9 Hz,H-2,H-6),3.97[1H,q,J=7.1 Hz,-CH(CH3)COO-],2.59(3H,s,-COCH3),2.50[2H,d,J=7.2 Hz,-CH2CH(CH3)2],1.88[1H,m,-CH(CH3)2],1.64 (3H,d,J=7.1 Hz,-CH3),0.93 [6H,d,J=6.6 Hz,-(CH3)2];ESI-MS[M +Na]+m/z 347.2 (calcd for C21H24O3,324.4)。
化合物C 黄色油状物;IR (KBr)νmax1689.82(-C=O),1762.49(-C=O)cm–1;1H-NMR (400 MHz,CDCl3)δ:7.77 (1H,d,J=7.8 Hz,H-4'),7.49 (1H,t,J=7.7 Hz,H-5'),7.33 (1H,d,J=8.0 Hz,H-2'),7.31 (2H,d,J=8.0 Hz,H-3,H-5),7.17 (2H,d,J=7.9 Hz,H-2,H-6),7.01 (1H,d,J=8.1 Hz,H-6'),4.02 [1H,q,J=7.1 Hz,-CH(CH3)COO-],2.50[2H,d,J=7.2 Hz,-CH2CH(CH3)2],2.36 (s,3H,-COCH3),1.88[m,1H,-CH(CH3)2],1.67 (3H,d,J=7.2 Hz,-CH3),0.92[6H,d,J=6.6 Hz,-(CH3)2];ESI-MS[M +Na]+m/z 347.2 (calcd for C21H24O3,324.4)。
化合物D 黄色油状物;IR (KBr)νmax1683.77(-C=O),1759.46(-C=O)cm–1;1H NMR (400 MHz,CDCl3)δ:7.32 (1H,d,J=8.0 Hz,H-3'),7.30 (2H,d,J=8.1 Hz,H-3,H-5),7.17 (2H,d,J=7.9 Hz,H-2,H-6),7.02 (1H,dd,J=3.0 Hz,J=8.9,H-6'),6.92 (1H,d,J=8.9 Hz,H-5'),4.00[1H,q,J=7.1 Hz,-CH(CH3)COO-],3.83(3H,s,-OCH3),2.48 [2H,d,J=7.2 Hz,-CH2CH(CH3)2],2.30 (3H,s,-COCH3),1.88[1H,m,-CH(CH3)2],1.67 (3H,d,J=7.1 Hz,-CH3),0.91[6H,d,J=6.6 Hz,-(CH3)2];ESI-MS[M +Na]+m/z 377.2 (calcd for C22H26O4,354.4)。
化合物E 黄色油状物;IR (KBr)νmax1687.67(-C=O),1754.26(-C=O)cm–1;1H-NMR (400 MHz,CDCl3)δ:7.33 (2H,d,J=7.8 Hz,H-3,H-5),7.24 (1H,d,J=8.2 Hz,H-5'),7.17 (2H,d,J=7.8 Hz,H-2,H-6),6.77 (1H,dd,J=2.2 Hz,J=8.3,H-6'),6.63 (1H,m,H-4'),6.58 (1H,d,J=8.0 Hz H-2'),3.95 [1H,q,J=7.1 Hz,-CH(CH3)COO-],3.79 (3H,s,-OCH3),2.50 [2H,d,J=7.2 Hz,-CH2CH(CH3)2],1.90 [1H,m,-CH(CH3)2],1.63 (3H,d,J=7.1 Hz,-CH3),0.94[6H,d,J=6.6 Hz,-(CH3)2];ESI-MS[M +Na]+m/z 335.2 (calcd for C20H24O3,312.4)。
2.3 目标化合物(A~E)的抗炎活性
A~E 对小鼠耳廓二甲苯致炎的抑制作用见表2。由表2 数据可以看出,A~E 的抗炎活性均强于模型对照CMC-Na 组和阳性对照布洛芬组。
化合物A~E 均为布洛芬的酯缩合产物,进入体内后存在一个水解释放的过程,到达最高有效的血药浓度时间慢于布洛芬。而本文的抗炎活性测试均在给药后1 h 进行,目标化合物可能尚未完全水解。因此后期计划进行目标化合物的体内释放度的实验,确定目标化合物的释放度与时间的关系,从而找出血药浓度的达峰时间,进一步确认化合物的抗炎活性强弱。至于布洛芬分子中羧基“隐藏”后对胃粘膜的损害是否减少,也将在后期进行实验进一步确认。
表2 目标化合物对二甲苯致炎小鼠耳肿胀的影响(n=10,()Table 2 Effects of targeted compounds on ear-swelling of mice induced by xylene (n=10,()

表2 目标化合物对二甲苯致炎小鼠耳肿胀的影响(n=10,()Table 2 Effects of targeted compounds on ear-swelling of mice induced by xylene (n=10,()
注:与CMC-Na 组比较,* P<0.05,** P<0.01;与布洛芬组比较,**P<0.05Note:Compare with control,* P<0.01,**P<0.01;Compare with ibuprofen,**P<0.05
1 Chinese Pharmacopoeia Commission (国家药典委员会).Pharmacopoeia of the People’s Republic of China (中华人民共和国药典).Beijing:China Medical Science Press,2000,193.
2 Kim HS,Kim AS,Lee JM,et al.A mixture of Trachelospermi caulis and Moutan cortexradicis extracts suppresses collageninduced arthritis in mice by inhibiting NF-(B and AP-1.J Pharm Pharmacol,2012,64(3):420-429.
3 Peng LH,Liu S,Xu SY,et al.Inhibitory effects of salidroside and paeonol on tyrosinase activity and melanin synthesis in mouse B16F10 melanoma cells and ultravivioletB-induced pigmentation in guigea pig skin.Phytomedicine,2013,20(12):1082-1087.
4 Zhang JZ(张竞之),Chen XY(陈小忆),Jin WX(金伟孝),et al.Effects of peaonol on activity and changes of HU-VEC-C in patients with blood stasis syndrome of hypertension.J Liaoning Univ TCM(辽宁中药大学学报),2012,14(6):29-31.
5 Fu PK,Wu CL,Tsai TH,et al.Anti-inflammatory and anticoagulative effects of paeonol on LPS-induced acute lung injury in rats.eCAM,2012,2012:1-12.
6 Kim SH,Kim SA,Park MK,et al.Paeonol inhibits anaphylactic reaction by regulating histamine and TNF-a.Int Immunopharmacol,2004,4(2):279-287.
7 Wang B,Yan G.Structure and antitumor(LOVO)activity of Cortex moutan heteroglycan and curcumin.Carbohydr Polym,2011,86:520-525.
8 Chen BD,Ning ML,Yang GS.Effect of paeonol on antioxidant and immune regulatory activity in hepatocellular carcinoma rats.Molecules,2012,17:4672-4683.
9 Chen BY(陈炳阳),Yue RC(岳荣彩),Liu F(刘芳),et al.Acetophenones and antioxidant activity in Cynanchum auriculatum Royle ex Wight.J Pharm Sci,2013,31(5):351-354.
10 Laine L,Smith R,Min k,et al.Systematic review:the lower gastrointestinal adverse effects of non-steroidal anti-inflammatory drugs.Aliment Pharmacol Ther,2006,3(43):751-767.
11 Zhen YM(赵一玫),Xia D(夏丹),Ai CP(艾彩萍),et al.Synthesis and anti-inflammatory activities of ibuprofen derivatives.Chin J Med Chem(中国药物化学杂志),2005,15(6):360-363.
12 Han YP(韩永萍),Lu J(卢晶),Zhang H(张欢),et al.Study on the preparation of salicylate ester of chitooligosaccharide by DCC condensation method and its anti-bacterial function.Chem World(化学世界),2011,3:155-159.
13 Ao GZ(敖桂珍).Studies on design,synthesis and anti-inflammatory activity of (-substituted p-methyl sulfonyl propenonic acid and related compounds.Nanjing:China Pharmaceutical University(中国药科大学),PhD.2002.

