南蛇藤活性成分Nimbidiol 抑制血管新生作用研究
白殊同,邓秋狄,谢 扬,唐雯慧,高皖皎,佟 丽*
1南方医科大学中医药学院;2 南方医科大学药学院,广州 510515
卫矛科南蛇藤属植物具有多种生物学活性,其中南蛇藤抗类风湿关节炎、抗肿瘤等多种药理学活性已被证明[1,2]。近期有研究表明,南蛇藤有抑制肿瘤细胞增殖及抑制肿瘤血管新生(Angiogenesis)作用[3],但物质基础尚未阐明。本课题组前期研究中,从南蛇藤总萜成分中分离出一个活性成分,通过1H NMR 和13C NMR 分析,鉴定该成分结构与Nimbidiol 相同(分子式:C17H22O3,分子量274.1524)。采用模式生物斑马鱼斑和大鼠动脉环实验对其生物活性进行筛选,观察了南蛇藤活性成分Nimbidiol 对斑马鱼节间血管发育及对大鼠动脉环生长情况的影响,为明确南蛇藤抑制血管新生作用确定了物质基础。
1 材料与方法
1.1 药品试剂与仪器
南蛇藤(Celastrus aculeatus Merr.)由华南植物园叶华古研究员采集并鉴定。Nimbidiol(由南方医科大学药学院谢扬教授,分离提取鉴定后提供);靛玉红(中国药品生物制品检定所,批号:1107171-200204);血管内皮生长因子(VEGF,Vascular endothelial growth factor,PeproTech 公司);新生牛血清(GIBCO 公司);Matrigel 胶(BD 公司);DMEM 高糖培养基(GIBCO 公司);胚胎培养水(Egg water,南方医科大学生物学教研室提供);二甲基亚砜(DMSO分析纯,南方医科大学试剂中心);苯硫脲(PTU,Sigma 公司);磷酸盐缓冲液(PBS,武汉博士德生物工程有限公司);高效液相色谱仪(HPLC,Agilent 公司);高速逆流色谱仪(HSCCC,上海Tauto 生物科技公司);核磁共振波谱仪(NMR,600M,Bruker 公司);电子轰击源-高分辨质谱仪(EI-HR-MS,Thermo Scientific 公司)。
1.2 实验动物
SPF 级SD 大鼠,雄性,体质量160~180 g,购买于南方医科大学实验动物中心(合格证号:SCXK 粤2011-0015);Fli1-GFP(+/ +)雄性转基因斑马鱼、AB 型雌性斑马鱼(南方医科大学生物学教研室提供)。斑马鱼饲养于斑马鱼养殖系统(北京爱生公司)内,培养水pH 值7.4,水温28.5 ℃。斑马鱼每天接受日光灯照射14 h,黑暗环境10 h,每天由实验室饲养人员喂食三次。
1.3 Nimbidiol 的提取分离及鉴定
过山枫原药材烘干粉碎,过60 目筛得粗粉。粗粉经95%乙醇浸泡、回流提取、滤液减压浓缩得乙醇提取浸膏。将乙醇浸膏分散于水中,用超声加热并使其均匀分散,用石油醚、氯仿萃取后再用乙酸乙酯萃取,得乙酸乙酯部位;乙酸乙酯部分用大孔树脂层析柱(9 ×40 cm),进行分离和筛选,先用蒸馏水进行冲洗,然后再用80%乙醇进行洗脱,将洗脱液进行减压浓缩,得浓缩物1;浓缩物1 用硅胶柱(4.5×65 cm)层析进行分离,洗脱液比例为石油醚∶丙酮=50∶1~5∶1(洗脱液均为体积比),对5∶1 部位收集液进行合并浓缩,得浓缩物2;浓缩物2 用硅胶柱(1.2 ×70 cm)层析进行分离,洗脱液:石油醚∶乙酸乙酯=8∶1~6∶1,其中对中间比例部位收集液进行合并浓缩,得浓缩物3;制备薄层色谱法得到浓缩物3,展开剂选择为石油醚∶丙酮(3∶1),得单体化合物1。化合物1 溶于甲醇,以高效液相色谱法(HPLC)检测化合物1 含量,其纯度为95%;以1H NMR 和13C NMR 对化合物1 进行结构鉴定。
化合物1(结构见图1),分子式(C17H22O3);mp.171~175 ℃;EI-HR-MS m/z:274.1524 m/z(rel.int.%):274 (M+,99),259 (100),217 (32),203 (24),191 (78),189 (94),177 (57),163(23),69 (51),57 (30),55 (24);1H NMR (CDCl3,600 MHz)δ:7.62 (1H,br,H-14),6.83 (1H,br,H-11),2.15 (1H,m,H-5),2.54-2.66 (2H,dd,H-6),1.71 (1H,overlapped,H-1a),1.64 (1H,m,H-1b),1.78 (1H,m,H-2a),1.48 (1H,overlapped,H-2b),1.22 (1H,m,H-3a),1.43 (1H,m,H-3b),1.14(3H,s,H-15),0.94 (3H,s,H-16),0.88 (3H,s,H-17);13C NMR (CDCl3,150 MHz)δ:37.9 (C-1),32.5 (C-2),41.3 (C-3),33.2 (C-4),49.8 (C-5),35.9 (C-6),200.6 (C-7),123.7 (C-8),142.2 (C-9),37.8 (C-10),110.1 (C-11),151.4 (C-12),152.4 (C-13),113.6 (C-14),18.9 (C-15),21.3(C-16),23.2 (C-17)。鉴定结果提示化合物1 与Nimbidiol 一致[4]。
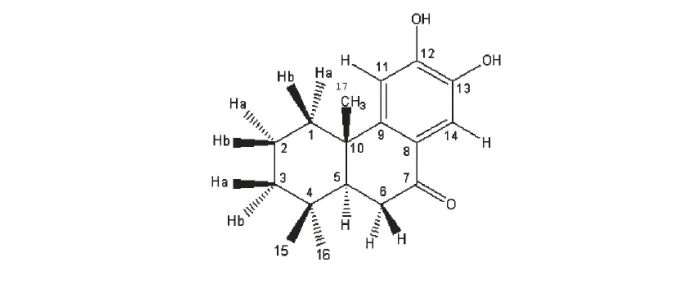
图1 Nimbidiol 的化学结构Fig.1 Chemical structure of nimbidiol
1.4 斑马鱼胚胎培养及药物浓度配制
实验前一天,挑选Fli1-GFP (+/ +)转基因斑马鱼与AB 型斑马鱼,以1:2 的比例分别放入交配盒中,以挡板将雌雄斑马鱼分隔,放置过夜。第二天早晨,取出交配盒挡板,光照刺激促使斑马鱼交配产卵。斑马鱼产卵后,收集半小时内的胚胎,移入到洁净培养皿中,并加入适量胚胎培养液,置于28.5 ℃孵化箱培养。胚胎发育11 h 后,筛选健康胚胎,用于试验。
将胚胎移入28.5 ℃生化培养箱中孵化11 h 后用于实验。将10 mg Nimbidiol 溶于100 μL 的DMSO 中,然后以胚胎培养水定容做为母液,实验时配成不同浓度工作液(DMSO 含量低于0.1%)。根据预实验结果确定Nimbidiol 药效浓度范围,正式实验时,将Nimbidiol 终浓度每个培养孔分别为12.5 μmol/L、25 μmol/L、50 μmol/L(三组含药培养水中,DMSO 含量均低于0.1%)。以100 μmol/L 终浓度靛玉红为阳性对照组、含0.1% DMSO 培养水为阴性对照组[5]。
1.5 斑马鱼胚胎节间血管形成实验
鱼卵孵化11 h 后移入24 孔板,每孔10 枚,各组设2 复孔。弃孔内培养水,加入900 μL 含PTU培养水(培养水与PTU 体积比1∶1)。根据预实验药物浓度,加入不同浓度药物100 μL,且DMSO 含量控制在体积分数0.1%以下。每孔加入药液后置培养箱中,胚胎继续孵化。待胚胎发育30 h 后,在荧光显微镜下观察胚胎节间血管(Intersegmental Vessels,ISV)发育状况。实验重复三次。
荧光显微镜下观察胚胎ISV 发育状态并拍照记录,对各组胚胎ISV 计数并统计分析;计算ISV 抑制率,抑制率(%)=(阴性对照组ISV 个数-给药ISV个数)/阴性对照组ISV 个数[6]。
1.6 大鼠动脉环试验
取6~8 周龄SPF 级SD 大鼠,颈椎脱臼处死,75%乙醇浸泡15 min,超净工作台内取胸主动脉,放入100 mm 培养皿中,PBS 缓冲溶液清洗2 次,去除动脉外周膜组织和纤维组织,将血管切成1.0~1.5 mm 长的主动脉环,PBS 清洗动脉环2 次,DMEM 高糖培养基漂洗2 次。将动脉环纵切面平行于培养孔底部,放进预先铺有Matrigel 胶的96 孔(50 μL/well),随后每孔加入预先融化的Matrigel 胶70 μL,放入细胞培养箱中(37 ℃,5% CO2)孵育2 h,使胶凝固。待基质胶凝固后,加入含10%新生牛血清的DMEM 高糖培养基(完全培养基)100 μL,每2 d 换液一次,实验第4 d 给药。
设空白对照组、VEGF 对照组(刺激血管内皮细胞增殖,100 ng/mL)、Nimbidiol 高剂量组(50 μM/L)、中剂量组(25 μM/L)、低剂量组(12.5 μM/L);以完全培养基释至VEGF 和药物稀至相应浓度,空白对照组加完全培养基作为对照,其余各组加入100 ng/mL 的VEGF,Nimbidiol 组加入相应浓度的药物,每孔培养基终体积100 μL。完成给药,将96 孔板放回细胞培养箱中继续培养,每2 d 换药一次。给药6 d 后,终止培养,显微镜下(40 ×)观察微血管生长情况,并拍照记录。每组设3 复孔,实验重复3次。
1.7 统计学分析
使用SPSS 13.0 软件,结果以X ±S 表示,采用ONE-WAY ANONA 方法对各组ISV 均数进行统计分析,统计结果以P<0.05 为有统计学差异。
2 实验结果
2.1 Nimbidiol 对斑马鱼胚胎血管发育形态影响
正常发育的斑马鱼胚胎背主动脉荧光清晰可见(图2A),ISV 荧光清晰、无畸形;阳性对照组斑马鱼背主动脉荧光消失,ISV 长度缩短且数量减少,血管生长受到抑制(图2B);Nimbidiol 低剂量组斑马鱼背主动脉荧光可见,ISV 长度均一且数量无明显变化(图2C);Nimbidiol 中剂量组斑马鱼背主动脉荧光消失,ISV 荧光缩短且数量减少,血管生长受到抑制(图2D);Nimbidiol 高剂量组斑马鱼背主动脉荧光消失,ISV 荧光减弱,且数量和长度均减少,提示血管生长受到显著抑制(图2E)。

图2 胚胎发育30 h 后,各组斑马鱼胚胎发育节间血管发育状态Fig.2 The development state of internode blood vessel in zebrafish embryo (30 h)
2.2 Nimbidiol 对斑马鱼胚胎节间血管数的影响
对各组ISV 均数比较可见,与阴性对照组比较,Nimbidiol 高、中、低剂量组斑马鱼胚胎,节间平均血管数量减少,血管生长呈抑制状态,且具有统计学差异(F=24.773,均P<0.05。结果见表1)
2.3 Nimbidiol 对大鼠动脉环血管生成的影响
动脉环经9 d 培养后,空白对照组动脉环周围内皮细胞增殖,出现条索状血管芽,最终形成新生微血管(图3A);以VEGF 刺激血管内皮细胞增殖,实验周期结束后,VEGF 组动脉环周围出现大量新生微血管结构,排列紧密(图3B);经Nimbidiol 低、中、高剂量处理后的动脉环,周围内皮细胞增殖减少,毛细血管样结构生成降低,微血管数量降低(图3C、D、E),且抑制效果与给药剂量具有依赖关系。
表1 Nimbidiol 对斑马鱼节间血管数量的影响()Table 1 Effect of nimbidiol on internode vessels number of zebrafish ()

表1 Nimbidiol 对斑马鱼节间血管数量的影响()Table 1 Effect of nimbidiol on internode vessels number of zebrafish ()
注:与阴性对照组比较,* P<0.05Note:compared with negative control group,* P<0.05

图3 Nimbidiol 对大鼠动脉环新生血管的影响Fig.3 Anti-angiogenesis effect of nimbidiol on new blood vessels formation around arty rings
3 讨论
类风湿关节炎(Rheumatoid Arthritis,RA)是一种发病机制尚未阐明的自身免疫系统疾病,临床表现为对称性的关节滑膜炎性增生,最终造成软骨和骨组织侵蚀。RA 患者滑膜组织呈类肿瘤样过度增殖,并伴有炎性细胞浸润,同时导致滑膜组织内出现大量新生血管。大量新生血管的出现,对RA 的发展起促进作用,新形成的血管为滑膜组织提供氧气、营养,同时血管内皮细胞分泌大量细胞因子、炎性因子,持续刺激滑膜组织,加重增生并形成血管翳,侵蚀关节面和关节软骨,并最终破坏关节软骨和软骨下骨,使关节畸形并功能损伤[7]。因此抑制滑膜新生血管的形成,能够延缓类风湿关节炎病情发展,减轻骨关节损伤。
南蛇藤抗类风湿关节炎实验研究已有很多报道,其相关作用机制与抑制炎症、调节机体免疫及细胞因子水平相关。但南蛇藤对类风湿关节炎滑膜血管新生作用尚未见报到。本研究通过模式生物斑马鱼实验模型,观察南蛇藤活性成分Nimbidiol,发现其在12.5 μmol/L 时,开始出现最低有效浓度的抑制斑马鱼血管形成活性,在一定的给药剂量范围内,随着给药浓度的增加,Nimbidiol 的抑制血管新生效果不断增强并与剂量相关,当给药浓度达到50 μmol/L 时,Nimbidiol 药效最强,如继续加大给药剂量,药物开始出现胚胎毒性,出现死胎现象。
在正常的生理条件下,血管内皮细胞处于一种相对静止状态;然而,当出现病理条件(如:RA)或者生长因子刺激的情况下,血管内皮细胞的活动增强。通过大鼠动脉环实验,观察Nimbidiol 对大鼠动脉环新生血管形成的影响;实验结果表明,在体外条件下,12.5~50 μmol/L 浓度范围内的Nimbidiol,能够抑制VEGF 诱导的动脉环周围内皮细胞的迁移和增殖,从而减少管腔状微血管的形成和抑制血管新生过程。实验结果提示,Nimbidiol 具有明显的抑制血管新生作用。
综上所述,Nimbidiol 在12.5~50 μmol/L 浓度范围内,能够有效抑制斑马鱼胚胎节间血管发育和大鼠动脉环周围血管新生过程,具有明显的抗血管新生作用。Nimbidiol 的抗血管新生活性,是南蛇藤抑制RA 重要活性成分之一,也表明了南蛇藤萜类成分是其抗RA 和抗肿瘤作用的物质基础,但其作用机制尚未阐明,推测其作用与抑制VEGF 信号通路活化有关,有待进一步研究证实。
1 Yang MM(杨蒙蒙),Tong L(佟丽),Chen YY(陈育尧).The experimental study on the treatment on adjuvant -induced arthritis with NST ethanol extract rats.Lishizhen Med Mater Med Res(时珍国医国药),2008,19:2917-2918.
2 Ji X(季雪),Qian YY(钱亚云),Zhang H(张华)et al.Effects of three TCM with sweet-flavor,cool-nature and meridian tropism in lung on the cAMP,cGMP of lung-yin deficiency rats.Pharmacol Clin Chin Mater Med (中药药理与临床),2012,28:90-97.
3 Hou Y(侯莹),Yuan L(员林),Qian YY(钱亚云).Celastrus orbiculatus extract inhibits the xenograft tumor growth of HepA1-6 hepatoma in mice.Tumor(肿瘤),2011,31:999-1003.
4 Xie Y,Ding ZB,Duan WJ,et al.Isolation and purification of terpenoids from Celastrus aculeatus Merr.by high-speed counter-current chromatography.J Med Plants Res,2012,6:2520-2525.
5 Sung JJ,Jeon J,Jin JS,et al.Zebrafish Jak2a plays a crucial role in definitive hematopoiesis and blood vessel formation.Biochem Biophys Res Commun,2009,378:629-633.
6 Han LW(韩利文),Wang SF (王思锋),Wang JN(王加宁),et al.Inhibitory effect of a novel tyrosine kinase inhibitor BSSD-1 on angiogenesis of zebrafish embryo and tumor growth of HT-29 colon cancer xenografts in nude mice.Chin Pharmacol Bull(中国药理学通报),2011,10:1434-1438.
7 Wang QT(汪庆童),Ma YK(马昱琨),Huang P(黄蓓),et al.Protective effect of AE3 on anoxia preconditioning Via NO pathway in rat cardiomyocytes.Chin Pharm Bull (中国药理学通报),2012,28:43-47.

