胱氨酸干预下AD 模型鼠海马CA1区神经干细胞凋亡影响因子NPM 表达变化情况
李丛言,盛宝英,韩 凤,齐志国,张瑞雪
阿尔茨海默病(Alzheimer’s disease,AD)是神经退行性病变,其主要表现以痴呆为主,经研究表明其为变异性疾病所致的退行性改变,与年龄有一定相关性。生活能力减低、记忆和认知功能成时间性减退,并有不断加重的趋势,同时伴有行为的改变和精神神经改变。据不完全统计,在全球阿尔茨海默病发病率呈上升趋势[1~3]。其发病机制的研究在医学科研中逐渐被重视并予以极大的关注,但其具体的发病机制还不是十分清楚,治疗也缺乏有效的方法,对人类健康造成极大的危害。本实验研究的目的是观察胱氨酸在AD 模型鼠中的治疗作用及其可能的机制。为AD 的治疗提供有益的临床思路。
1 实验材料及方法
1.1 实验动物和药品 大连医科大学动物实验中心提供清洁级Wistar 大鼠66 只。凋亡检测试剂盒,购于同仁化学研究所。NPM 抗体,购于武汉博士徳生物工程有限公司。Aβ1-40购自上海瑞奇生物科技有限公司。胱氨酸购于Labsigma co.ltd,其他试剂为实验室常用试剂。
1.2 实验方法
1.2.1 动物分组及模型制备 将Wistar 大鼠66 只,随机分为3 组,一组为正常组(n=6);一组为AD 模型组(n=30)和胱氨酸治疗组(n=30)。将60只大鼠固定于脑立体定位仪上,前囟后3.8 mm,中线左2 mm,脑表面进针3 mm,缓慢注射2 min,2 μl 凝聚态Aβ1-40(10 μg·μl-1),留针10 min,缓慢拔出,缝合切口,术后大鼠在低温下苏醒。再对60 只大鼠进行行为学验证,并将筛选出的AD 模型组,胱氨酸治疗组行腹腔注射胱氨酸,60 只大鼠行NPM 的相关染色和检测。Morris 水迷宫检测AD 模型大鼠。Morris水迷宫:圆形水池直径120 cm,深50 cm,水温21 ℃±1.5 ℃。任选一象限在其中央放置平台,平台无色透明,直径6 cm,高30 cm,液面高于平台2 cm,水池周围参照物固定。训练包括:定位航行实验:历时45 d,每半日为一段,每个段试验4 次,将Wistar 大鼠分别从4 个象限入水,记录其找到平台时间(逃逸潜伏期,Latency escape)与游泳路径。空间探索实验:第5 天下午撤除平台,观察120 s 内双转基因小鼠第一次穿越平台坐标的时间、穿越平台次数、游泳路径等。
1.2.2 给药方法 为了使给药后胱氨酸在AD模型大鼠达到较为理想的药物浓度,本实验根据有关说明及该药药品说明书中药代动力学的相关内容,将胱氨酸溶于灭菌注射用水(50 mg/ml),采用腹腔注射的方法对胱氨酸组AD 模型大鼠给予注射胱氨酸(150 mg/kg/day),1 d、3 d、7 d、14 d、21 d 这几个时间点给予胱氨酸组AD 模型大鼠腹腔注射等剂量的胱氨酸。
1.2.3 免疫印迹法 (Western-blot)检测AD模型大鼠海马区NPM 因子的表达。免疫印迹(immunoblotting)又称蛋白质印迹(Western blotting),是根据抗原抗体的特异性结合检测复杂样品中的某种蛋白的方法。该法是在凝胶电泳和固相免疫测定技术基础上发展起来的一种新的免疫生化技术。由于免疫印迹具有的高分辨力和固相免疫测定的高特异性和敏感性,现已成为蛋白分析的一种常规技术。免疫印迹常用于鉴定某种蛋白,并能对蛋白进行定性和半定量分析。结合化学发光检测,可以同时比较多个样品同种蛋白的表达量差异。
1.2.4 r-tPCR 检测AD 模型大鼠海马区NPM基因的表达 参照文献[4]设计跨NPM 基因第12 外显子的PCR 引物,上游引物:5’-TTA ACTCTCTGGTGGTAGAATGAA-3’;下 游 引 物:5’-CAAGACTATTTGCCATT CCTAAC-3’,产物大小为560 bp。PCR 扩增体系为20 μl,PrimeSTAR DNA Ploymerization 0.5 U。反应条件:95 ℃预变性5 min 后,98 ℃30 s,55 ℃1 min,72 ℃1 min,共35 个循环,最后72 ℃延伸10 min。PCR 扩增产物经1.5%琼脂糖凝胶电泳检测,并将产物纯化后进行测序鉴定。在判定结果时,用循环阈值(cycle threshold,CT)作为临界点,该点位于PCR 产物进入指数增长期的起始点。50 μl PCR 反应体积中,含5XPCR 反应液[50 mmol/ L Tris-HCl(pH8.3)、10 mmol/L MgCl2、250 mmol/L KCl、1 mg/ml 明胶]10 μl,mdr-1 上下游引物各15 pmol/L,荧光探针10 pmol/L,Taq 酶3 U和不同样本自100 ng RNA 逆转得到的cDNA,同时将定量模板梯度稀释,作标准曲线,在 ABI PRISM7700 型实时检测扩增仪上进行扩增,反应条件为93 ℃预变性3 min,93 ℃40 s,55 ℃120 s 共作40 个循环。反应结束后用计算机将样本与标准曲线对比得出NPM 基因表达的拷贝数。
1.2.5 TUNEL 凋亡细胞检测 根据TUNEL试剂盒操作方法行石蜡包埋各组大鼠海马CA1区组织切片染色,选取高倍视野(400 ×)下6 个视野平均阳性细胞数,以均数±标准差行组间对比。
2 结果
2.1 水迷宫的行为学变化 在定位航行试验中,AD 模型大鼠的平均逃逸潜伏期显著长于正常组大鼠(P <0.01)。在空间探索实验中,AD 模型大鼠在120 s 内穿越原平台位置的次数显著少于正常组小鼠(P <0.01)。在定位航行试验中,胱氨酸干预下AD 模型大鼠的平均逃逸潜伏期显著短于AD模型大鼠(P <0.01)。在空间探索实验中,胱氨酸干预下AD 模型大鼠在120 s 内穿越原平台位置的次数较AD 模型大鼠明显增多(P <0.05)(见表1)。
2.2 海马CA1区NPM 因子表达的变化 注射胱氨酸3 d 后,胱氨酸治疗组大鼠较AD 模型大鼠NPM 因子的表达明显增加(P <0.01),具有统计学意义,于14 d 达到高峰,此后虽呈现下降趋势,但仍维持在较高水平(见表2)。
2.3 海马CA1区细胞凋亡的变化 实验进行7 d后,AD 模型组大鼠海马CA1区细胞凋亡数明显高于正常对照组(P <0.01),具有统计学意义,并于14 d后达到高峰,并持续到21 d。经胱氨酸干预后7 d时细胞凋亡数减少(P <0.05),于14 d 后达到最低(P <0.01),21 d 时细胞凋亡数较干预14 d 时有所增加(P >0.05)(见表3)。
表1 Morris 水迷宫各实验组平均穿越次数(次,n=6,)

表1 Morris 水迷宫各实验组平均穿越次数(次,n=6,)
与正常对照组比* P <0.01;与AD 组比#P <0.01
表2 实验不同时间点海马CA1区NPM 因子表达的变化(OD 值,n=6,)

表2 实验不同时间点海马CA1区NPM 因子表达的变化(OD 值,n=6,)
与正常对照组比△P <0.05;与正常对照组比* P <0.01;与AD 组比#P <0.01
表3 不同时间点各组海马CA1区细胞凋亡计数(个,n=6,)
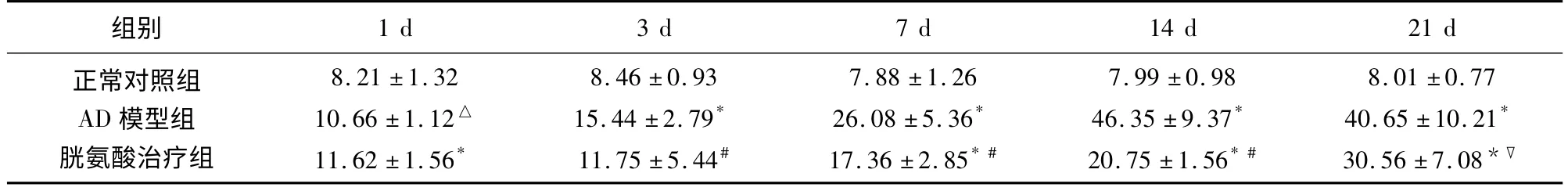
表3 不同时间点各组海马CA1区细胞凋亡计数(个,n=6,)
与正常对照组比△P <0.05;与正常对照组比* P <0.01;与AD 组比▽P <0.05;与AD 组比#P <0.01
3 讨论
Alzheimer 病(AD)是神经元丧失的神经退行性变。由于缺乏有效的治疗方法,在发达国家AD 已成为继心脏病、癌症和卒中之后人类第四位的死因。该病的临床特点是近期记忆和智力功能进行性恶化。神经病理学特点是在大脑皮质和海马出现大量的老年斑(senile plaque,SP)和神经元纤维缠结(neurofibrilary tangle,NFT),并伴随出现神经元丧失。近年来许多资料表明,细胞凋亡(apoptosis)即程序性细胞死亡(programmed cell death,PCD)过多,引起神经元丧失是脑组织退行性疾病发生的原因之一,内外因素激活细胞自身基因程序而引起神经元凋亡。有实验研究表明,Aβ1-40能够诱导脑内皮质神经元的程序性细胞死亡,并出现级联反应,从而诱导更多的神经元发生凋亡,导致神经功能丧失[5,6]。在本实验中发现Aβ1-40使大鼠海马CA1区神经干细胞凋亡增加,减少了同源性神经细胞的生理性补充作用。神经干细胞的丢失也可能参与了神经缺损的修复功能的减低。在神经细胞受损后的保护机制中,神经细胞能够通过产生核磷蛋白(NPM),后者通过间接途径发挥抗凋亡作用,抵抗脑缺血损伤,使细胞得以存活。要挽救走向凋亡的神经元,保护脑功能,进行药物干预加强NPM 的表达也许会是一种可行的方法。Aβ1-40损伤减少了NPM 的表达,从而削弱了其保护作用,诱发了凋亡的发生。
核磷蛋白是一种多功能的蛋白质,参与核糖体的生物合成,控制中心体复制,具有分子伴侣作用,并可通过多种信号通路调节细胞增殖和凋亡。研究发现,NPM 在增殖活跃的细胞中呈过度表达,产生过量核磷蛋白,从而起到抵抗凋亡的作用,虽然没有证据表明NPM 直接参与凋亡机制,但它可通过间接途径参与凋亡调控[7]。目前,有关NPM 在全脑缺血缺氧诱导的神经细胞凋亡方面的作用及机制尚未完全明了,国内外相关的研究还较少。
胱氨酸是一种小分子含二硫键的胺盐,具有抗氧化应激及抑制神经细胞退行性变的作用。近年来国外通过动物、离体细胞实验对帕金森氏病、亨廷顿舞蹈病及阿尔茨海默病等神经退行性病变研究表明胱氨酸可以抑制神经细胞的凋亡,这为研究AD 患者神经干细胞抗凋亡治疗提供新的思路。但是,其抗神经元凋亡机制及具体通路尚未明了,特别是与AD 脑细胞损伤的关系以及调控其表达的各种因素之间的关系目前尚无研究。本实验中可以观察到胱氨酸干预后Aβ1-40对神经干细胞的损伤作用减弱,凋亡发生率减低,同时NPM 表达有所上调,其作用途径是否由于NPM 上调从而起到细胞保护作用还有待进一步研究。
[1]Simon L,Michael P,James C,et al.Genetics,molecular biology,neuropathology and phenotype of frontal lobe dementia:A case history[J].British Journal of Psychiatry,2002,180:455 -460.
[2]Nilsen LH,Mel TM,Saether O,et al.Altered neurochemical profile in the McGill-R-Thy1-APP rat model of Alzheimer’s disease:a longitudinal in vivo 1H MRS study[J].J Neurochemistry,2012,123(4):532 -541.
[3]Rodrigues Elizabeth M,Weissmiller April M,Goldstein Lawrence SB,et al.Enhanced[beta]-secretase processing alters APP axonal transport and leads to axonal defects[J].Human Molecular Genetics,2012,21(21):4587 -4601.
[4]Dohner K,Schlenk RF,Hab dank M,et al.Mutant nucleophosmin(NPM1)predicts favorable prognosis in younger adults with acute myeloid leukemia and normal cytogenetics interaction with other gene mutations[J].Blood,2005,106(12):3740 -3746.
[5]Thathiah A,De Strooper B.The role of G protein-coupled receptors in the pathology of Alzheimer’s disease[J].Nature Reviews Neuroscience,2011,12(2):73 -87.
[6]Bromley B,Kelley S,Song Wei-hong,et al.The role of TMP21 in trafficking and amyloid-[beta]precursor protein (APP)processing in Alzheimer’s disease[J].Current Alzheimer Res,2012,9(4):411 -424.
[7]徐诚望,杨晓明.核磷蛋白与肿瘤的发生[J].军事医学科学院院刊,2008,32(4):382 -385.

