山豆根和苦参生物碱类成分UPLC/Q-TOFMSE 比较研究
曾祖平,郭 智,彭 冰,沈胜楠,夏方博,刘亚旻,潘瑞乐*
1首都医科大学附属北京中医医院北京市中医研究所,北京100010;2中国医学科学院北京协和医学院药用植物研究所,北京100193
山豆根为豆科槐属植物越南槐Sophora tonkinensis Gapnep.的干燥根及根茎,主产于广西、贵州、云南、广东、江西等地,其味苦、性寒、有毒,具有清热解毒、消肿利咽的功效,主治火毒蕴结、咽喉肿痛、齿龈肿痛等症[1]。苦参为槐属植物苦参Sophora flavescens Ait.的干燥根,全国各地均产,其味苦、性寒,具有清热燥湿、杀虫利尿的功效,主治热痢、便血、黄疸尿闭、赤白带下、阴肿阴痒、湿疹、湿疮、皮肤瘙痒和疥癣麻风等症,外治滴虫性阴道炎[2]。两者均为《中国药典》收载的常用中药。现代研究表明山豆根和苦参都含有生物碱、黄酮和三萜类成分,生物碱是山豆根和苦参的主要成分,也是主要的活性成分,且二者所含的生物碱均属于喹诺里西啶类生物碱(quinolizidine)。2010年版《中国药典》规定山豆根和苦参质量控制的定量指标均为氧化苦参碱和苦参碱[1,2]。说明生物碱在山豆根和苦参药材中重要性。
本研究采用高灵敏度的UPLC/Q-TOF MSE技术建立山豆根和苦参中生物碱类成分的定性鉴别、相对定量和聚类分析方法。根据离子流色谱图色谱峰的分子量及其二级质谱碎片离子的裂解规律,结合参考文献进行结构推定,应用主成分分析(PCA)及正交偏最小二乘法(OPLS-DA)进行聚类分析,同时采用面积归一法计算各色谱法的相对含量,以期寻找区分山豆根和苦参中生物碱的特征性成分,为两者临床疗效差异的物质基础提供参考依据。
1 材料与方法
1.1 仪器与试剂
仪器:Acquity UPLC I-class超高效液相系统,Xervo G2 Q TOF质谱系统,Acquity工作站,Masslynx 4.1工作站(沃特世,美国)。Integral 3 Milli-Q超纯水系统(默克密理博,美国),MS105 DU电子分析天平(梅特勒),N1100旋转蒸发仪(东京理化,日本),KQ-250B超声波清洗器(昆山市超声仪器有限公司,中国)。
试剂:Optima LC/MS乙腈(赛默飞,美国),HPLC甲醇(赛默飞,美国)。甲酸,甲酸铵(Sigma,美国);氨水,氯仿(北京化工厂,中国)。其他试剂均为分析纯。
样品:山豆根样品分别采自其主产地广西和云南,苦参样品采自河南省、河北省。以上样品各收集三批,并经中国医学科学院药用植物研究所张本刚教授鉴定拉丁学名。
1.2 供试液的制备
取山豆根/苦参粉末(过40目筛)1.0 g精密称定,置于50 mL具塞茄型瓶中,精密量取含1%氨水氯仿25 mL,密塞,摇匀,放置过夜。超声提取30 min,过滤。残渣清洗3次,合并滤液,回收溶剂,浓缩至干。残渣甲醇溶解,定容于50 mL容量瓶,摇匀。溶液使用0.22μm微孔滤膜过滤,弃去初滤液,取续滤液,即得供试品溶液[3]。每个药材平行制备3份供试品,保存于4℃冰箱备用。
1.3 仪器分析条件
1.3.1 UPLC 分析条件
色谱柱:Acquity UPLC BEH C18(2.1 mm ×150 mm,1.7 μm);保护柱:VanGuand BEH C18(2.1 mm×5 mm,1.7 μm),流动相:乙腈(A),5 mmol/L 甲酸铵水溶液(B)[4],梯度洗脱(0 ~ 10 min,3% ~20%A;10~12 min,20% ~100%A;12~13 min,100%A;13 ~13.01 min,100% ~3%A;13.01 ~15 min,3%A);流速:0.5 mL/min;进样量:1 μL;柱温45℃。
1.3.2 Q-TOFMS 分析条件
正离子,MSE模式;检测范围100~1500 Da;毛细管电压:3 kV,锥孔电压:45 V,裂解电压:40~50 V;锥孔气流量:50 L/h;脱溶剂气流量:800 L/h;源温:100℃;脱溶剂气温度300℃;准确质量测定采用 亮 氨 酸-脑 啡 肽 (Leucine-Enkephalin,m/z=556.2771)溶液作为质量锁定溶液。
1.4 数据分析
将供试品溶液1μL注入UPLC/Q-TOF MSE分析,运行时间为10 min。每个样品平行进样3次。色谱及质谱数据使用沃特世工作站MassLynx4.1软件进行处理。主成分分析(PCA)及正交偏最小二乘法(OPLS-DA)分析采用沃特世工作站MarkerLynx XS软件。
2 实验结果
2.1 山豆根和苦参生物碱总离子流色谱图的指纹比较及主要成分的结构鉴定
在上述色谱-质谱条件下,山豆根和苦参供试液能得到较好分离,质谱信号响应良好。如图1所示,从山豆根和苦参总生物碱离子流色谱图可以直观地看出,两者生物碱成分指纹图谱很相似,色谱图中以最小峰面积为10进行筛选,在山豆根色谱图中可以看到19个色谱峰,在苦参色谱图可以看到26个色谱图,其中有11个主要的色谱峰相同。
根据山豆根和苦参总生物碱提取物总离子流色谱图色谱峰的分子量及其二级质谱碎片离子特征和裂解规律,结合参考文献数据,对总离子流色谱图各个主要峰进行结构推定,从山豆根中推定11个化合物,从苦参中推定12个化合物,其中有10个为二者共有结构。化合物保留时间、名称、分子式、分子量,在苦参和山豆根中相对峰面积及峰面积比值等信息见表1。在药材质量、色谱条件相同时,同一化合物峰面积的大小可以反映其含量的高低,从表1可以看出:山豆根和苦参的10个共有峰的峰面积比值有8个小于1,说明苦参中生物碱的含量多数大于山豆根中的含量。
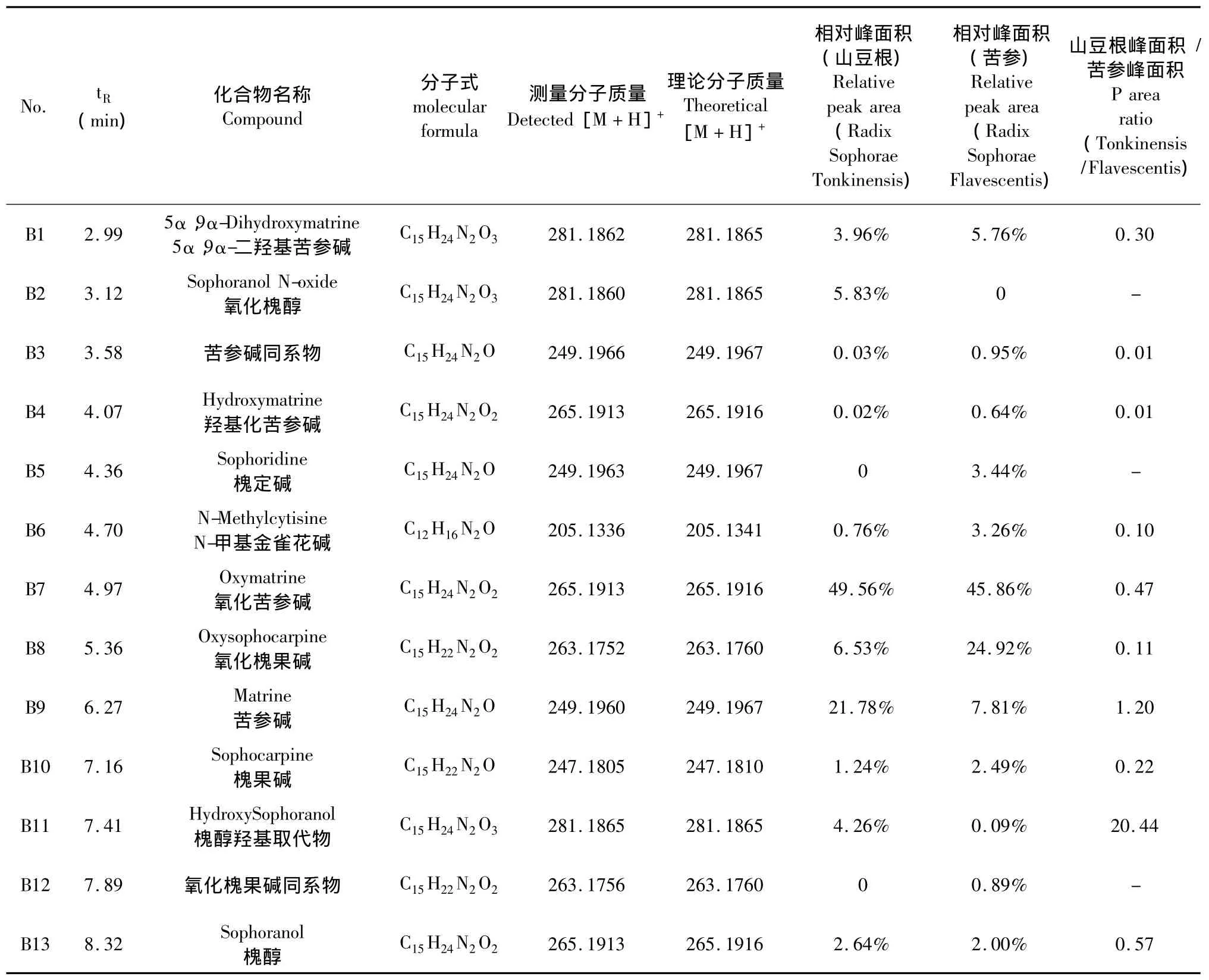
表1 山豆根和苦参总生物碱UPLC/Q-TOFMSE结构鉴定表Table 1 Structural identification of alkaloids in Radix Sophorae Tonkinensis and Radix Sophorae Flavescens using UPLC/Q-TOFMSE

图1 山豆根(右)和苦参(左)总生物碱离子流色谱指纹图及主要化合物的指认Fig.1 Total ion chromatograms of Radix Sophorae Tonkinensis(right)and Radix Sophorae Flavescens(left)
2.2 化合物结构鉴定的质谱解析依据
化合物 B1、B2、B11分子离子峰([M+H]+)m/z=281,参考文献推定它们可能为二羟基苦参碱或者羟基苦参碱的氮氧化物,其一级质谱及二级质谱图谱见表2。由三个化合物的二级质谱可见均含有较高丰度的m/z=148、m/z=150的苦参碱型特征离子峰[5-7],认为均为苦参碱型生物碱。一级质谱中,B2化合物的二倍峰离子([2M+H]+)m/z=561丰度较高,这是氮氧化物的特征性离子峰[8](氮氧化物生物碱一级质谱中[2M+H]+峰丰度较高,羟基生物碱中[2M+H]+峰丰度很低,可以用来区别两种生物碱类型)。结合文献推定B2为氧化槐醇。B1一级质谱中二倍峰离子丰度很低,推定为羟基生物碱,二级质谱图谱中有[M+H-H2O]+m/z=263,[M+H-2H2O]+m/z=245离子峰的存在,结合文献推定B1为5α,9α-二羟基苦参碱。B11中一级质谱中二倍峰离子丰度很低,推定为羟基生物碱,二级质谱中[M+H-2H2O]+峰丰度很低,故推断其容易失去一个羟基,另一个不易失去,可能为邻羟基取代。
化合物B4、B7、B13的分子离子峰([M+H]+)m/z=265,结合文献数据推定它们可能为羟基化苦参碱或者苦参碱的氮氧化物。根据较高丰度的m/z=148、m/z=150的苦参碱型特征离子峰,认为均为苦参碱型生物碱。一级质谱中B7二倍峰离子([2M+H]+)m/z=561丰度较高,结合文献推定其为氧化苦参碱。B4,B13一级质谱中二倍峰离子丰度很低,推定为羟基生物碱。结合文献及保留时间规律,推定B13为槐醇,B4为14或13或9位羟基化苦参碱。
化合物 B5、B9的分子离子峰为([M+H]+)m/z=249。根据较高丰度的 m/z=148、m/z=150的苦参碱型特征离子峰,认为均为苦参碱型生物碱。两图谱中除了丰度差别外其他离子碎片相似,根据文献和含量情况推断B5为槐定碱,B9为苦参碱。根据文献和结合保留时间,含量,分子量,推断B6为N-甲基金雀花碱,B8为氧化槐果碱,B10为槐果碱。

表2 化合物一级和二级质谱数据Table 2 MS and MSE data of the detected alkaloids
2.3 MarkerLynx统计结果
采用沃特世组学工作站MarkerLynx XS软件对山豆根和苦参提取物中的分子离子峰进行PCA分析。然后通过OPLS-DA计算分析,经S-Plot散点图找出引起山豆根和苦参中显著差异的化合物,并通过比较文献推定其结构。
2.3.1 主成分分析结果
山豆根和苦参生物碱部分质谱数据经MarkerL-ynx分析得主成分分析图(图2)。由主成分分析图可见,山豆根和苦参两组样品组内聚集、组间分离良好。

图2 山豆根与苦参生物碱部分正离子模式下主成分分析图Fig.2 PCA plot of alkaloids in Radix Sophorae Tonkinensis and Radix Sophorae Flavescens
2.3.2 正交偏最小二乘法分析结果
主成分分析结果经OPLS-DA计算分析,绘制化合物的S-plot图(图3)。图中散点纵坐标绝对值越大可信度越大,横坐标绝对值越大特征性越强。其中一象限代表苦参,三象限代表山豆根。各化合物散点按照S型排列,位于S两端的点代表引起山豆根和苦参化学成分差异贡献大且可信度高的成分。经鉴定在山豆根中贡献大的化合物有:苦参碱、氧化槐醇、槐醇羟基取代物、氧化苦参碱;苦参中贡献大的化合物有:氧化槐果碱、槐定碱、N-甲基金雀花碱、槐果碱。

图3 山豆根与苦参生物碱正离子模式下正交偏最小二乘法S-plot图Fig.3 OPLSS-plot diagram of alkaloids in Radix Sophorae Tonkinensis and Radix Sophorae Flavescens
3 讨论
为了能准确地反映山豆根和苦参化学成分的差异,我们从山豆根主产地广西和云南,苦参的主产地河北省、河南省等各收集三批样品,通过比较其生药的形态特征,并结合UPLC-PDA色谱指纹图谱(数据未给出),选择山豆根和苦参的代表性样品进行UPLC/Q-TOFMSE研究。
本文的质谱条件参考文献[8]方法,但色谱条件进行了大量的摸索,选择了不同的色谱柱(T3柱,BEH柱),不同的流动相(甲醇,乙腈),不同的缓冲盐(乙二胺,乙酸铵,甲酸铵)和不同的梯度条件等,最终确定了本文的分析方法,几种主要的生物碱类化合物得到较好的分离。
通过山豆根和苦参生物碱总离子流色谱图比较,可以看出山豆根和苦参生物碱类成分的指纹很相似,但苦参中生物碱种类较多,相对含量较高。根据两者生物碱成分结构的推定和相对含量的比较,发现两者主成分均为B1-5α,9α-二羟基苦参碱、B7-氧化苦参碱、B8-氧化槐果碱、B9-苦参碱等。
主成分分析结果表明山豆根和苦参两组样品组内聚集、组间分离良好;经OPLS-DA计算分析,绘制的S-plot图可以看出,苦参碱、氧化槐醇、槐醇的羟基取代物和氧化苦参碱是山豆根区别于苦参的置信度高的主要生物碱成分;而氧化槐果碱、槐定碱、N-甲基金雀花碱和槐果碱是苦参区别于山豆根置信度高的主要的生物碱成分。
通过离子流指纹图谱、化合物相对含量及化合物分布分析,苦参和山豆根的主要差异性成分在两者均有检出,可见造成两者差异的主要原因不是生物碱的类别,而主要是生物碱的含量。本研究结果表明引起山豆根和苦参的临床疗效的差异,可能是生物碱含量的差异,也可能是生物碱以外的其它成分。因此,对山豆根和苦参非生物碱部分的化学成分进行深入研究是非常有必要的。
1 Chinese Pharmacopoeia Commission(国家药典委员会).Pharmacopoeia of the People’s Republic of China(中华人民共和国药典).Beijing:China Medical Science Press,2010.Vol I,25.
2 Chinese Pharmacopoeia Commission(国家药典委员会).Pharmacopoeia of the People’s Republic of China(中华人民共和国药典).Beijing:China Medical Science Press,2010.Vol I,188.
3 Ding PL(丁佩兰).Comparative studies on the chemical constituents of Sophora tonkinensis and Sophora flavescents.Shanghai:Fudan University(复旦大学),PhD.2004.
4 Liu LN(刘丽娜),Sun L(孙磊),Cheng XL(程显隆),et al.Identification ofmatrine and ammothamnine in Picrasmae lignum by high performance liquid chromatography/tandem mass spectrometry.Chin JExp TraditMed Form(中国实验方剂学杂志),2012,4:110-113.
5 Zhang L,Xu L,Xiao SS,et al.Characterization of flavonoids in the extract of Sophora flavescens Ait.by high-performance liquid chromatography coupled with diode-array detector and electrospray ionization mass spectrometry.J Pharm Biomed Anal,2007,44:1019-1028.
6 Liu Q(刘倩),Zhang H(张宏桂),Liu YG(刘永刚),et al.Analysis of chemical components in compound Kushen injection by HPLC-MSn.Chin Tradit Pat Med(中成药),2006,28:1488-1491.
7 Chen HX(陈怀侠),Han FM(韩凤梅),Du P(杜鹏),et al.Electrospray ionization mass spectrometry for analyses of alkaloids in Sophora flavescens Aits.Chin J Anal Chem(分析化学),2006,34:205-208.
8 Zhao QQ(赵琴琴),Zhang YF(张玉峰),Fan XH(范骁辉).Simultaneous characterization of two types ofmajor active components in Kushen by high performance liquid chromatography coupled multi-stage mass spectrometry.Chin J Chin Mater Med(中国中药杂志),2011,6:762-769.

