黄芩素脂质体冻干粉的制备及初步评价
徐东伟 刘同祥
1.中央民族大学医院药剂科,北京 100081;2.中央民族大学中国少数民族传统医学研究院药物化学所,北京 100081
黄芩素(Baicalein)是黄酮类化合物,唇形科植物主要有效成分之一,具有抗菌、抗氧化,抗病毒、保肝利胆、抗肿瘤等广泛的药理活性,是一种具有很好应用前景的药物,目前临床上主要用于抗菌消炎及抗感染。但由于其水溶性与脂溶性较差,体内生物利用度低,限制了其临床应用[1-3]。
为了有效提高生物利用度,改善其口服吸收,将黄芩素制成脂质体,利用磷脂形成的脂质双分子层与生物膜相似,其具有良好的组织相容性和细胞相容性,囊泡包裹的药物分子也易被机体吸收,解决了脂溶性药物难溶于水的问题。不稳定的药物被脂质体包封后受到脂质体双层膜的保护,提高了易氧化药物在体内外的稳定性,具有生物降解性和生物相容性。本课题以脂质体作为药物载体,制备了黄芩素脂质体冻干剂,为黄芩素进一步拓展新剂型奠定了良好基础[4-5]。
1 仪器与材料
1.1 仪器
L-2000Elite型高效液相色谱仪(日立高新技术集团);LGJ-10真空离心浓缩干燥机(北京松源华兴科技发展有限公司);Mastersizer2000激光粒度测定仪(英国Malvern公司);UV-9100型紫外分光光度计(北京普析通用仪器有限责任公司);EM-1400高衬度透射电子显微镜(日本电子公司);RE-52A型旋转蒸发仪(上海亚荣生化仪器厂);KQ-250B型超声波清洁器(昆山市超声仪器有限公司);LD4-2A低速离心机(北京医用离心机厂);AL204电子天平(梅特勒-托利多仪器有限公司);DF-101S恒温磁力搅拌器(郑州市亚荣仪器有限公司)。
1.2 材料
透析袋(美国联合碳化公司,截留相对分子质量8 000~14 000 D;批号:20141108);大豆卵磷脂(上海太伟药业有限公司;批号:20141027);黄芩素(西安瑞迪生物科技有限公司;纯度≥ 98%;批号:20140129);胆固醇(中国医药集团上海化学试剂公司;批号:20140109);Sephadex G-50(上海蓝季科技发展有限公司;批号:20141220);吐温80(天津市永晟精细化工有限公司);甲醇,乙酸,乙腈为色谱纯,其他试剂均为国产分析纯或药用。
2 方法与结果
2.1 黄芩素脂质体的制备
采用乙醇注入法制备黄芩素脂质体[6-7]。精密称取20 mg胆固醇、80 mg卵磷脂、2 mg黄芩素原料药于小烧杯中,加入5 mL无水乙醇,超声混匀。在涡旋条件下,将所得混合液用10.0 mL注射器以1 mL/min匀速注入55℃的10 mL磷酸盐缓冲液(PBS)(pH=7.4,下同)溶液中,超声1 min后倒入小烧杯,加入转子,磁力搅拌器上慢速搅拌,除去乙醇(溶液体积小于10 mL),再次超声至体系均匀,得到黄色的带有淡黄色乳光的混悬液,过0.45 μm微孔滤膜,即得样品,4℃下保存,备用。空白脂质体除不加药物外,其他条件一样。
2.2 黄芩素的含量测定方法
精密称取黄芩素1 mg,置于10 mL量瓶中,用无水乙醇稀释得0.1 mg/mL储备液。取该储备液适量,用无水乙醇稀释成浓度分别为 1、3、5、7、9、11 μg/mL 的对照品溶液,并在276 nm处测定各溶液的吸光度值(A),以浓度(C,μg/mL)为 X 轴,吸光度(A)为 Y 轴进行线性回归,回归方程:A=0.1673 C-0.0624(r=0.9994),溶液在 1~11 μg/mL 线性关系良好。低、中、高浓度(1、5、11 μg/mL)的标准溶液日内、日间相对标准偏差(RSD)平均值分别为0.27%和0.55%(n=5);低、中、高样品回收率分别为102.08%、99.16%和99.78%(n=3),均符合分析要求。精密吸取300 μL黄芩素脂质体至10 mL量瓶中,无水乙醇稀释至刻度,重复3次测定吸光度,代入标准曲线方程,计算得黄芩素脂质体的平均含药量为(0.20±0.03)mg/mL。
2.3 黄芩素脂质体的质量研究
2.3.1 脂质体的形态及粒径测定 取脂质体混悬液适量,用pH 7.4的PBS适当稀释,经激光散射粒度分析仪测定脂质体粒径及分布。结果表明,黄芩素脂质体粒度分布较均匀,平均粒径为(92.1±9.2)nm,多分散性指数(PDI)为0.238,粒径分布见图1。黄芩素脂质体混悬液为带有淡蓝色乳光的半透明黄色溶液。取脂质体混悬液液适量,pH7.4的PBS适当稀释后,用2%磷钨酸溶液负染,自然挥干,在透射电镜下观察脂质体形态并摄制照片,可见脂质体多为球形及类球形粒子,形态圆整,大小均一,见图2。
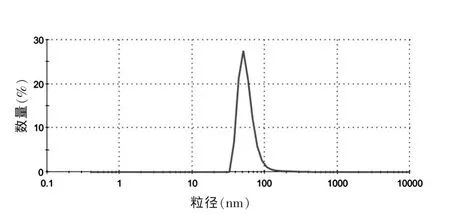
图1 黄芩素脂质体的粒径分布

图2 黄芩素脂质体的透射电镜情况
2.3.2 包封率的测定 采用柱层析法测定包封率,取适量充分溶胀的葡聚糖凝胶G-50,制备层析柱(200 mm×15 mm);精密量取0.5 mL脂质体混悬液上柱,流速为0.5 mL/min,室温操作,以双蒸水洗脱,收集带有乳光的洗脱液,置10 mL量瓶中,用无水乙醇定容,涡旋混匀后,按“2.2”项下方法测定脂质体中包裹的药量W1;另取0.5 mL脂质体混悬液置10 mL量瓶中,同法操作,测定脂质体混悬液中的总药量W0[8-9]。按下式计算包封率(EE%):EE%=W1/W0×100%。计算得3批脂质体的平均包封率为(82.9±1.4)%,RSD 为 0.82%(n=3)。
2.3.3 稳定性参数的测定 将制备好的黄芩素脂质体混悬液,取8 mL置于10 mL的EP管中,3 000 r/min离心20 min后,取下层溶液用无水乙醇适当稀释,以无水乙醇为空白,于276 nm处测定吸光度A0。另取未离心的脂质体混悬液同法稀释后测定A,计算稳定系数K(%)=(A0-A)/A0×100%,K 值越小,则体系的物理稳定性越好[10-11], 反之则越差。结果重复3次,K为(0.1188±0.0300),K值较小,说明该法制备的黄芩素脂质体混悬液的稳定性较好。
2.4 药物体外释放研究
按照《中国药典》2010年版第3法采用透析袋法测定释放度[12-13]。分别取5 mL黄芩素脂质体混悬液(含黄芩素1 mg)和5 mL黄芩素溶液(0.2 mg/mL的乙醇溶液,含黄芩素1 mg)置透析袋中,扎紧两端,置锥形瓶,释放介质为含0.2%吐温80的磷酸盐缓冲液(pH=7.4), 释放体积为 100 mL, 转速为 100 r/min,于(37±0.5)℃进行试验。在预定时间 0、0.5、1、1.5、2、2.5、3、4、6、8、12、24、36 h 取样 1 mL,同时补充等体积同温的释放介质。根据“2.2”项下方法,测量并计算各时间点黄芩素的释放量,以累积释放百分率为纵坐标,取样时间为横坐标绘制释放曲线。5 h内黄芩素原料药已经基本释放完全,而黄芩素脂质体释放不到50%,且释放速度小于原料药,36 h累积释放约80%,具有缓释效果。见图3。

图3 黄芩素脂质体和黄芩素原药的体外释放曲线
2.5 黄芩素脂质体冻干粉的处方优化
为了提高黄芩素脂质体的稳定性,筛选3种不同的冻干保护剂(甘露醇、葡萄糖和乳糖),在黄芩素脂质体混悬液中的浓度分别为3%、5%(W/V),将加有冻干保护剂的混悬液分装至西林瓶中,-80℃预冻12 h,后迅速转移至冷冻干燥机中冷冻干燥24 h即可。以外观、色泽、再分散性为主要评价指标,评分方法见表1,得分多者较佳,同一得分以辅料用量少者为佳[14]。综合指标分见表2,可见处方2分值最高,即用5%的甘露醇作为冻干保护剂制备得到的黄芩素冻干粉,外观饱满,色泽均一,再分散性好。

表1 冻干粉评分标准
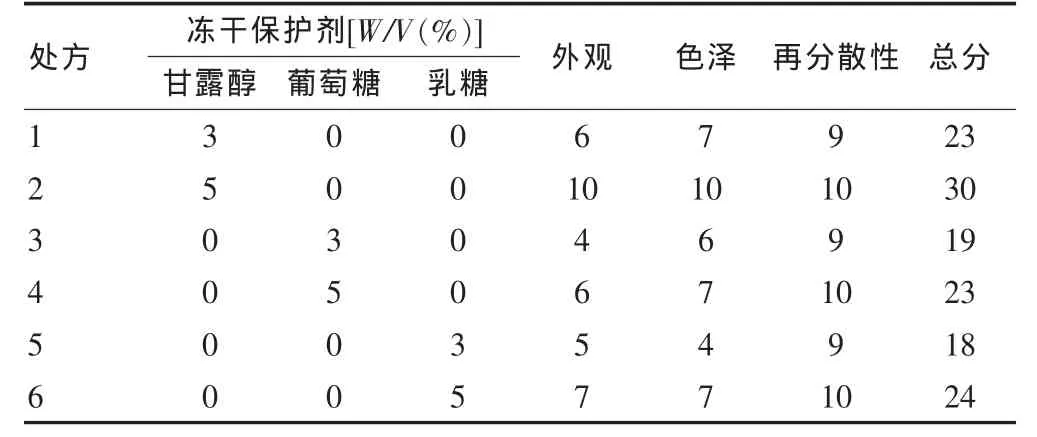
表2 黄芩素冻干粉冻干保护剂的选择
3 讨论
本研究选择pH 7.4的磷酸盐缓冲液作为释放介质,由于黄芩素是水难溶性药物,具有较强的亲脂性,无法满足体外释放所需的漏槽条件,所以在释放介质中加入了表面活性剂0.2%吐温-80,促进其在释放介质中的溶解度。在体外释放过程分为两个阶段,突释阶段和缓释阶段,前者释放快的原因主要是来自未包封的游离药物,而以分子或细小粒子包载在脂质体中内相的药物,需要跨越磷脂双分子层,故而起到了缓释、长效的作用。
一般采用凝胶层析法测定柚皮素脂质体的包封率,但这种方法耗时长并使样品大量稀释而不利于药物含量的测定。柱层析方法由于离心力的作用,加快了脂质体和游离药物的洗脱速度,加之操作简单并可同时操作多份样品,大大缩短了测定时间。同时还有对样品稀释倍数小,减少葡聚糖凝胶用量,样品用量小等优点。
本实验为了降低脂质体粒子的粒径,通过薄膜分散后再经过超声处理,从而减小脂质体的粒径。另外由于其极小的粒径而具有的黏附性,比表面积大,使其易于黏附于肠壁上,增加了药物与肠壁的接触面积和接触时间,有利于药物吸收,增加了难溶性药物的生物利用度[15-20]。
[1]云宝仪,周磊,谢明杰,等.黄芩素抑菌活性及机制的初步研究[J].药学学报,2012,47(12):1587-1592.
[2]辛文妤,宋俊科,何国荣,等.黄芩素和黄芩苷的药理作用及机制研究进展[J].中国新药杂志,2013,22(6):647-659.
[3]王芳.黄芩素对人肝癌HepG2细胞生长的抑制作用[J].中国药房,2014,25(47):4430-4432.
[4]季鹏,赵文明.柚皮素脂质体冻干粉的制备及其药效学评价[J].中国医学科学院学报,2015,37(2):208-214.
[5]季鹏,赵文明.柚皮素脂质体的制备及大鼠肺部给药药动学研究[J].中成药,2015,37(8):1699-1703.
[6]王立华,王永利,张江伟,等.大黄酚脂质体制备方法的研究[J].中国新药杂志,2013,22(12):1452-1454.
[7]赵永新,赵子剑,王邹.羧甲基茯苓多糖脂质体的制备及其包封率的测定[J].中国医药导报,2013,10(3):130-132.
[8]陈道阳,陈晓丹,王利胜.川芎嗪长循环脂质体包封率的测定[J].中国医药导报,2013,10(14):114-116.
[9]刘晓明,闫云宇,毕华.猴头菇多糖脂质体包封率的测定方法及其稳定性研究[J].中国医药导报,2013,10(24):118-120.
[10]柯学,许颖,平其能,等.汉黄芩素脂质体的制备及大鼠体内药代动力学[J].中国药科大学学报,2007,38(6):502-506.
[11]季鹏,赵文明.柚皮素固体脂质纳米粒的制备及体内外初步评价[J].中国新药杂志,2015,24(18):2147-2153.
[12]孟卫东,初瑞雪,顺铂脂质体腹腔缓释化疗治疗S180腹水瘤小鼠肿瘤的临床研究[J].中国医药导报,2012,9(5):21-23.
[13]管晨峰,路伟,张开礼,等.载神经生长因子纳米柔性脂质体透血-脑屏障的研究[J].中国医药导报,2014,11(17):131-133.
[14]向晓琴,杜丽娜,李淼,等.冬凌草甲素粉雾剂的制备及其对大鼠急性肺损伤的治疗[J].国际药学研究杂志,2014,41(2):211-215.
[15]高缘,江鲲,李莉,等.黄芩素纳米混悬液的生物利用度研究[J].中国药科大学学报,2011,42(4):314-318.
[16]顾一珠,周文,翟光喜.葛根素脂质体的研制及其大鼠口服吸收[J].中药材,2007,30(8):970-973.
[17]管庆霞,华晓丹,李伟男,等.载中药肝靶向纳米给药系统的研究进展[J].中国药房,2015,26(7):1002-1005.
[18]曾慧琳,符旭东.多囊脂质体在递药系统中的应用研究进展[J].中国药房,2014,25(37):3526-3528.
[19]魏雪仙,张世川,刘玉璇,等.中药柔性脂质体的制备工艺研究[J].西部中医药,2015,34(7):411-413.
[20]梁立,苟小军,郭晓强,等.橄榄苦苷脂质体包封率测定方法探讨[J].西部中医药,2015,35(14):1286-1289.

