微生物合成γ-聚谷氨酸的相关基因、合成机理及发酵的研究进展
严涛 郗洪生
(江苏恒丰强生物技术有限公司,海门 226100)
微生物合成γ-聚谷氨酸的相关基因、合成机理及发酵的研究进展
严涛 郗洪生
(江苏恒丰强生物技术有限公司,海门 226100)
γ-聚谷氨酸(γ-PGA)是一种天然的氨基酸聚合物,由于其水溶性好、可生物降解、食用,以及对人类、动物和环境无毒等特点,因此,在环境、医药、食品和化妆品、饲料添加剂等领域有广泛的应用前景。主要是对微生物合成γ-PGA所采用的菌株、相关基因、合成机理及发酵方面进行综述。
γ-PGA;基因;机理;发酵
随着人们绿色环保意识的加强,寻找绿色、无污染的新型材料越来越受到关注,而γ-聚谷氨酸(γ-polyglutamic acid,γ-PGA)由于水溶性好,可生物降解与食用,以及对人类、动物和环境无毒的特点,目前已成为生物多聚物中的研究热点之一。γ-PGA是一种水溶性可生物降解的新型绿色生物材料,由D-或L-谷氨酸通过α-氨基和γ-羧基通过γ-酰胺键结合而成的阴离子聚合物。γ-PGA的结构式如图1所示。

图1 γ-PGA的结构式
γ-PGA具有可食用性、无毒性、成膜性、黏结性、保湿性等特点,其应用非常广泛,既可应用于医药、食品和化妆品中,又可以作为保水剂及水果、蔬菜的防冻剂、保鲜剂,还可以作为污水处理的絮凝剂、重金属螯合剂。更重要的是,还可应用于饲料添加剂方面,提高动物对钙、铁、磷等微量元素的吸收,减少动物排泄物对环境造成的污染。γ-PGA的合成方法有化学合成法、提取法和微生物发酵法。其中化学合成法包括传统的肽合成法和二聚体缩合法,由于产物纯度难以控制、副产物比较多,同时产物的相对分子质量比较小,所以限制了该方法的应用;提取法是从日本传统食品纳豆(类似中国的豆豉)中分离得到γ-PGA,由于纳豆中成分复杂,γ-PGA的含量不稳定,使该方法不能广泛运用。目前合成γ-PGA的主要方法是微生物发酵法[1,2],该法工艺相对简单,产物分离纯化容易,微生物发酵法在近几年得到了广泛的采用与快速发展。本文主要是对微生物合成γ-PGA所采用的菌株、相关基因、合成机理及发酵方面进行综述。
1 合成γ-PGA的菌株
γ-PGA是最早于1933年在炭疽芽孢杆菌(Bacillus anthracis)的荚膜上发现的,主要功能是保护细菌免受外界不利环境的影响。据报道[3],表皮葡萄球菌(Saphylococcus epidermidis)也能合成γ-PGA,合成的γ-PGA结合在细胞壁上。另外,3种古生菌,如嗜盐球菌(Planococcus halophilus),盐藻芽孢八叠球菌(Sporosarcina halophila)和亚洲嗜盐碱杆菌(Natrialba asiatica)也能合成γ-PGA,用来降低细菌周围的盐浓度。目前发现的唯一一种真核γ-PGA合成生物为腔肠动物(Cnidaria)。
通过微生物来发酵合成γ-PGA,其研究主要集中在芽孢杆菌属细菌的炭疽芽孢杆菌、地衣芽孢杆菌(Bacillus licheniformis)、枯草芽孢杆菌(Bacillus subtilis)等[4]菌株上。根据细胞生长的营养要求,按是否需要L-谷氨酸,可以把γ-PGA合成菌分为两大类[5]:一类是谷氨酸依赖型,即培养时需要L-谷氨酸才能积累γ-PGA,这类菌种主要有Bacillus anthracis、Bacillus subtilis MR-141、Bacillus licheniformis ATCC-9945、Bacillus subtilis IFO3335和Bacillus subtilis F-2-01等;另一类是谷氨酸非依赖型,即培养时不需要L-谷氨酸也能积累γ-PGA的,如Bacillus subtilis 5E、Bacillus licheniformis A35、Bacillus subtilis TAM-4等[6]。21世纪以来,筛选可以高效合成γ-PGA的微生物,受到越来越多的学者的关注,曹明飞等[7]成功从土壤中分离到一株γ-PGA合成菌Bacillus licheniformis NK-03,其合成的γ-PGA中L-谷氨酸单体达到98%,在已报道的同种菌株L-谷氨酸单体含量中尚属最高。而发现的能够大量合成γ-PGA的多种芽孢杆菌都具有潜在的工业应用价值,本研究组合成γ-PGA所用到的菌株为枯草芽孢杆菌。
2 微生物合成γ-PGA的相关基因研究
合成γ-PGA的相关基因,根据其命名可分为cap(Capsule)和pgs(Polyglutamate synthase)。前者是将γ-PGA做为荚膜的结构组成部分,为结构型,其代表菌株为Bacillus anthracis;后者是将产生的γ-PGA分泌到胞外,为分泌型,其代表菌株类型为Bacillus subtilis。在Bacillus anthracis的菌体中包含两个质粒,即pXO1(108 kb)和pXO2(951 kb),最初将有关PGA编码的相关基因定位在Bacillus anthracis的pXO2质粒上,称之为cap BCA,这也是Makino等[8]在1989年首次报道编码γ-PGA生物合成过程的相关基因研究,他们通过基因互补技术,在质粒pXO2上鉴定出呈簇状分布的3个顺反子,并确定其排列顺序为:cap B、cap C和cap A,如图2-A所示。通过对cap BCA这3个蛋白的氨基酸序列进行分析、定位及对理化处理的敏感性,推测这些属于膜交联酶。后来Urushibata等[9]将cap BCA基因克隆转到大肠杆菌(Escherichia coli)中进行表达发现,cap B是一个重叠基因,能编码2个蛋白cap B和cap B',cap BCA酶以膜结合蛋白形式存在。另外,在cap BCA基因簇下游发现了编码γ-聚D-谷氨酸解聚酶的基因dep,该基因主要是菌体在饥饿条件下,启动该基因的表达来降解PGA为菌体提供氮源。
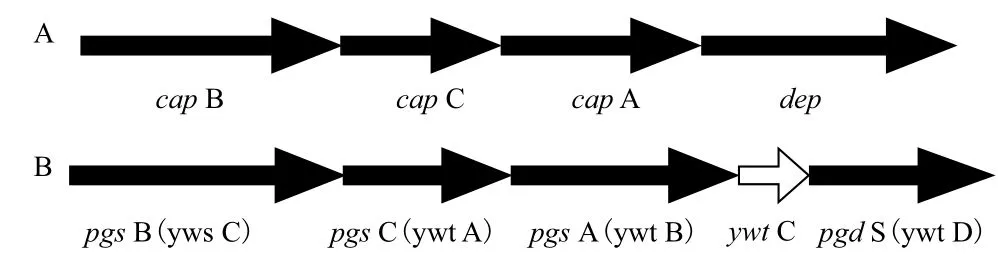
图2 炭疽芽孢杆菌荚膜基因cap BCA(A)与枯草芽孢杆菌合成酶基因pgs BCA(B)
Ashiuchi等[10]从Bacillus subtilis IFO3336基因组文库中,筛选到编码γ-PGA合成酶复合体的克隆,其能在胞外合成更高分子量的γ-PGA。此合成基因包含:pgs B、pgs C和pgs A(也有学者称为yws C、ywt A和ywt B)3个基因,排列成簇,如图2-B所示。下游ywt C基因功能未知,可能是编码γ-PGA解聚酶pgd S(也有学者称为ywt D)基因的先导小蛋白,Bacillus subtilis IFO3336中pgs BCA基因与Bacillus anthracis的cap BCA基因同源性分别为66%、77%和50%。Cao等[11]筛选到一株谷氨酸非依赖型γ-PGA合成菌,即解淀粉芽孢杆菌LL3,并从菌体中克隆到pgs BCA的PGA合成基因,通过与谷氨酸依赖型Bacillus subtilis IFO3336序列比对发现,pgs B、pgs C和pgs A 这3个基因的相似性分别为81.39%、83.33%和73.8%。Uruchibata等[12]从Bacillus subtilis IFO16449中获得包含4个开放阅读框的4.2 kb片段,Northern杂交显示其组成一个操纵子,其中yws C(pgs B)、ywt A(pgs C)和ywt B(pgs A)为γ-PGA合成必要的基因;Western杂交发现yws C蛋白由44 kD的 yws C和33 kD的yws C'两部分组成,且由同向重叠的yws C基因编码,然而两蛋白具体功能尚不清楚。pgs BCA系统是分泌型芽孢杆菌菌体内唯一的γ-PGA合成体系[13],石峰等[14]从Bacillus subtilis ZJU-7的基因组中扩增得到合成γ-PGA的pgs BCA,通过把pTrc99A作为载体转化到大肠杆菌JM109中,构建出来的工程菌大肠杆菌JM109能合成γ-PGA;有些枯草芽孢杆菌,如Bacillus subtilis 168,虽然含有pgs BCA这3个基因,但是由于γ-PGA合成酶操纵子受不同启动子控制,在Bacillus subtilis 168菌体中转录水平太低,使其不能合成γ-PGA,而马婕等[15]从Bacillus subtilis 168基因组中获得合成γ-PGA的3个基因,即yws C、ywt A和ywt B,这3个基因被连接酶连接后,导入到pTrcHisA中,电转化至转录水平比较高的大肠杆菌TOP10及大肠杆菌BL21(DE3)中进行表达,结果显示宿主菌都具备了γ-PGA的合成能力。
Xu等[16]从Bacillus subtilis IFO 16449 菌中克隆出了一个新基因,命名为ywt D,其功能是编码可降解γ-PGA的一种酶。经DNA序列分析将其定位于ywt ABC和yws C基因的相连的下游,并与yws C和ywt ABC构成控制γ-PGA生物合成的一个操纵子,如图2-B所示。同时还证明,ywt D基因与编码DL-内肽酶的基因序列部分相同。纯化的这种酶,具有降解γ-PGA的功能,降解后可产生两种酶解产物,一种高分子质量产物(490 kD,100%由L-谷氨酸组成);另一种低分子质量产物(11 kD,其中D-谷氨酸与L-谷氨酸的比为80∶20)。再用羧肽酶G分析证明这两种产物,这种ywt D酶为一种只降解γ-PGA的D-与L-谷氨酸所形成的γ-谷氨酰键,为γ-DL-谷氨酰基水解酶。王计伟等[17]通过在pET-28b(+)大肠杆菌表达系统中克隆表达Bacillus licheniformis ATCC9945A的ywt D基因,采用SDSPAGE和Western Blot方法检测目的蛋白的表达,并进行体外酶解试验验证其活性,体外酶解试验表明该表达产物具有降解γ-PGA的活性。笔者在用Bacillus subtilis发酵合成γ-PGA时,在发酵后期,发酵液变得十分黏稠,但当超滤后,高黏度的发酵液若不及时提取γ-PGA,放置几日后,则黏度逐渐消失,这是由于γ-DL-谷氨酰基水解酶对γ-PGA降解的原因。目前,虽然已经得知γ-PGA合成的必需基因(即cap BCA和pgs BCA),但是其合成的各个蛋白的具体功能,仍然不清楚,需要后期进一步的研究。
3 γ-PGA合成机理的研究
3.1 γ-PGA中碳骨架的来源
组成γ-PGA碳骨架是来源于葡萄糖中的碳,还是来自谷氨酸中的碳,不同菌体其来源不尽相同。有学者[18]通过13C标记葡萄糖,对Bacillus subtilis NX-2中γ-PGA分子链中的碳骨架进行了跟踪分析,结果发现葡萄糖作为碳源大部分用于能量代谢和菌体合成,只有少部分参与了γ-PGA合成,而谷氨酸则为γ-PGA单体的主要来源;Cromwick和Gross[19]用13C标记柠檬酸和谷氨酸作为培养基碳源,通过核磁共振技术对该菌合成γ-PGA的代谢途径进行了研究,结果发现柠檬酸和谷氨酸均作为前体参与了γ-PGA碳骨架的合成;另外,在Bacillus subtilis MR-141[20]中,除了35%的外源14C-谷氨酸整合入γ-PGA,还有6%的14C-葡萄糖也整合入γ-PGA。由此可知,不同微生物,其γ-PGA碳骨架来源有种属特异性,根据这一现象有助于为培养基成分的设计及γ-PGA的合成提供理论依据。
3.2 γ-PGA的聚合机制研究
最早推测出γ-PGA合成机制的是Troy等[21]首先在Bacillus licheniformis 中发现的,其合成机制为:首先,ATP激活L-谷氨酸,然后由ATP脱去ppi形成的AMP,与谷氨酸在γ位结合,形成谷氨酰-γ-AMP;然后该物质与一种带-SH的酶或者受体(如一些硫脂,暂以X代称)结合,并随后异构化为谷氨酰-X;然后谷氨酰连接到γ-PGA片段上,并脱去X,完成γ-PGA片段的延伸。
后来,Ashiuchi等[13]在一株Bacillus subtilis 中分离到了细胞膜成分,在ATP和D-谷氨酸存在下体外合成了γ-PGA。但他们发现该菌在合成γ-PGA时,ATP水解形成的是ADP,而非AMP,而由于cap B的表达蛋白cap B属氨基连接酶,他们提出了另一条合成机制。即ATP被ATP水解酶水解为ADP与Pi,然后磷酸基团结合到小分子γ-PGA的C末端,之后D-或者L-谷氨酸的氨基端与C端磷酸化了的小分子γ-PGA发生亲核攻击,生成Pi,在γ-PGA合成酶的作用下,延伸γ-PGA链。但是,D-谷氨酸依赖型的ATP酶活性要比L-谷氨酸依赖型的ATP酶活性高,这似乎解释了合成酶系对底物的偏好性,使得γ-PGA中的D-谷氨酸单体比例偏高。但此机制仍有待进一步证明,如小分子γ-PGA究竟多大,发生亲核攻击的具体位置等。笔者认为,虽然不同的学者得到的合成γ-PGA的机制不尽相同,但是不同的微生物,由于其生物特性及代谢调控的不同,其合成γ-PGA的机制也应该不完全相同。

图3 γ-PGA的合成途径及调控示意图
3.3 γ-PGA合成的调控研究
由于cap BCA和pgs BCA的基因序列相似度很高,而且微生物合成γ-PGA属于结合型还是游离型,主要是取决于另外的基因cap D和pgs S,所以推测cap BCA和pgs BCA基因控制的γ-PGA合成调控机理相同[22],而且cap BCA基因合成的γ-PGA主要是炭疽芽孢杆菌荚膜的主要成分,一般不用其大量生产γ-PGA,对其调控的研究很少有报道。因此,这里简述一下pgs BCA基因合成γ-PGA的调控研究。
Mader等[23]在Bacillus subtilis中发现高浓度的磷酸化的DegU能够活化pgs B,C,A的转录。2005年,Stanley等[24]报道称在Bacillus subtilis中,调控蛋白ComP-ComA、DegS-DegU、GegQ和SwrA对γ-PGA的合成是必需的。他们将DegQ和SwrA分别敲除发现,这两个基因任一的敲除都将导致γ-PGA不能合成。而后对DegQ进行了反转录PCR发现,高浓度的DegQ对yws C(与pgs B相同)的转录起调节作用,而SwrA对其转录有细微的影响,所以研究者猜测SwrA主要在转录后起调节作用。而之前的研究已经表明,ComP-ComA和DegS-DegU都能影响DegQ的转录,所以他们提出了一种可能的调节途径,如图3所示。Kimura等[25]于2009年发现pgs B基因上游的一段非编码区对其表达起重要作用。他们将lac Z与pgs B融合,组成融合基因,并通过检测Lac Z的表达来定量表征pgs B的表达情况,然后用一种外切酶从pgs B上游-811开始切除,进而研究上游非编码区域对pgs B的表达影响。结果表明,-721(+1为转录起始位点)之后的非编码区对融合基因的表达起重要作用,猜测可能是ComA或者DegU需要与该段区域结合,进而对γ-PGA合成基因进行调控。另外,Bacillus subtilis 168被广泛用于γ-PGA调控研究,因为该菌是为数不多的、拥有全套的γ-PGA合成基因却不生产γ-PGA的菌株。
综 上 所 述,ComP-ComA、DegS-DegU、DegQ和SwrA对γ-PGA的合成都是必需的。其中ComPComA,DegS-DegU蛋白对基因degQ进行调控,进而调节DegQ的转录,影响γ-PGA合成酶的合成,间接影响pgs B,C,A的转录,SwrA则主要作用于pgs B,C,A的转录后调控,即主要调控γ-PGA合成酶的活性。而pgs B上游的非编码区对pgs B的表达也有重要影响。

表1 γ-聚谷氨酸部分合成菌及发酵条件
4 微生物合成γ-PGA发酵的研究
通过微生物来发酵生产γ-聚谷氨酸,其发酵影响因素,如碳氮源、通氧量、搅拌速度、金属离子、微量元素、前体物质、生物素等,对不同菌株生产γ-聚谷氨酸的影响是不同的。表1[26-34]列出了几株谷氨酸依赖型和非依赖型菌株的培养基配方、发酵周期和γ-聚谷氨酸产量、单体D/L-谷氨酸比例及分子量大小。以发酵菌株、发酵培养基成分及培养条件、发酵方式3个方面来简述微生物发酵合成γ-聚谷氨酸的研究进展。
4.1 发酵合成γ-PGA的菌株研究
由于不同菌株,其本身的特性,决定了其生长代谢的不同,因此发酵合成γ-PGA的能力也不同,因此,很多研究者在基因分子层面对菌株进行改造,采用基因工程的手段(基因克隆、敲除,转录和表达等)来构建基因工程菌,以提高其菌株的性能,进而提高γ-PGA的产量。Su等[35]首次将细菌血红蛋白基因(vgb)采用同源重组方式整合入枯草芽孢杆菌染色体中,突变株枯草芽孢杆菌S18-3-vgb+能正常表达血红蛋白基因,增强了摄氧能力,成功克服了发酵时黏度增加引起的溶氧不足,使菌体浓度提高1.26倍,γ-PGA产量增至60.5 g/L;Yeh等[36]研究组将一种高效合成表达控制序列(synthetic expression control sequence,SECS)单拷贝形式整合入非γ-PGA合成菌枯草芽孢杆菌DB430 yws C 基因上游,获得重组菌枯草芽孢杆菌PGA 6-2,其在不添加额外谷氨酸和氯化铵的培养基中,能产生28 g/L的γ-PGA,在遗传研究方面,是优良的选择性菌株。综上所述,通过将外源基因或调控元件导入到γ-PGA菌株的基因组中,可使菌体浓度、摄氧能力或内源合成酶表达水平得到提高,以增加γ-PGA的产量。
4.2 发酵合成γ-PGA的培养基成分及培养条件研究
4.2.1 碳源 对于用Bacillus 属的几种菌发酵合成γ-PGA最适碳源多为柠檬酸、甘油、果糖、淀粉、葡萄糖和麦芽糖等。其中不同菌株适用不同的碳源。Bacillus licheniform WBL-3[37]最适碳源为柠檬酸、甘油;Bacillus subtilis NX-2的最适碳源为淀粉和麦芽糖,但它不能利用柠檬酸作为碳源[38];Bacillus licheniformis ATCC 9945a以最佳碳源为葡萄糖和甘油的组合[39]时,其γ-PGA的产量可达到 20.5 g/L,它也是合成γ-PGA的主要菌株之一。Yao等[40]运用13C核磁共振的方法跟踪检测13C标记的葡萄糖的结果表明,葡萄糖作为一种速效碳源,主要是作为菌体生长的营养物质,而添加的 L-谷氨酸则被用来合成γ-PGA,对于谷氨酸依赖型的菌株来说是来自外加的谷氨酸,对于非谷氨酸依赖型的菌株来说,其碳源通过内循环能提供合成所需的谷氨酸。大多数枯草芽孢杆菌以柠檬酸和葡萄糖作为最适宜的碳源,以供合成γ-PGA所需要的能量。就降低合成成本[41]考虑,宜用柠檬酸或葡萄糖作碳源。
4.2.2 氮源 对于Bacillus sp.而言,最适氮源包括有机氮源和无机氮源。无机氮源如氯化铵、硫酸铵、硝酸铵和尿素等,有机氮源包含豆浆、蛋白胨、酵母抽提物、玉米浆、玉米浆干粉、黄豆饼粉和花生饼粉等。无机氮源的组成比较清楚,但是营养成分比较单一;而无机氮源营养比较丰富,含有许多未知的促生长因子,能显著促进菌体的生长,但是其组成成分不明确。不同的菌青睐不同的氮源。如以豆浆作为Bacillus licheniformis ATCC 9945a的氮源,γ-PGA的最高产量可以达到35 g/L[42];以(NH4)2SO4等作为Bacillus subtilis IFO3335、Bacillus subtilis PGS-1的氮源,在发酵培养基中额外添加L-谷氨酸能促进γ-PGA的合成,且没有副产物的产生[43];用酵母抽提物代替硝酸铵,Bacillus licheniformis CGMCC3336的γ-PGA的产量比之前增加17%[44]。不同氮源对微生物的生长和目标产物的产量具有重要的影响,表现为氮源不仅可以通过同化作用转变成微生物自身的组成成分,如重要功能性分子酶类和蛋白质等,而且也是某些目标产物合成的原料来源,如氨基酸类产物中的氮元素的主要来源。谷氨酸非依赖型菌株虽然γ-PGA产率较低,但由于可用廉价原料代替价格偏高的谷氨酸,因此在工业合成中有其实际应用意义。所以需要根据不同菌株合理选择相适应的氮源。
4.2.3 金属离子 某些金属离子对Bacillus sbutilis 的γ-PGA合成非常重要,K+、Mn2+、Fe3+、Mg2+和Ca2+等金属离子对枯草芽孢杆菌合成γ-PGA是必须的营养成分之一[45]。低浓度的Mn2+有利于枯草芽孢杆菌自身的生长,进一步提高培养基中Mn2+的浓度,枯草芽孢杆菌的生长反而被抑制,尽管如此,发酵液中γ-PGA的积累量仍然增加。同时Cromwick等[46]发现可以通过改变培养基中的Mn2+离子浓度来调节某些芽孢杆菌产物γ-PGA的多聚体链中D-型或L-型谷氨酸的比例。同样,培养基中添加Ca2+有利于菌体内多肽的合成,其浓度对于菌体活性具有重要的影响作用。在发酵合成γ-PGA的过程中,Mg2+可能具有控制菌体内专一性很强的D-和L-多肽合成酶系统的作用。随着枯草芽孢杆菌原生质体的获得,金属离子对γ-PGA发酵合成的影响作用将会得到进一步深入研究。因此,培养基中金属离子种类和浓度对γ-PGA的合成具有重要的影响作用。在发酵合成γ-PGA的过程中有许多酶类参加反应,金属离子对维持这些酶的活性中心构象和保持酶活性方面具有重要的作用。
4.2.4 其他培养条件 除了碳源、氮源、金属离子对γ-PGA合成造成影响外,还有一些盐类,如NaCl的加入,对其合成有一定的影响。有研究发现[32],加入一定浓度的NaCl,可以减小发酵后期发酵液的黏度,起到消泡的作用。其原因是加入的NaCl破坏了γ-PGA形成的凝胶网络结构,甚至使γ-PGA的黏弹性完全丧失,从而降低其黏度,但加入的NaCl量太高,会使发酵液中的渗透压过高,会导致细胞脱水死亡,影响γ-PGA的产量;另外,培养条件对其γ-PGA合成也有影响,如转速太低,传质不均匀,溶氧不足;转速太高,对菌体产生的剪力越大,会破坏菌体的细胞壁、细胞膜,不利于菌体的生长,进而影响产物的生成[44],因此需要选择合适的转速;好氧微生物在生长过程中需要给菌体生长提供足够的溶氧量,供氧量不足时,好氧微生物会在厌氧条件下,其正常的生理代谢会受到影响[47];另外,有研究发现[46],Bacillus licheniformis ATCC 9945a在pH维持在6.5时γ-PGA生成量最大,而pH小于5.5或大于7.4则γ-PGA生成量显著下降。培养条件的研究对提高γ-PGA的产量具有重要作用,必须创造适合于菌体产γ-PGA的最佳环境,才能让微生物发酵出更多的γ-PGA。
4.3 合成γ-PGA的发酵方式研究
发酵方式有多种,如液体发酵、固体发酵、固定化细胞发酵等。通过微生物的方式发酵合成γ-PGA,常用的发酵方式为液体发酵,Cromwick等[46]以Bacillus licheniformis ATCC 9945a菌株在适宜的条件下液体发酵γ-PGA,其产量可达到25 g/L。液体发酵的优点是发酵过程中的参数容易控制,发酵周期短,有利于后期分离提取,成本低廉,适合工业化大生产。Chen等[48]采用固态发酵,其培养成分鸡粪、豆饼粉、麦麸用量为1∶1∶0.2,0.5%谷氨酸,0.5%柠檬酸,含水量65%,通过Bacillus subtilis CCTCC202048固体发酵,可得到42 g/L的γ-PGA。另外,Xu等[49]采用一种新型的有氧植物纤维床生物反应器(APFB),对细胞进行固定化发酵,通过发酵动力学进行分析,固定化细胞发酵表现出更高效的γ-PGA产量,用这个APFB反应器进行分批补料发酵,γ-PGA的产量达到了71.21 g/L。固态发酵与液态发酵相比,其优点是设备和技术较简易,成本、能源消耗低,培养基原料价格低廉、广泛易得。不足之处是工艺参数难以控制,发酵速度慢,周期长,后期分离纯化困难,离工业化生产还有一定的距离;固定化细胞发酵,虽然其发酵γ-PGA的产量比较高,但由于其发酵设备及相关技术有较高的要求,生产成本高,目前还处于实验室阶段,不适合工业化大生产。
综上所述,影响微生物产γ-PGA的原因,主要包括内因(菌株本身的特性)和外因(培养基成分及发酵方式)两方面。针对内因,可以通过构建工程菌,从分子水平上来将菌种改造成合成所需要的高产γ-PGA的菌株;针对外因,可以通过统计学的方法(如PB设计,CCD设计、正交实验、响应面分析等)来进行培养基成分及培养条件的优化,为微生物提供一个有利于产γ-PGA的环境,最大限度的使菌株产γ-PGA。另外,改变传统液态发酵方式,改变发酵设备等,也能提高γ-PGA的产量。另外,为了能迎合工业化大生产的需要,不仅是要提高 γ-PGA的产量,而且还要能降低合成成本,合成可采用廉价的原料,如甘蔗、糖蜜[50]、玉米浆干粉、牛粪堆肥、合成味精的残渣[51,52]等合成γ-PGA。本研究正在从廉价的培养基原料(如玉米浆干粉、糖蜜、黄豆饼粉、麦麸等)着手,其成分为天然的营养成分,营养丰富,价格低廉,适合作为工业化大生产的原料,通过统计学的方法,已筛选出最佳培养基配方,γ-PGA的产量可达到50 g/L。
5 展望
γ-PGA最吸引人的特性在于它是水溶性的、无毒、可生物降解、可食用等,这些特性使其有大量潜在的商业应用前景[53],目前研究得比较热门的菌株主要是地衣芽孢杆菌(Bacillus licheniforms)和枯草芽孢杆菌(Bacillus subtilis)。而急需解决的是如何降低合成成本、提高PGA的产量、控制产物分子量等。根据国内外研究现状,γ-PGA的未来研究方向可向这些方面来发展:寻求廉价的适合工业化大合成的原料,如玉米浆、黄豆饼粉等;筛选高效高产的优良菌株,特别是谷氨酸非依赖型合成菌,并对发酵条件进行优化;通过基因工程的手段,构建工程菌,提高菌株本身的合成性能,进而增加γ-PGA的产量。目前,在国外,如日本味之素株式会社利用纳豆菌对谷氨酸进行聚合,成功的生成了PGA,已经投入到商业化生产当中;Cell Therapeutics公司开发出了以PGA作为药物载体,用于治疗肿瘤的药物——PGA-紫杉醇药物,其产品已经在日本、中国台湾、韩国及亚洲其他国家和地区上市销售。而国内的研究工作大部分仅限于实验室,或者只有中小规模的生产,且偏重于菌种和发酵工艺,对菌株合成γ-PGA的基因层面、提取工艺研究相对较少。随着研究的深入和基因改造手段的成熟,传统方法对γ-PGA产量的提高越来越有限,而通过对基因和代谢流的改造,如提高关键酶的活性、增加正向调控蛋白的浓度、敲除γ-PGA的降解基因等,将会扮演越来越重要的角色。本研究组在分子层面,正在进行通过基因同源重组[54,55]的方法,通过氨苄青霉素作为筛选标记,敲除枯草芽孢杆菌中的降解酶基因[56],减少γ-PGA产物的降解,进而提高γ-PGA的得率。
[1] 任尚美, 马霞, 王海波. γ-聚谷氨酸的发酵条件优化及其初步表征[J]. 中国酿造, 2008, 27(19):43-46.
[2] 赵紫华, 马霞, 刘蕊. 高产γ-聚谷氨酸菌株的选育与鉴定[J].中国酿造, 2007, 26(7):32-34.
[3] 郑重, 吴剑光, 邱乐泉. 微生物聚谷氨酸(γ-PGA)合成酶及合成机理的研究进展[J]. 生物技术通报, 2010(6):52-56.
[4] Negus D, Burton J, Sweed A, et al. Poly-γ-d-glutamic acid capsule interferes with lytic infection of Bacillus anthracis by B. anthracisspecific bacteriophages[J]. Applied and Environmental Microbiology, 2013, 79(2):714-717.
[5] 王浩, 杨丽萍, 乔君. γ-聚谷氨酸的研究进展[J]. 山东食品发酵, 2011, 4:015.
[6] Hidetoshi K, Toshio M, Kazumichi U, et al. Production of poly(γ-glutamic acid)by Bacillus subtilis F-2-01. Bioscience,Biotechnology, and Biochemistry, 1993, 57(7):1212-1213.
[7] Cao M, Song C, Jin Y, et al. Synthesis of poly(γ-glutamic acid)and heterologous expression of pgs BCA genes[J]. Journal of Molecular Catalysis B:Enzymatic, 2010, 67(1):111-116.
[8] Makino S, Uchida I, Terakado N. Molecular characterization and protein analysis of the cap region, which is essential for encapsulation in Bacillus anthracis[J]. Journal of Bacteriology,1989, 171(2):722-730.
[9] Urushibata Y, Tokuyama S, Tahara Y. Difference in transcription levels of cap genes for γ-poly glutamic acid production between Bacillus subtilis IFO16449 and Marburg 168[J]. Journal of Bioscience and Bioengineering, 2002, 93(2):252-254.
[10] Ashiuchi M, Soda K, Misono H. A poly-γ-glutamate synthetic system of Bacillus subtilis IFO3336:gene cloning and biochemical analysis of poly-γ-glutamate produced by Escherichia coli clone cells[J]. Biochemical Biophysical Research Communications,1999, 263(1):6-12.
[11] Cao M, Geng W, Liu L, et al. Glutamic acid independent production of poly-γ-glutamic acid by Bacillus amyloliquefaciens LL3 and cloning of pgs BCA genes[J]. Bioresource Technology, 2011,102(5):4251-4257.
[12] Urushibata Y, Tokuyama S, Tahara Y. Characterization of the Bacillus subtilis ywsC gene, involved in γ-polyglutamic acid production[J]. Journal of bacteriology, 2002, 184(2):337-343.
[13] Ashiuchi M, Nawa C, Kamei T, et al. Physiological and biochemical characteristics of poly-γ-glutamate synthetase complex of Bacillus subtilis[J]. European Journal of Biochemistry, 2001, 268(20):5321-5328.
[14] 石峰, 徐志南, 岑沛霖. 利用枯草芽抱杆菌制备 γ-聚谷氨酸[C]. 中国资源生物技术与糖工程学术研讨会论文集,2005.
[15] 马婕, 王丹, 李强. 基因工程大肠杆菌合成 γ-聚谷氨酸[J].过程工程学报, 2009, 9(4):792-795.
[16] Xu Q, Sudek S, McMullan D, et al. Structural basis of murein peptide specificity of a γ-D-glutamyl-L-diamino acid endopeptidase[J]. Structure, 2009, 17(2):303-313.
[17] 王计伟, 施庆珊, 欧阳友生. 地衣芽胞杆菌ATCC9945A中γ-聚谷氨酸降解酶基因的克隆、表达及降解性能鉴定[J]. 生物技术, 2012, 22(1):13-17.
[18]Wu Q, Xu H, Xu L, et al. Biosynthesis of poly(γ-glutamic acid)in Bacillus subtilis NX-2:regulation of stereochemical composition of poly(γ-glutamic acid)[J]. Process Biochemistry, 2006, 41(7):1650-1655.
[19]Cromwick AM, Gross RA. Investigation by NMR of metabolic routes to bacterial γ-poly(glutamic acid)using13C-labeled citrate and glutamate as media carbon sources[J]. Canadian Journal of Microbiology, 1995, 41(10):902-909.
[20]Ogawa Y, Yamaguchi TF, Yuasa K, et al. Efficient production of γ-polyglutamic acid by Bacillus subtilis(natto)in Jar fermenters[J]. Biosci Biotech Bioch, 1997, 61:1684-1687.
[21]Troy F. Chemistry and biosynthesis of poly(gamma-d-glutamyl)capsule in Bacillus licheniformis. 1. properties of membranemediated biosynthetic reaction[J]. Journal of Biological Chemistry, 1973, 248(1):305-315.
[22]Candela T, Fout A. Poly-gamma-glutamate in bacteria[J]. Molecular Microbiology, 2006, 60(5):1091-1098.
[23]Mader U, Antelmann H, Buder T. Bacillus subtilis functional genomics:genome-wide analysis of the DegS-DegU regulon by transcriptomics and protiomics[J]. Molecular Genetics and Genomics, 2002, 268(4):455-467.
[24]Stanley N, Lazazzera B. Defining the genetic differences between wild and domestic strains of Bacillus subtilis that affect polygamma-DL-glutamic acid production and biofilm formation[J]. Molecular Microbiology, 2005, 57(4):1143-1158.
[25]Kimura K, Tran L. Expression of the pgs B encoding the polygamma-DL-glutamate synthetase of Bacillus subtilis(natto)[J]. Bioscience Biotechnology and Biochemistry, 2009, 73(5):1149-1155.
[26]Cao Mf, Geng W, Li L, et al. Glutamic acid independent production of poly-γ-glutamic acid by Bacillus amyloliquefaciens LL3 and cloning of pgs BCA genes[J]. Bioresource Technology, 2011,102(5):4251-4257.
[27]Cheng C, Yoshihiro A, Tokujiro A. Production of γ-polyglutamic acid by Bacillus licheniformis A35 under denitrifying conditions[J]. Agricultural and Biological Chemistry, 1989, 53(9):2369-2375.
[28]Ishwar B, Rekha S. Poly(glutamic acid)-an emerging biopolymer of commercial interest[J]. Bioresource Technology, 2011, 102(10):5551-5561.
[29]Jae-Hoon J, Jin-Nam K, Young-Jung W, et al. The statistically optimized production of poly(γ-glutamic acid)by batch fermentation of a newly isolated Bacillus subtilis RKY3[J]. Bioresource Technology, 2010, 101(12):4533-4539.
[30]Lung SI, Wu PJ, Jen SC. Microbial production of a poly(γ-glutamic acid)derivative by Bacillus subtilis[J]. Process Biochemistry,2005, 40(8):2827-2832.
[31]Masao K, Atsuo G. Biosynthesis of poly(γ-glutamic acid)from L-glutamic acid, citric acid, and ammonium sulfate in Bacillus subtilis IFO3335[J]. Applied Microbiology and Biotechnology,1994, 40(6):867-872.
[32]Yoshihito I, Takeshi T, Tetsuo O, et al. Glutamic acid independent production of poly(γ-glutamic acid)by Bacillus subtilis TAM-4[J]. Bioscience, Biotechnology, and Biochemistry, 1996, 60(8):1239-1242.
[33]金映红, 刘静, 刘莉. 利用 Bacillus licheniformis NK-03 合成聚谷氨酸及其合成酶基因 pgs BCA 的克隆[J]. 南开大学学报:自然科学版, 2008, 41(3):57-63.
[34]疏秀林, 施庆珊, 冯静. 一株非谷氨酸依赖型聚 γ-谷氨酸高产菌株的鉴定与诱变育种[J]. 微生物学通报, 2009, 36(5):705-710.
[35] Su Y, Li X, Liu Q, et al. Improved poly-γ-glutamic acid production by chromosomal integration of the Vitreoscilla hemoglobin gene(vgb)in Bacillus subtilis[J]. Bioresource Technology, 2010,101(12):4733-4736.
[36]Yeh CM, Wang JP, Lo S. Chromosomal integration of a synthetic expression control sequence achieves poly-γ-glutamate production in a Bacillus subtilis strain[J]. Biotechnology Progress, 2010, 26(4):1001-1007.
[37]杨革, 陈坚, 曲音波. 金属离子对地衣芽孢杆菌合成多聚谷氨酸的影响[J]. 生物工程学报, 2001, 17(6):706-709.
[38] Hong X, Min J, Hui L, et al. Efficient production of poly(γ-glutamic acid)by newly isolated Bacillus subtilis NX-2[J]. Process Biochemistry, 2005, 40(2):519-523.
[39] Young HK, Richard AG. Effects of glucose and glycerol on γ-poly(glutamic acid)formation by Bacillus licheniformis ATCC 9945a[J]. Biotechnology and Bioengineering, 1998, 57(4):430-437.
[40] Yao J, Xu H, Shi N, et al. Analysis of carbon metabolism andimprovement of γ-polygiutamic acid production from Bacillus subtilis NX-2[J]. Applied Biochemistry and Biotechnology,2010, 160(8):2332-2341.
[41]Hwan DJ, Nam CH, Yup LS. Efficient recovery of γ-poly(glutamic acid)from highly viscous culture broth[J]. Biotechnology and Bioengineering, 2001, 76(3):219-224.
[42]冯志彬, 程仕伟, 缪静. γ-聚谷氨酸生产菌的选育及培养条件研究[J]. 生物加工过程, 2010(1):40-44.
[43]阮文辉, 杨家志, 姚俊. γ-聚谷氨酸合成菌株的筛选与优化培养[J]. 中国酿造, 2011(5):66-69.
[44] Qiao C, Zhang S, Li Z, et al. improving poly-(γ-glutamic acid)production and reducing impurities in fermentation broth by medium optimization using Bacillus licheniformis CGMCC3336[J]. Journal of Biobased Materials and Bioenergy, 2013, 7(3):390-394.
[45] Andrew R, Argyrios M. Optimization of cell growth and poly(glutamic acid)production in batch fermentation by Bacillus subtilis[J]. Biotechnology Letters, 2003, 25(6):465-468.
[46]Anne MC, Richard AG. Effects of manganese on Bacillus licheniformis ATCC 9945A physiology and γ-poly(glutamic acid)formation[J]. International Journal of Biological Macromolecules, 1995, 17(5):259-267.
[47]Gooding EA, Sharma S, Petty SA, et al. pH-dependent helix folding dynamics of poly-glutamic acid[J]. Chemical Physics, 2013,422:115-123.
[48]Chen X, Li QY, Dai J, et al. Solid state fermentation for chicken manure regenerative feed containing poly-γ-glutamic acid[J]. Advanced Materials Research, 2013, 807:1176-1180.
[49]Zongqi X, Xiaohai F, Dan Z, et al. Enhanced poly(γ-glutamic acid)fermentation by Bacillus subtilis NX-2 immobilized in an aerobic plant fibrous-bed bioreactor[J]. Bioresource Technology,2014, 155:8-14.
[50]Zhang D, Feng X, Zhou Z, et al. Economical production of poly(γ-glutamic acid)using untreated cane molasses and monosodium glutamate waste liquor by Bacillus subtilis NX-2[J]. Bioresource Technology, 2012, 114:583-588.
[51]Yong X, Raza W, Yu G, et al. Optimization of the production of poly-γ-glutamic acid by Bacillus amyloliquefaciens C1 in solidstate fermentation using dairy manure compost and monosodium glutamate production residues as basic substrates[J]. Bioresource Technology, 2011, 102(16):7548-7554.
[52]Zeng W, Li W, Shu L, et al. Non-sterilized fermentative coproduction of poly(γ-glutamic acid)and fibrinolytic enzyme by a thermophilic Bacillus subtilis GXA-28[J]. Bioresource Technology, 2013, 142:697-700.
[53]Bajaj I, Singhal R. Poly(glutamic acid)-an emerging biopolymer of commercial interest[J]. Bioresource Technology, 2011, 102(10):5551-5561.
[54]彭其安, 张西峰, 吴思方. 同源重组法构建枯草芽孢杆菌转酮酶缺失突变菌株[J]. 生物技术, 2006, 16(6):23-26.
[55] 严涛, 赵锦芳, 高文慧. 大肠杆菌工程菌pts G基因敲除及其缺陷株混合糖同型乙醇发酵[J]. 生物工程学报, 2013, 29(7):937-945.
[56]金晶, 姚俊, 徐虹. 枯草杆菌NX-2聚谷氨酸解聚酶的克隆表达及其降解性质研究[J]. 中国生物工程杂志, 2007, 27(5):34-38.
(责任编辑 狄艳红)
Progresses of Microbial Synthesis of Poly-γ-Glutamic Acid of Related Genes,Synthesis Mechanism and Fermentation
Yan Tao Xi Hongsheng
(Jingsu Hengfengqiang Bio-technology Co.,Ltd,Haimen 226100)
γ-polyglutamic acid(γ-PGA)is naturally occurring poly amino acids with characteristics of water solubility, biodegradability,edible and non-toxicity towards human, animals and the environment. Therefore, γ-Poly(glutamic acid)and its derivatives have been of interest in a broad range of industrial fields such as environment, medicine, food, cosmetics and feed additives. This paper focuses on the microbial synthesis of γ-PGA of related genes, synthesis mechanism and fermentation.
γ-polyglutamic acid;gene;mechanism;fermentation
10.13560/j.cnki.biotech.bull.1985.2015.04.004
2014-08-09
严涛,男,硕士,研究方向:微生物发酵;E-mail:yantao2112@126.com

