利用基因工程技术提高微藻油脂含量的研究进展
李逸 王潮岗 胡章立
(深圳大学生命科学学院 深圳市海洋生物资源与生态环境重点实验室,深圳 518060)
利用基因工程技术提高微藻油脂含量的研究进展
李逸 王潮岗 胡章立
(深圳大学生命科学学院 深圳市海洋生物资源与生态环境重点实验室,深圳 518060)
利用微藻油脂制备生物柴油因具有重要的战略意义而受到世界各国的重视,成为近年来的研究热点。利用微藻制备生物柴油具有生长周期短、易于大规模培养、能大量吸收CO2及不占用耕地等优点。但是,由于对藻类油脂合成代谢中的调节机制了解不多,导致微藻基因组研究相对滞后,极大地限制了微藻生物能源的大规模开发和利用。随着现代生物技术的发展,通过基因工程、代谢工程等方法调控微藻脂类的合成代谢,提高藻类含油量和生物量已成为可能。概述了微藻中油脂的合成代谢,归纳总结利用基因工程技术提高微藻油脂含量的研究进展,为获得含油量高的工程微藻及微藻制备生物柴油提供技术储备。
微藻;基因工程;生物柴油;油脂
随着经济全球化和人口总量的急剧扩增,极大增加了人们对工业生产和能源的需求。从21世纪起,能源已是影响人类文明进步的重要因素。据报道,2050年全球能源需求将会翻一番,目前,全球大约80% 的能源来自化石燃料,包括石油、天然气等。它们作为一种不可再生能源,全球储量越用越少,已经成为影响地区稳定、经济发展的主要原因。与此同时,化石燃料的大量使用还引起了气候变暖、环境污染等一系列问题。当今社会进入新经济时代,发展低碳经济,使用可再生、低污染的新型可替代能源已经成为当务之急。现在,生物柴油已被各国认为是理想的可再生能源,其主要成分脂肪酸甲酯(fatty acid methyl ester,FAME)是以可再生资源为原料通过酯交换制备而成,具备与石化柴油相近的性能。其优势如下:是一种可持续供应的可再生资源;具有高度生物降解性,毒性小;基本不会增加环境污染物的排放;有较高的氧含量,比从石油中提炼出的柴油有更大的燃烧值;能逐步缓解对进口资源的依赖性;生物柴油来源于植物的光合作用,可以缓解生物柴油燃烧所生成的CO2,所以无论是生产还是使用生物柴油都可以有效的减少温室效应[1,2]。
生物柴油的发展历程主要分为3个阶段:第一代生物柴油的原料主要是油菜、大豆、棕榈油和向日葵。第二代生物柴油的原料主要是麻风树、麻花、烟草种子、三文鱼油、废烹调油、餐厅油脂和动物脂肪等。第三代生物柴油的原料主要是微藻。第一代和第二代原料因为存在与人争地、来源有限、原料的效率低和可持续性差等问题,无法满足人们的需求,逐渐被第三代原料的微藻所取代[3]。利用微藻生产生物燃料的概念早在50多年前就已提出,它具有其他绿色油脂植物所不具备的优点:生长周期短、繁殖速度快、易于大规模培养、能大量吸收CO2、不占用耕地、单位生物量微藻产油量高于一般油料作物等[2,3]。据国内外报道,油脂含量较高的微藻主要集中在绿藻、金藻和硅藻等真核微藻中,常见的高产油微藻有绿藻中的葡萄藻、小球藻和杜氏盐藻;硅藻中的三角褐指藻等[2]。这些微藻可以储存大量的高能化合物,如三酰甘油和淀粉,这些化合物可直接用于生产生物柴油和酒精等生物燃料[1,3,4]。
利用微藻中的油脂生产生物柴油因为具有重要的战略意义而受到世界各国的关注,成为近年来的研究热点。然而,应用微藻制备生物柴油存在以下两方面的问题:获得油脂含量高的工程藻株以及降低后续生产成本,这是微藻制备生物燃料能否工业化生产的关键,特别是获得油脂含量高的基因工程藻株,对微藻制备生物燃料的下游生产工艺具有巨大的影响[5-7]。在本篇综述中,我们将重点阐述通过基因工程构建高产油藻的途径,归纳总结近年来微藻产油的研究进展,为获得含油量高的工程微藻及微藻制备生物燃料提供技术储备[8]。
1 微藻油脂合成路径的探究
人们对于植物脂肪酸的代谢路径了解较多,如拟南芥、油菜等,其产油路径已有报道。但是,对于藻类的脂肪酸代谢路径了解还不够准确。图1是根据植物脂肪酸合成路径及近年来的研究推导出的藻类脂肪酸合成路径图。
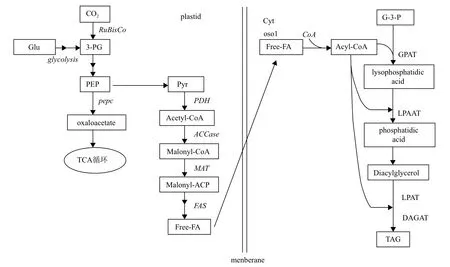
图1 微藻脂代谢路径图
微藻中油脂的合成路径主要分为两个部分,包括自由脂肪酸的合成和三酰甘油的合成(即Kennedy路径),两个路径分别发生在质体和细胞质中,其中的质体为叶绿体,在叶绿体中生成自由脂肪酸后,被转运到质体外进行三酰甘油(triacylglycerol,TAG)的组装合成。藻细胞中的糖酵解路径为脂肪酸合成提供原材料乙酰辅酶A(Acetyl-CoA),乙酰辅酶A在乙酰辅酶A羧化酶(Acetyl-CoA carboxylase,ACCase)的催化下生成丙二酸单酰辅酶A(Malonyl-CoA),这步反应是不可逆的,是脂肪酸合成的关键步骤。经脂肪酸合酶的催化生成自由脂肪酸,并从质体中进入细胞质的内质网上开始三酰甘油的组装。Kennedy路径主要是由3种酰基转移酶包括甘油3-磷酸酰基转移酶(glycerol-3-phosphate acyltransferase,GPAT)、溶血磷脂酸酰基转移酶(lysophosphatidic acid acyltransferase,LPAAT)和二酰甘油酰基转移酶(diacylglycerol acyltransferase,DAGAT)起作用,最终合成TAG。
2 三酰甘油合成路径的改造
对于微藻基因组的研究在近几十年已有很大进步,建立了表达序列标签(EST)数据库,一些微藻的核、线粒体和叶绿体基因组也已经测序完毕。目前总基因组测序完毕的有莱茵衣藻(Chlamydomo-nas reinhardtii)、三角褐指藻(Phaeodactylum tricornutum)、假微型海链藻(Thalassiosira pseudonana)、红藻(Cyanidioschyzon merolae)及绿色鞭毛藻(Ostreococcus lucimarinus)等[9,10]。
2.1 微藻中CO2的固定
在工业化培养的光生物反应器和农业化培养的开放池中培养藻时,提高太阳能利用率很重要,不仅在微藻中,在现代化农业生产中,如何提高农作物光合效率也成为研究重点[11,12]。改造的关键在于叶绿体,大多数叶绿体的基因组可以进行高效同源重组,微藻叶绿体转化技术也相对成熟,如基因枪的应用和筛选标记的开发。通过基因工程方法改造微藻叶绿体基因,提高其光合效率,可以促进微藻对环境中二氧化碳的利用。研究发现,利用基因工程将莱茵衣藻中的叶绿体基因组导入酵母细胞中,实现了二氧化碳固定效率和光合效率的提高[13]。
二磷酸核酮糖羧化酶(RuBisCO)是一种初级二氧化碳固定酶,属于光合作用C3路径中的重要羧化酶。微藻细胞在进行光合作用时,利用核酮糖-1,5-二磷酸羧化酶/加氧酶(Ribulose-1,5-bisphosphate carboxylase/oxygenase,RuBisCO)将CO2催化生成3-磷酸-甘油酸。尽管研究人员已经通过不同的试验在植物和藻类中证明了RuBisCO的功能,且它在所有的光合有机体中含量最多,但它的效率是最低的[14]。对RuBisCO进行改造可以提高其固碳率,增加光合效率,从而增加微藻的产量。近年来一些文献报道,RuBisCO在促进脂肪酸合成的同时也发挥一定的作用。研究发现,在油菜种子中RuBisCO的活性与油脂的形成有关,同时可以促进种子中乙酰辅酶A的含量提升。由此推测,RuBisCO活性的增加可以使更多的碳源流向后续反应,从而影响油脂的代谢,微藻中RuBisCO的研究并没有太多报道,还需要更多的研究去证实[1,9]。
与固碳作用有关的另外一种酶是碳酸酐酶(carbonic anhydrase,CA)。在微藻中,碳酸酐酶可以催化CO2和HCO3-之间的转换[15]。碳酸酐酶分为α型、β型和γ型3种,已经在蓝细菌(Cyanobacteria)中发现了类似CA功能的蛋白,莱茵衣藻(Chlamydomonas rerhardtii)中存在的是α型和β型,涉及到的基因有12个。Sinetova等[16]在2012年发现,莱茵衣藻的CA缺陷株与野生型相比,在二氧化碳浓度增加的条件下,细胞膜上多不饱和脂肪酸含量增加幅度较小,因此推测碳酸酐酶与微藻的产油量存在一定关系。
2.2 自由脂肪酸合成路径的改造
最早关于微藻脂肪酸合成相关酶的研究是乙酰辅酶A羧化酶(ACCase),它是脂肪酸合成过程中的关键酶,负责催化脂肪酸合成的第一步反应,将乙酰辅酶A催化成丙酮酸辅酶A。ACCase分为2类,即异质型和同质型[17-19]。
在酵母和其他高等真核生物中ACCase的活性和表达量与脂肪酸含量有密切关系,Shi等[20]发现在酿酒酵母(S. cerevisiae)中过量表达改造后酶活性提高的ACCase时,酿酒酵母油脂含量最多增加65%。大肠杆菌中(Escherichia coli)中ACCase的过量表达使得总脂含量增加为原来的6倍[21]。但是,通过增加ACCase的表达量促进脂肪酸合成在微藻中并不成功。Dunahay等[22]增加硅藻(C. cryptica和N. saprophila)中ACCase的表达量,尽管ACCase的表达量增加2-3倍,但脂肪酸含量无明显增加。在隐秘小环藻(Cyclotella cryptica)、舟形藻(Navicula saprophila)中过量表达ACCase均未导致脂类含量明显增加。存在的原因可能有两个,一是ACCase酶结构复杂,碱基数多,对其改造难度较大;二是ACCase虽然是限速酶,但与终产物三酰甘油的距离较远,加上微藻中还存在反馈抑制的调控,这大大减弱了ACCase的作用。
脂肪酸合酶(fatty acid synthase,FAS)是一个多亚基多酶复合体,脂肪酸合酶以丙二酰辅酶A为底物,每进行一个循环增加2个碳原子,最后形成16碳的软脂酰-ACP和18碳的硬脂酰-ACP,再形成二十二碳六烯酸(docosahexaenois,DHA)和花生四烯酸(arachidonic acid,ARA)等长链多不饱和脂肪酸[1,23],很多藻的FAS已经被发现。FAS作为一个多酶复合体,它的底物通常有多个酶结合位点,产物的合成由多个酶调节。因此,单一的改变其中一种酶活性,只能改变某一种油脂成分的含量,对脂肪酸总量的影响不大。2001年,Dehesh等[23]克隆了菠菜中3-酮脂酰-酰基载体蛋白合成酶III(KASIII)的cDNA序列,分别在烟草细胞、橄榄型油菜和拟南芥中进行过表达,结果增加了这3种植物中饱和脂肪酸(16∶0)的含量,总脂的合成率没有明显提高。以上研究说明,FAS多亚基、多调控机制的特性导致人们不能通过单一的酶基因改变来提高总的脂肪酸含量(表1)。
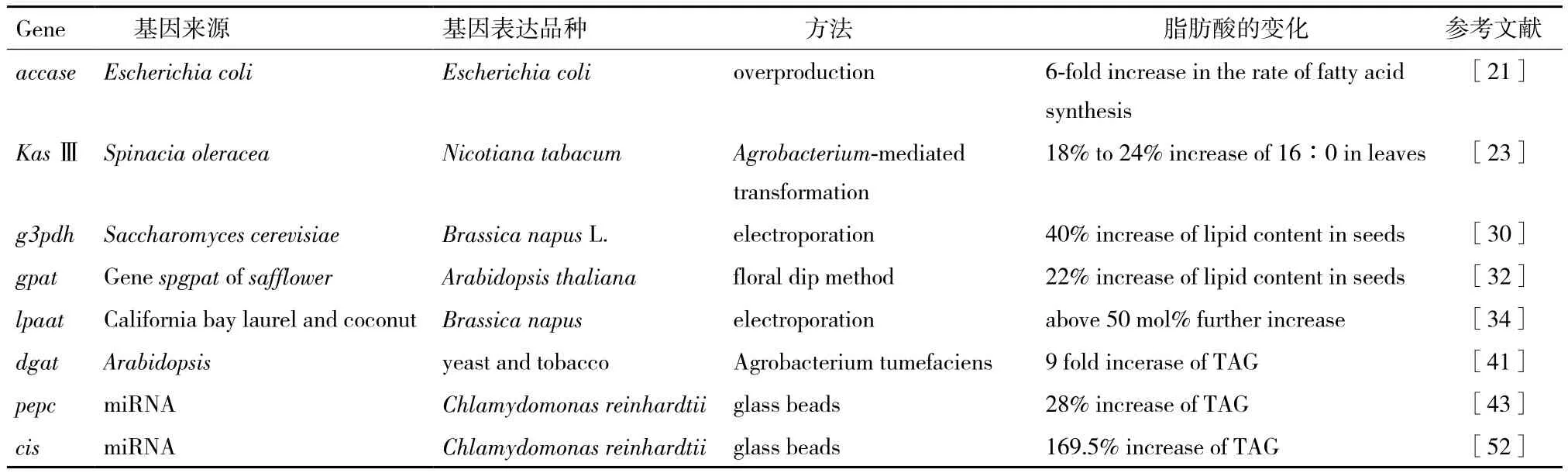
表1 部分基因在提高脂肪酸含量中的应用
2.3 TAG组装路径(Kennedy路径)的改造
TAG路径是指三酰甘油的形成路径,脂肪酸在质体中形成后,被运送到细胞质的内质网上,与甘油进行组装,主要包括:3-磷酸甘油脱氢酶(glycerol-3-phosphate dehydrogenase,G3PDH)、甘油-3-磷酸酰基转移酶(glycerol-3-phosphate acyltransferase,GPAT)、溶血磷脂酸酰基转移酶和二酰甘油酰基转移酶[24]。在胁迫条件下,TAG合成量的显著增加就是与4种酶有密切的关系,它们是合成TAG的关键酶。目前,关于这些酶的研究主要集中在拟南芥、油菜等高等植物,在大肠杆菌、酵母和微藻中也有少量研究[25]。在不同的物种中酰基转移酶的存在形式是不同的。如图2,为三酰甘油主要合成过程。
2.3.1 甘油-3-磷酸脱氢酶(G3PDH,EC1.1.1.8)
G3PDH负责将磷酸二羟基丙酮(dihydroxyacetoneph-osphate,DHAP)催化形成甘油-3-磷酸(glycerol-3-phosphate,G-3-P),反应公式如图2所示,该反应是甘油代谢途径中的限速步骤,在还原态烟酰胺腺嘌呤二核苷酸 NADH的参与下催化DHAP生成3-磷酸甘油,它决定了甘油合成量的多少[26]。这步反应严格说虽不算Kennedy途径,但为Kennedy路径提供前体物质,决定了目标产物的产量。
在哺乳动物中,G3PDH与脂肪酸含量的关系研究较多,早在1979年就已经确定,在小鼠的3T3细胞脂肪转换时,G3PDH可以作为晚期分化的重要标志[27]。2014年,Kim等[28]发现用药物处理小鼠的前脂肪细胞时,前脂肪细胞的分化被抑制,同时G3PDH的酶活被抑制。与之相似,Yi等[29]发现用脂肪酸结合蛋白3(H-FABP,FABP3)刺激小鼠脂肪细胞,三酰甘油总量提高的同时,g3pdh基因的表达量明显升高,这说明哺乳动物中G3PDH的酶活与脂肪细胞密切相关。
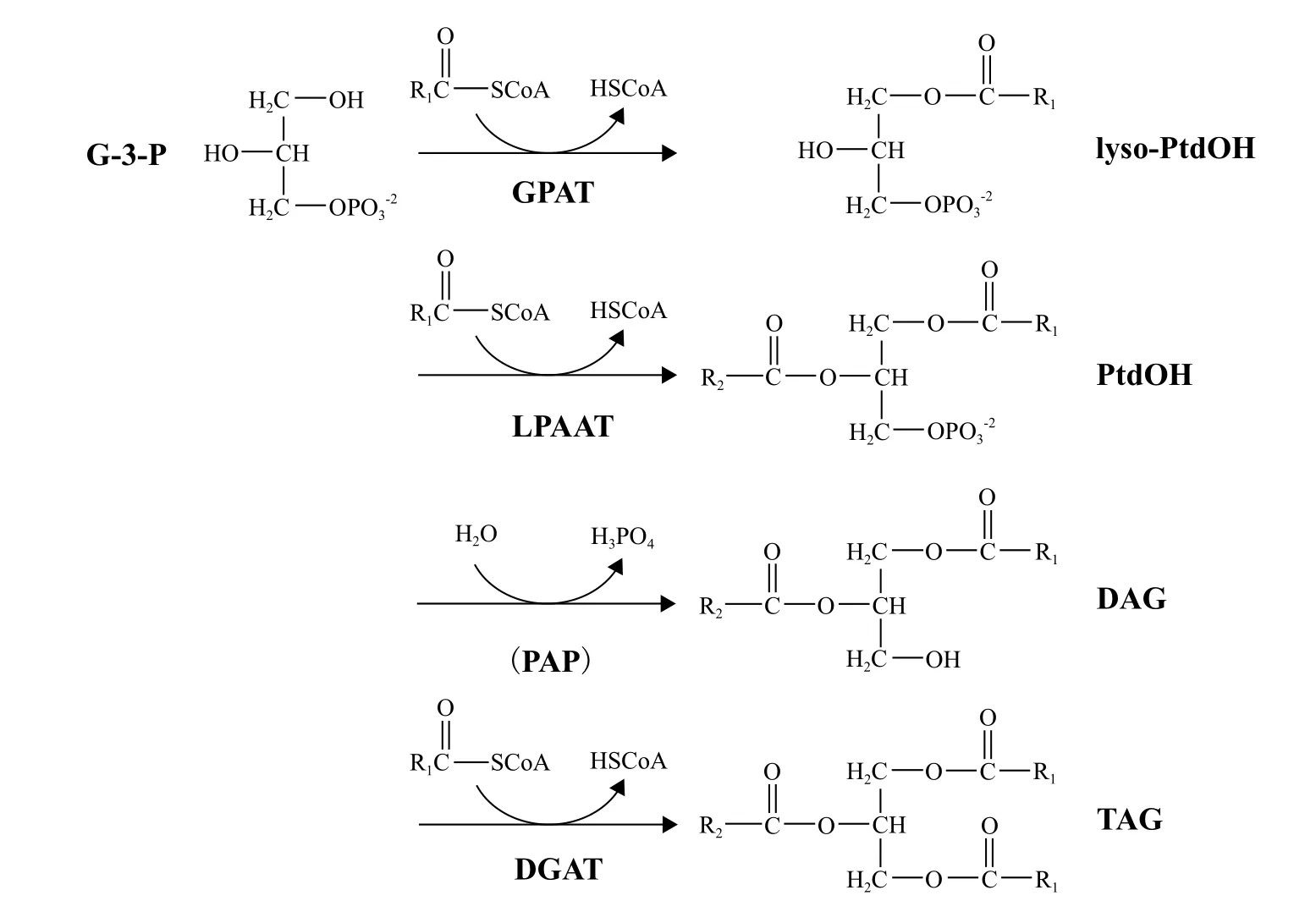
图2 TAG合成公式
G3PDH在植物和藻类中的研究报道较少。Vigeolas等[30]将一种胞质酵母的甘油-3-磷酸脱氢酶基因gpd1转化到油菜种子中,结果发现油菜种子中的含油量增加了40%,因为微藻中与脂代谢相关的大部分基因序列与陆生植物的同源性较高。由此推测,G3PDH的过表达或酶活性提高对微藻的油脂量变化有影响,目前本实验室已根据莱茵衣藻密码子偏好性合成该基因,并转入了莱茵衣藻中进行功能分析,获得了一些有意义的结果。
2.3.2 甘油-3-磷酸酰基转移酶(GPAT,EC 2.3.1.15)
GPAT是Kennedy路径的第一个酰基转移酶,负责催化脂肪酰基转移到3-磷酸甘油的sn-1位上,生成1-酰基-3-磷酸甘油。目前,多种高等植物和藻类的GPAT基因序列已经分离出来。Jain等[32]在研究莱茵衣藻膜脂代谢时发现,在光刺激条件下,莱茵衣藻膜脂代谢增加的同时,GPAT的酶活性提高至少10倍。由此推测微藻中脂产量与GPAT的活性有密切关系。通过分子生物学手段将大肠杆菌和红花(safflower)的GPAT基因转移到拟南芥中,可以增加种子的含油量和重量,使得拟南芥油脂含量分别提高了15%和22%。Misra等[31]对7种藻类和3种高等植物质体中的GPAT进行了序列结构分析,研究GPAT的进化过程发现,莱茵衣藻、拟南芥和大豆的GPAT序列虽然不同,但都有保守的拓扑结构14α螺旋和9β折叠。这些研究为利用gpat构建基因工程藻提供了重要依据。
2.3.3 溶血磷脂酸酰基转移酶(LPAAT,EC 2.3.1.51)
LPAAT负责催化脂酰-CoA上的脂肪酸酰基转移到溶血磷脂酸的sn-2位,生成磷脂酸(PA)。对高等植物中的研究主要集中在花生、拟南芥和油菜中,它提高产油量的效果显著。将一个酵母的sn-2酰基转移酶(SLC1-1)转入到基因缺陷型的酵母中,证明该基因编码的酶可以催化sn-1位溶血磷脂酸,转入拟南芥后,它能使种子中的油脂含量提高8%-48%不等,其中超长链脂肪酸所占比例明显增多[33]。Knutzon等[34]将来自椰子中的lpaat基因和福尼亚月桂树中的硫酯酶基因共同转入油菜中,使得月桂酸产量提高,除了出现在固定位置sn-1和sn-3积累外,在sn-2位上也有积累,菜籽油中的月桂酸含量增加了50%。
研究发现,莱茵衣藻在胁迫条件下脂肪酸含量增加时,lpaat等基因的表达量也相应升高,利用基因敲除技术减少lpaat表达量后,中性脂含量降低了20%[35],由此推测,调节lpaat基因的表达量或者增加LPAAT酶的活性可以增加藻类脂肪酸含量。最近的研究表明,LPAAT酶等作用下生成的磷脂对人类疾病,如Chanarin-Dorfman综合征、癌症、过渡肥胖和二十二碳六烯酸(docosahexaenoic acid,DHA,22∶6)的产量等均有影响[36,37]。
2.3.4 甘油二酯酰基转移酶(DGAT,EC 2.3.1.20)
甘油二酯酰基基转移酶(diacylglycerol acyltransferase,DGAT)是三酰甘油合成的最后一个酶,催化二酰甘油(DAG)生成三酰甘油,同时也可以催化磷脂酸生成二酰甘油,使其进入油脂生物合成路径,是TAG合成反应的重要限速酶。DGAT主要分为4种类型:DGAT1、DGAT2、Cyto DGAT和WS/DGAT。DGAT1和DGAT2蛋白主要结合在内质网膜上,是微粒体酶;Cyto DGAT和WS/DGAT是近年发现的新类型。
DGAT的过表达已经在酵母、哺乳动物、植物和昆虫中实现[38-40],证实对于脂肪酸含量都有影响。最早关于DGAT影响产油量的报道是在2001年,Jako等[41]将DGAT的cDNA导入野生型拟南芥中进行过量表达,结果DGAT的活性增加了10%-70%,种子含油量也有所增加。将拟南芥的dgat基因分别在酵母和烟草中进行过量表达,使得酵母中DGAT活性增加了200-600倍,TAG含量提高为原来的3-9倍,烟草中TAG含量提高7倍。Zhang等[2]用特异性hpRNA沉默烟草中的DGAT1基因,烟草种子的含油量下降了9%-49%。过量表达DGAT使得脂肪酸含量显著提高,这可能是因为DGAT催化两条相关代谢步骤,使得更多的二酰甘油生成TAG。
莱茵衣藻因其培养简单、背景清晰、转化技术成熟成为微藻研究领域的模式生物,也是研究脂肪酸合成代谢最好的试验材料。Lv等[35]在对莱茵衣藻积累脂肪酸时的转录进行分析时发现,超过2 500种基因的上调,lpaat和dgat被抑制后,脂肪酸产量下降。本实验室目前将经过密码子优化的lpaat和gpd1基因转入莱茵衣藻中,研究其基因表达量和脂肪酸含量提高程度,取得了较好的研究结果,为获得油脂含量高的基因工程藻提供了新思路。
3 旁路代谢路径的调控
旁路代谢路径是指除脂肪酸代谢路径之外的其他代谢路径,如三羧酸循环等。这些路径分担了部分碳流,使得流向脂肪酸合成的碳源变少,所以对于这些代谢路径中关键酶的调节通常会影响到脂肪酸的含量。
3.1 磷酸烯醇丙酮酸羧化酶(PEPC,EC4.1.1.31)
磷酸烯醇式丙酮酸羧化酶(phosphoenolpyruvate carboxylase,PEPC)是一种在有机体中广泛存在的细胞质酶,主要存在于古细菌、细菌、单细胞绿藻和维管束植物等有机体中[42]。在C4植物和景天酸代谢(crassulacean acid metabolism,CAM)植物中,PEPC在CO2固定过程中起到重要作用;在C3植物和非光合组织中,PEPC在柠檬酸反应中催化不可逆反应,使得磷酸烯醇式丙酮酸盐(PEP)生成草酰乙酸盐(OAA)。所以,PEPC是碳源是否流向脂肪酸合成链的关键酶。
在对磷酸烯醇式丙酮酸羧化酶的研究中,可以利用RNA沉默技术抑制pepc的表达。1999年Chen等[3]发现,油菜籽中的pepc沉默后,其产油量提高了6.4%-18%,表明脂肪酸含量与PEPC酶活性为负相关,同样的研究结果也出现在微藻中。在莱茵衣藻和三角褐指藻中,利用RNAi技术使pepc1和pepc2基因沉默后,莱茵衣藻(C. reinhardtii)的油脂含量分别提高了14%-28%和20%[43]。另外,通过抑制PEPC酶活性,同样可以显著提高微藻(如绿藻,硅藻等)的脂含量[44,45]。
3.2 柠檬酸合成酶(CIS,E.C. 2.3.3.1)
柠檬酸合成酶是三羧酸反应循环的第一步,有多种同工酶,存在各种亚细胞结构中,在多种生理代谢路径中起作用,位于线粒体中的柠檬酸合成酶在三羧酸循环中起到限制性酶的作用,负责将乙酰辅酶A催化成柠檬酸。
在对植物和动物的研究中发现,柠檬酸合成酶的作用主要集中在如下3方面:(1)该基因的过表达可以促进农作物分泌柠檬酸,促进磷在土壤中的溶解,增加土壤中磷的利用率[46,47];(2)增加细胞对铝毒素的抵抗作用[48];(3)CIS基因的表达与水果成熟过程中有机酸的积累有关。Zhang等[49,50]发现,在松子果成熟期间,柠檬酸含量与CIS的活性有关。
早在1973年,Taylor等[51]研究了4种蓝藻的CIS活性发现,在胁迫条件下更多的碳原子进行脂肪酸合成时,CIS活性下降。Deng等[52]最近研究了莱茵衣藻中的CrCIS与脂肪酸含量的关系,利用RNAi抑制CrCIS的活性,使得莱茵衣藻中的TAG含量增加了169.5%,结果表明莱茵衣藻中柠檬酸合成酶的活性可以影响脂肪酸的积累代谢。
近年来,RNA干扰技术逐渐被microRNA技术所代替,microRNA是一类长度很短的非编码调控单链小分子RNA,由一段具有茎环结构的长度为70-80 nt的单链RNA前体经过Dicer加工之后的一类非编码的小RNA分子(约21-23个核苷酸),在动物和植物中广泛表达,是一类新型的调控基因表达的小分子RNA,它作为基因表达的负调控因子,在转录后水平调节靶基因的表达。因此,利用microRNA技术调控的专一性更强,表达也更稳定,可控性更好[45,53]。
4 脂肪酸分解代谢路径
脂肪酸和TAG合成相关基因的激活或者脂肪酸β-氧化酶对应基因的失活,都可以增加脂肪酸产量。在提高微藻脂肪酸产量的策略中,减少脂肪酸的分解代谢也是重要的方法之一。脂肪酸的分解代谢路径主要是β-氧化,具体的脂肪酸分解路径,如图3,它存在于真核生物的线粒体基质和原核生物的细胞溶胶中,现阶段该方法多在高等植物和酵母中实验成功。
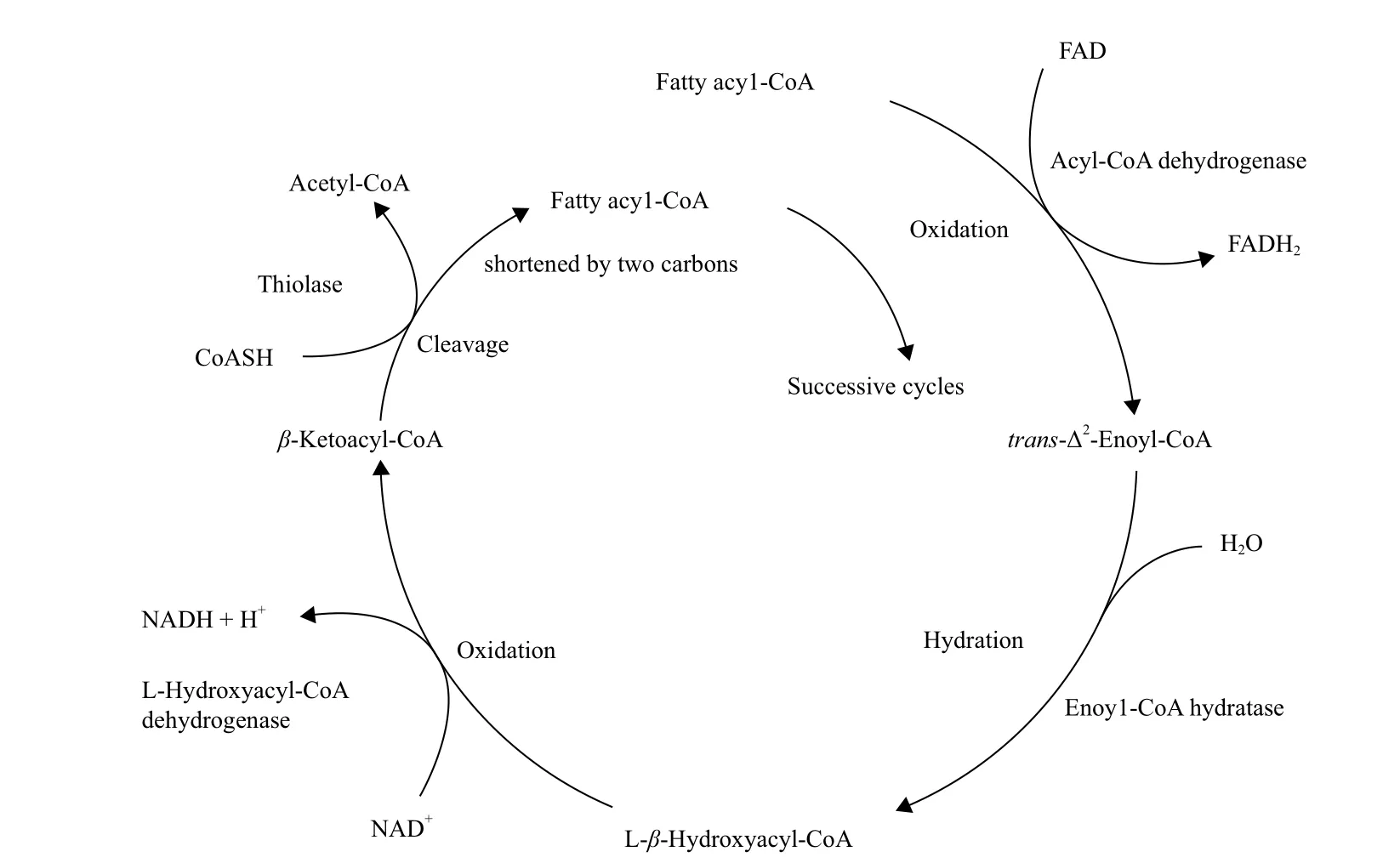
图3 脂肪酸分解代谢路径图
在一些情况下,细胞依靠脂肪酸β氧化提供能量,敲除脂肪酸分解代谢对应基因后,在增加脂肪酸储存量的同时也会影响细胞的生长和增值。例如,在拟南芥中,将过氧化物酶长链乙酰辅酶A合成酶抑制后,同工酶LACS6和LACS7失活,虽然种子的油脂含量增加了,但是种子由于碳源的缺失使得生长速度受到抑制[17]。Germain等[18]还将3-酮脂酰-CoA硫解酶(KAT2)失活,结果也是相同的。
脂肪酸氧化有多个酶共同参与,完全抑制这个过程的难度较大。拟南芥中含有短链乙酰辅酶A氧化酶,包括ACX3和ACX4,如果只是突变其中一个基因,拟南芥种子的生长和脂肪酸的代谢并未受到影响,如果两个基因同时突变会导致拟南芥死亡[19]。通过基因工程技术敲除酿酒酵母(S. cerevisiae)中的β氧化酶基因,不仅使得内源性脂肪酸含量增加,还可以促进脂肪酸的胞外分泌[14,54,55]。
5 诱发突变
突变在自然界中广泛存在,实验中用到的多为诱发突变,即人为条件下诱发产生的基因突变。通过基因突变改造微藻,使其产油量提高,也是一种可行性较高的方法。诱发突变的方法常用的有紫外诱变、抗性基因插入等,这些方法适用范围广,且便于操作。还可以通过抑制其他化合物代谢路径(如淀粉合成路径)来增加脂肪酸合成。研究显示,利用插入突变得到莱茵衣藻的两个淀粉合成缺陷株sta6和sta7,发现其ADP-葡糖焦磷酸化酶基因异淀粉酶基因功能受损[1]。2006年,Ramazanov等[56]通过紫外诱变获得小球藻(Chlorella pyrenoidosa)的淀粉突变株,它的不饱和脂肪酸含量有所提高。2013年,刘飞飞等[57]将博来霉素抗性基因ble随机插入三角褐指藻基因组中,构建突变体文库,筛选得到含油量显著变化的突变株。但是,利用诱发突变筛选突变株的不确定性高,目的性不强,筛选工作量大。
6 分泌型藻株
利用微藻制备生物柴油需要通过大规模的培养获得足够多的微藻来提取油脂,微藻由于体积微小导致后续收集成本较高,除了步骤繁琐,花费也比较大。例如,利用静置沉淀或者絮凝沉淀等收集藻细胞可以节约成本,但存在耗时长、需要进一步脱水处理等问题。目前可替代的方法是离心法和过滤法,其优点是耗时短,但成本较高。大多数产油微藻有坚硬的细胞壁,这使得提取油脂难度加大。有一种解决方法是改造微藻细胞,使其将油脂自动分泌到培养液中,通过油水分离可以获得藻细胞中合成的油脂。
6.1 酵母中自由脂肪酸的分泌
如上所述,在脂代谢中,β-氧化酶基因的失活在某些情况下会导致脂肪酸分泌,通过对缺陷型酵母的研究,确定了这些基因在脂肪酸分泌中有重要作用[14,54]。酿酒酵母(S. cerevisiae)中有5种基因与脂肪酸乙酰辅酶A合成酶活性有关,包括编码FAA1和FAA4的基因。FAA1和FAA4同时失活或者FAA1和乙酰辅酶A氧化酶同时失活都会导致细胞内自由脂肪酸的累积和分泌,但脂肪酸的分泌往往会减少细胞数目[14],原因是脂肪酸的分泌主要发生在酵母的对数生长期,而脂肪酸的积累则发生在细胞的平台期[55]。酵母中TAG或者自由脂肪酸分泌的机制尚不清晰。根据研究可知,任何使得酵母细胞积累高水平自由脂肪酸的机制都可以使自由脂肪酸从细胞中分泌出来。Roessler等[58]通过合成基因组学研究发现了蓝细菌也存在类似的脂肪酸分泌机制。
6.2 脂肪酸和相关化合物的分泌机制
目前,一些亲脂性化合物的分泌路径已明确,包括从肝细胞分泌的含有TAG的极低密度脂(VLDL)小泡、从乳腺分泌的含TAG小泡和由多种碳氢化合物组成的植物蜡的ABC转运机制[59,60]。除了细胞输出路径,还有许多细胞内不同细胞器之间的脂肪酸运输也已经了解清楚,如脂肪酸进入线粒体和过氧物酶体进行β氧化,或许可以利用这些机制将脂肪酸运输到细胞外。这些路径中一些主要的基因已经明确,ABC转运体(transporters)的转基因表达已经应用于药物运输。然而,这些成功的转基因表达和脂肪酸分泌路径的改造是否适合生物燃料的生产,有待进一步证实[61,62],明确的分泌机制也有待进一步探索。
目前,促进微藻分泌脂肪酸最直接的方法就是利用ABC转运体。ABC转运体可以介导植物细胞中蜡质的分泌,也可以将长链脂肪酸运输到过氧化物酶体中进行β-氧化。拟南芥(A. thaliana)中已经发现超过120种不同的ABC转运体,它们除了转运超长链脂肪酸外,还可以转运其他次级代谢产物,如萜类化合物。研究发现,拟南芥中的Desperado/ AtWBC11转运体和Cer5/AtWBC12转运体能够促进蜡分泌到植物表层[63,64]。另外,ABC转运系统相关酶基因的转基因表达可以增加卡那霉素、胆固醇和固醇等化合物的输出[65-67]。
总之,利用微藻制备生物柴油尚处于试验阶段,通过基因工程技术促进脂肪酸分泌到培养系统,并利用油水分离收集脂肪酸,其成本较传统的生产工艺低很多,但是脂肪酸的分泌量还很难达到工业化生产的需要,需要人们对脂肪酸分泌机制了解更多,最终实现可应用的脂肪酸分泌系统和技术[68,69]。
7 展望
随着陆地资源的减少,海洋资源的开发逐渐被人们关注,其中,微藻能源的开发就是研究的重点。微藻是多样化的有机体,具有许多独特的代谢特性:高光合传递速率、快速的生物量生产速率、适应多种环境和可以生产多种类的生物柴油等特点。基于微藻制备生物燃料的战略意义,多国包括中国投入了大量的人力、物力,已经取得了阶段性的成果。许多藻类的基因组序列已经测序完毕,如莱茵衣藻、三角褐指藻和小球藻等。微藻的遗传转化体系也日渐完善,莱茵衣藻、小球藻、盐藻和硅藻等已建立了高效的表达体系。另外,微藻积累脂肪酸的机制、脂肪酸合成相关基因的克隆及功能研究也已经完成,对其合成调控机制有了初步认识。同时,利用基因工程手段提高脂肪酸合成相关酶基因的转录及表达水平的研究也表现出不同的效果,某些FAS酶和TAG组装酶对油脂合成的影响较明显,Kennedy路径中任何一种酰基转移酶的表达量增加都会导致TAG含量增加[1]。生物体内的代谢路径相互联系、相互影响,对于其他代谢路径,如三羧酸循环和磷脂酸合成路径的调节均会影响到脂肪酸含量的变化。如用反义RNA技术对pepc基因进行调控,使得微藻莱茵衣藻的脂肪酸含量提高了20%[44]。以上研究也说明微藻中脂肪酸代谢体系比较复杂,是一个多酶参加的生物合成过程,受到多种因素的影响,还有未知的调控机制在起作用。因此,也有人试图通过转录因子来调控脂肪酸的合成代谢,它不只是调控一种酶而是对应着多个基因,效果会更明显,这也是未来微藻油脂合成调控研究的重要方向。
尽管微藻产油存在多种优势,但相比陆地植物来说,其大规模培养仍然受限,尚有许多问题需要解决,如脂肪酸代谢路径、密码子偏好性、高表达载体等方面。微藻大规模培养技术及获得油脂含量达到商业开发水平的工程藻仍是整个生产环节的关键。微藻的培养和收集模式以及后期脂肪酸提取方法的革新都可能会降低生产成本。未来关于基因工程藻的研究可能集中在如下几个方向:(1)Kennedy路径中各个酰基转移酶的改造;(2)利用转录因子综合调控脂类代谢过程;(3)研究脂肪酸自动分泌的相关基因,以减少脂肪酸的提取成本。
[1]Radakovits R, Jinkerson RE, Darzins A, et al. Genetic engineering of algae for enhanced biofuel production[J]. Eukaryotic Cell, 2010,9(4):486-501.
[2]Zhang FY, Yang MF, Xu YN. Silencing of DGAT1 in tobacco causes a reduction in seed oil content[J]. Plant Science, 2005, 169(4):689-694.
[3]陈锦清, 郎春秀, 胡张华, 等. 反义PEP基因调控油菜籽粒蛋白质/油脂含量比率的研究[J]. 农业生物技术学报, 1999, 7(4):316-320.
[4] 姚茹, 程丽华, 徐新华, 等. 微藻的高油脂化技术研究进展[J].化学进展, 2010, 22(6):1221-1232.
[5]夏金兰, 万民熙, 王润民, 等. 微藻生物柴油的现状与进展[J].中国生物工程杂志, 2009, 29(7):118-126.
[6]Merchant SS, Prochnik SE, Vallon O, et al. The Chlamydomonas genome reveals the evolution of key animal and plant functions[J]. Science, 2007, 318(5848):245-250.
[7]王金娜, 严小军, 周成旭, 等. 产油微藻的筛选及中性脂动态积累过程的检测[J]. 生物物理学报, 2010, 26(6):472-480.
[8]朱顺妮, 王忠铭, 尚常花, 等. 微藻脂肪合成与代谢调控[J].化学进展, 2011, 23(10):2169-2176.
[9]李兴军, 林文亚. 利用遗传工程提高油料作物含油量的研究进展[J]. 粮食科技与经济, 2010, 35(6):33-36.
[10]Hu Q, Sommerfeld M, Jarvis E, et al. Microalgal triacylglycerols as feedstocks for biofuel production:perspectives and advances[J]. The Plant Journal, 2008, 54:621-639.
[11]赫冬梅, 段舜山. 代谢调控在微藻油脂累积中的作用[J]. 生态科学, 2009, 28(1):85-89.
[12]Georgianna DR, Mayfield SP. Exploiting diversity and synthetic biology for the production of algal biofuels[J]. Nature, 2012,488:329-330.
[13]Sheehan J, Dunahay T, Benemann J, et al. A look back at the US Department of Energy's aquatic species program:biodiesel from algae[M]. Colorado:National Renewable Energy Laboratory,1998:328.
[14]Michinaka Y, Shimauchi T, Aki T, et al. Extracellular secretion of free fatty acids by disruption of a fatty acyl-CoA synthetase gene in Saccharomyces cerevisiae[J]. Journal of Bioscience andBioengineering, 2003, 95(5):435-440.
[15]于水燕, 赵权宇, 史吉平. 固碳产油微藻的基因工程改造[J].中国生物工程杂志, 2012, 32(12):117-124.
[16]Sinetova MA, Kupriyanova EV, Markelova AG, et al. Identification and functional role of the carbonic anhydrase Cah3 in thylakoid membranes of pyrenoid of Chlamydomonas reinhardtii[J]. Biochimica et Biophysica Acta, 2012, 1817:1248-1255.
[17]Fulda M, Schnurr J, Abbadi A, et al. Peroxisomal acyl-CoA synthetase activity is essential for seedling development in Arabidopsis thaliana[J]. The Plant Cell, 2004, 16(2):394-405.
[18]Germain V, Rylott EL, Larson TR, et al. Requirement for 3-ketoacyl-CoA thiolase-2 in peroxisome development, fatty acid β-oxidation and breakdown of triacylglycerol in lipid bodies of Arabidopsis seedlings[J]. The Plant Journal, 2001, 28(1):1-12.
[19]Rylott EL, Rogers CA, Gilday AD, et al. Arabidopsis mutants in short- and medium-chain acyl-CoA oxidase activities accumulate acyl-CoAs and reveal that fatty acid β-oxidation is essential for embryo development[J]. The Journal of Biological Chemistry,2003, 278:21370-21377.
[20]Shi S, Chen Y, Siewers V, et al. Improving production of malonyl coenzyme A-derived metabolites by abolishing Snf1-dependent regulation of Acc1[J]. MBio, 2014, 5:1-8.
[21]Davis MS, Solbiati J, Cronan JE. Overproduction of acetyl-CoA carboxylase activity increases the rate of fatty acid biosynthesis in Escherichia coli[J]. Journal of Biological Chemistry, 2000, 275:28593-28598.
[22]Dunahay TG, Jarvis EE, Roessler PG. Genetic transformation of the diatoms Cyclotella cryptica and Navicula saprophila[J]. Journal of Phycology, 1995, 31(6):1004-1012.
[23]Dehesh K, Tai H, Edwards P, et al. Overexpression of 3-ketoacylacyl-carrier protein synthase IIIs in plants reduces the rate of lipid synthesis[J]. Plant Physiology, 2001, 125:1103-1114.
[24] Griffiths MJ, Harrison STL. Lipid productivity as a key characteristic for choosing algal species for biodiesel production[J]. Journal of Applied Phycology, 2009, 21:493-507.
[25] Mutanda T, Ramesh D, Karthikeyan S, et al. Bioprospecting for hyper-lipid producing microalgal strains for sustainable biofuel production[J]. Bioresource Technology, 2011, 102:57-70.
[26]Larkum AWD, Ross IL, Kruse O, et al. Selection, breeding and engineering of microalgae for bioenergy and biofuel production[J]. Trends in Biotechnology, 2011, 30:198-205.
[27]冯国栋, 程丽华, 徐新华, 等. 微藻高油脂化基因工程研究策略[J]. 化学进展, 2012, 24:1413-1426.
[28]Kim JW. Topical prostaglandin analogue drugs inhibit adipocyte differentiation[J]. Korean Journal of Ophthalmology, 2014, 28:257-264.
[29]Yi B, Wang J, Wang S, et al. Overexpression of Banna mini-pig inbred line fatty acid binding protein 3 promotes adipogenesis in 3T3-L1 preadipocytes[J]. Cell Biology International, 2014, 38:918-923.
[30] Vigeolas H, Waldeck P, Zank T, et al. Increasing seed oil content in oil-seed rape(Brassica napus L. )by over-expression of a yeast glycerol-3-phosphate dehydrogenase under the control of a seedspecific promoter[J]. Plant Biotechnology Journal, 2007, 5:431-441.
[31]Misra N, Panda PK. In search of actionable targets for agrigenomics and microalgal biofuel production:sequence-structural diversity studies on algal and higher plants with a focus on GPAT protein[J]. OMICS:A Journal of Integrative Biology, 2013,17:173-186.
[32]Jain RK, Coffey M, Lai K, et al. Enhancement of seed oil content by expression of glycerol-3-phosphate acyltransferase genes[J]. Biochemical Society Transactions, 2000, 28:958-961.
[33]Zou J, Katavic V, Giblin EM, et al. Modification of seed oil content and acyl composition in the brassicaceae by expression of a yeast sn-2 acyltransferase gene[J]. The Plant Cell, 1997, 9:909-923.
[34]Knutzon DS, Hayes TR, Wyrick A, et al. Lysophosphatidic acid acyltransferase from coconut endosperm mediates the insertion of laurate at the sn-2 position of triacylglycerols in lauric rapeseed oil and can increase total laurate levels[J]. Plant Physiology, 1999,120:739-746.
[35]Lv H, Qu G, Qi X, et al. Transcriptome analysis of Chlamydomonas reinhardtii during the process of lipid accumulation[J]. Genomics, 2013, 101:229-237.
[36]Pingitore P, Pirazzi C, Mancina RM, et al. Recombinant PNPLA3 protein shows triglyceride hydrolase activity and its I148M mutation results in loss of function[J]. Biochimica et Biophysica Acta,2014, 1841:574-580.
[37]Eto M, Shindou H, Shimizu T. A novel lysophosphatidic acid acyl-transferase enzyme(LPAAT4)with a possible role for incorporating docosahexaenoic acid into brain glycerophospholipids[J]. Biochemical and Biophysical Research Communications, 2014,443:718-724.
[38]Lardizabal K, Effertz R, Levering C, et al. Expression of Umbelopsis ramanniana DGAT2A in seed increases oil in soybean[J]. Plant Physiology, 2008, 148:89-96.
[39]Zheng P, Allen WB, Roesler K, et al. A phenylalanine in DGAT is a key determinant of oil content and composition in maize[J]. Nature Genetics, 2008, 40:367-372.
[40]Bouvier-Navé P, Benveniste P, Oelkers P, et al. Expression in yeast and tobacco of plant cDNAs encoding acyl CoA:diacylglycerol acyltransferase[J]. European Journal of Biochemistry, 2000,267:85-96.
[41]Jako C, Kumar A, Wei Y, et al. Seed-specific over-expression of an Arabidopsis cDNA encoding a diacylglycerol acyltransferase enhances seed oil content and seed weight[J]. Plant Physiology,2001, 126:861-874.
[42]Deng X, Li Y, Fei X. The mRNA abundance of pepc2 gene is negatively correlated with oil content in Chlamydomonas reinhardtii[J]. Biomass and Bioenergy, 2011, 35(5):1811-1817.
[43]Deng X, Cai J, Li Y, et al. Expression and knockdown of the PEPC1 gene affect carbon flux in the biosynthesis of triacylglycerols by the green alga Chlamydomonas reinhardtii[J]. Biotechnology Letters, 2014, 108:56-67.
[44]De Riso V, Raniello R, Maumus F, et al. Gene silencing in the marine diatom Phaeodactylum tricornutum[J]. Nucleic Acids Research, 2009, 57:66-78.
[45]Molnar A, Bassett A, Thuenemann E, et al. Highly specific gene silencing by artificial microRNAs in the unicellular alga Chlamydomonas reinhardtii[J]. The Plant Journal, 2009, 58(1):165-174.
[46]Tong J, Zhang GM, Wang XF, et al. Cloning of citrate synthase gene in rapeseed(Brassica napus L. )and its expression under stresses[J]. Acta Agronomica Sinica, 2009, 35:33-40.
[47]Hu LH, Wu HM, Zhou ZM, et al. Introduction of citrate synthase gene(CS)into an elite indica rice restorer line Minghui 86 by agrobacterium -mediated method[J]. Molecular Plant Breeding,2006, 4:160-166.
[48]Barone P, Rosellini D, LaFayette P, et al. Bacterial citrate synthase expression and soil aluminum tolerance in transgenic alfalfa[J]. Plant Cell Reports, 2008, 27(5):893-901.
[49]Chi GH, Zhou XL, Li MY, et al. Cloning and bioinformatics analysis of MaGCS encoding a homolog citrate synthase from banana[J]. Chinese Journal of Tropical Agriculture, 2009, 29:12-18.
[50]Zhang XM, Du LQ, Sun GM, et al. Changes in organic acid concentrations and the relative enzyme activities during the development of Cayenne pineapple fruit[J]. Journal of Fruit Science, 2007, 24:381-384.
[51]Taylor BF. Fine control of citrate synthase activity in blue-green algae[J]. Arch Mikrobiol, 1973, 92(3):245-249.
[52]Deng X, Cai J, Fei X. Effect of the expression and knockdown of citrate synthase gene on carbon flux during triacylglycerol biosynthesis by green algae Chlamydomonas reinhardtii[J]. BMC Biochemistry, 2013, 14:38-49.
[53]Zhao T, Wang W, Bai X, et al. Gene silencing by artificial microRNAs in Chlamydomonas[J]. The Plant Journal, 2009, 58(1):157-164.
[54]Nojima Y, Kibayashi A, Matsuzaki H, et al. Isolation and characterization of triacylglycerol-secreting mutant strain from yeast, Saccharomyces cerevisiae[J]. The Journal of General and Applied Microbiology, 1999, 45:1-6.
[55]Scharnewski M, Pongdontri P, Mora G, et al. Mutants of Saccharomyces cerevisiae deficient in acyl-CoA synthetases secrete fatty acids due to interrupted fatty acid recycling[J]. FEBS Journal, 2008, 275(11):2765-2778.
[56]Ramazanov A, Ramazanov Z. Isolation and characterization of a starchless mutant of Chlorella pyrenoidosa STL-PI with a high growth rate, and high protein and polyunsaturated fatty acid content[J]. Phycological Research, 2006, 54(4):255-259.
[57]刘飞飞, 李秀波, 方仙桃, 等. 三角褐指藻产油突变株的筛选[J]. 水生生物学报, 2013, 37(4):799-802.
[58]Roessler PG, Chen Y, Liu B, et al. Secretion of fatty acids by photosynthetic microorganisms:US, US20080333280[P]. 2009-12-3.
[59]Gibbons GF, Islam K, Pease RJ. Mobilisation of triacylglycerol stores[J]. Biochimica et Biophysica Acta, 2000, 1483(1):37-57.
[60]Lehner R, Vance DE. Cloning and expression of a cDNAencoding a hepatic microsomal lipase that mobilizes stored triacylglycerol[J]. Biochemical Journal, 1999, 343:1-10.
[61] Tietge UJF, Bakillah A, Maugeais C, et al. Hepatic overexpression of microsomal triglyceride transfer protein(MTP)results in increased in vivo secretion of VLDL triglycerides and apolipoprotein B[J]. The Journal of Lipid Research, 1999, 40:2134-2139.
[62]McManaman JL, Russell TD, Schaack J, et al. Molecular determinants of milk lipid secretion[J]. Journal of Mammary Gland Biology and Neoplasia, 2007, 12(4):259-268.
[63]Panikashvili D, Savaldi-Goldstein S, Mandel T, et al. The Arabidopsis DESPERADO/AtWBC11 transporter is required for cutin and wax secretion[J]. Plant Physiology, 2007, 145:1345-1360.
[64]Pighin JA, Zheng H, Balakshin LJ, et al. Plant cuticular lipid export requires an ABC transporter[J]. Science, 2004, 306:702-704.
[65]Janvilisri T, Venter H, Shahi S, et al. Sterol transport by the human breast cancer resistance protein(ABCG2)expressed in Lactococcus lactis[J]. The Journal of Biological Chemistry, 2003, 278:20645-20651.
[66]Mentewab A, Stewart CN. Overexpression of an Arabidopsis thaliana ABC transporter confers kanamycin resistance to transgenic plants[J]. Nature Biotechnology, 2005, 23:1177-1180.
[67]Yu L, Gupta S, Xu F, et al. Expression of ABCG5 and ABCG8 is required for regulation of biliary cholesterol secretion[J]. The Journal of Biological Chemistry, 2005, 280:8742-8747.
[68]Hayashi M, Nito K, Takei-Hoshi R, et al. Ped3p is a peroxisomal ATP-binding cassette transporter that might supply substrates for fatty acid beta-oxidation[J]. Plant and Cell Physiology, 2002, 43(1):1-11.
[69]Zolman BK, Silva ID, Bartel B. The Arabidopsis pxa1 mutant is defective in an ATP-binding cassette transporter-like protein required for peroxisomal fatty acid beta-oxidation[J]. Plant Physiology, 2001, 127(3):1266-1278.
(责任编辑 狄艳红)
Research Advances of Genetic Engineering of Microalgae for Improving Lipid Production
Li Yi Wang Chaogang Hu Zhangli
(Shenzhen Key Laboratory of Marine Bioresources and Ecology,College of Life Sciences,Shenzhen University,Shenzhen 518060)
In recent years, microalgae oil biodiesel has become a hot spot because of its strategic importance. Microalgae are a promising feedstock for biodiesel due to their short growth cycle, easy to mass culture, ability to absorb CO2and no taking farmland, etc. However, largescale development and utilization of microalgae biomass energy is limited by less knowledge about metabolic mechanisms of lipid synthesis and lagging research of genome in microalgae. With the development of modern biotechnology, improving lipid content and biomass of microalgae may achieve through genetic engineering and metabolic engineering methods. This review describes recent efforts to metabolic mechanisms on lipid biosynthesis and genetic engineering techniques on increasing lipid content, which provide technical reserves for attaining high lipid transgenic microalgae and producing microalgae biodiesel.
microalgae;genetic engineering;biodiesel;lipid
10.13560/j.cnki.biotech.bull.1985.2015.04.010
2014-08-03
国家自然科学基金项目(41176106,31000162和31070323),深圳市科技计划项目(CXB201104210005A,JCYJ201206131125-12654,JSGG20130411160539208)
李逸,女,硕士研究生,研究方向:藻分子生物学;E-mail:811054831@qq.com
王潮岗,男,博士,研究方向:藻类学;E-mail:charlesw@szu.edu.cn

