醋酸钙不动杆菌的分离鉴定及溶藻特性
王赟 张业猛 李佩佩
(河南城建学院生命科学与工程学院,平顶山 467036)
醋酸钙不动杆菌的分离鉴定及溶藻特性
王赟 张业猛 李佩佩
(河南城建学院生命科学与工程学院,平顶山 467036)
淡水微囊藻水华不仅造成水体动植物缺氧死亡,而且释放藻毒素,影响人类和其它动物的健康。利用液体感染技术,从河南省平顶山市白龟山水库分离一株能够溶解铜绿微囊藻PCC 7806的溶藻菌,命名为溶藻菌5,16S rDNA核苷酸序列测序证实该菌株为醋酸钙不动杆菌。它具有一定的溶藻特异性,只溶解PCC 7806,对FACHB-930和斜生栅藻没有影响,能够促进衣藻和红球藻的生长。最佳溶藻体积比为1∶1。溶藻菌5的菌体和无细胞培养物均具有相同的溶藻效果。显微观察藻细胞被溶解的黄化液显示细菌并未附着在藻细胞周围,也无菌胶膜形成。表明溶藻菌5可能通过释放杀藻物质和与藻竞争营养物质两种机制溶解藻细胞。
溶藻菌;醋酸钙不动杆菌;16S rDNA;铜绿微囊藻;溶藻特性
近年来水体富营养化日益加剧,水华现象频繁发生,致使水体恶化严重,我国有限的淡水资源愈加匮乏。藻类分泌的毒素不仅破坏了水域生态环境,而且严重影响人体和动物的饮用水安全[1-3]。
除藻的方法主要有物理、化学和生物方法[4]。物理法有微滤法、直接过滤法、气浮除藻法等。化学法主要分为直接灭杀法、絮凝剂沉淀法和天然矿物絮凝法[5]。但物理和化学方法都不能从根本上解决水华问题,并且耗资耗时。生物控藻已经受到国内外学者的广泛关注,其中溶藻菌的研究最多。溶藻菌是水体中天然存在的一类细菌的总称[1,6],具有繁殖快、效率高和寄主特异性等特点。菌株取于环境用于环境,不会造成二次污染,节约了费用,因此溶藻菌作为一种安全有效的除藻方法[7],其深入研究有望解决水华问题。
溶藻菌可通过直接或间接方式来杀死或抑制藻类的生长[8],溶藻机理主要有以下5种:直接接触溶藻、释放溶藻物质、细菌与藻竞争营养物质、水体表面形成菌胶膜及菌进入藻细胞内杀灭藻细胞[9-11]。已鉴定的溶藻菌有假单胞菌[5,12-14]、嗜胞菌[15]、弧菌[5,16-18]、芽孢杆菌[19]、粘细菌[20]、腐生螺旋体属(Saprospira sp.)[21]、假交替单胞菌(Pseudoalteromonas nigrifaciens)[13,22,23]等,未见不动杆菌的报道。本研究分离一株高效溶藻菌,对其进行种属及特性鉴定,旨在为溶藻菌的研究提供新资源,为解决水华问题提供参考。
1 材料与方法
1.1 材料
1.1.1 藻种 微囊藻PCC 7806 和FACHB-930,红球藻、衣藻和斜生栅藻均购自武汉水生所淡水藻种中心。PCC 7806 和FACHB-930在30℃,2 000 lx的光照强度下24 h光照培养。红球藻、衣藻、斜生栅藻在25℃,2 000 lx的光照强度下24 h光照培养。
1.1.2 菌种 试验菌株从平顶山市白龟山水库中分离纯化得到,命名为溶解酶5。
1.1.3 培养基 溶藻菌用LB培养基富集培养,pH7.2;藻的培养基为BG11[22],配制方法如下:首先配置下列母液,母液1-K2HPO4·3H2O 4 g/mL,母液2-MgSO4·7H2O 7.55 g/mL,母液3-CaCl23.6 g/mL,母液4-C6H8O7·H2O(柠檬酸)0.6 g/mL,母液5-(NH4)3FeC12H10O14(柠檬酸铁铵)0.6 g/mL,母液6-EDTA·Na20.1 g/mL,母液7-Na2CO32 g/mL,A5:H3BO32.86 g/L,MnCl2·4H2O 1.81 g/L,ZnSO4·7H2O 0.222 g/L,CuSO4·5H2O 0.08 g/L,Na2·MoO4·2H2O 0.39 g/L,CoCl2·6H2O 0.01 g/L。然后按1∶1 000的比例在水中加入母液2、3、4、6、7、A5,以及1.5 g/L NaNO3,灭菌。使用前加入1/1 000的单独灭菌的母液1和5。
1.2 方法
1.2.1 溶藻菌株的分离纯化 从白龟山水库中采集的水样经过滤除杂后按20%的体积接入培养至对数生长期的铜绿微囊藻PCC 7806的藻液中,于30℃光照混合培养,待藻液黄化后,取黄化藻液经密度梯度稀释,涂布LB平板,37℃培养24 h后,挑取形态差异显著不同的单菌落,多次划线分离得到纯种菌株[24,25]。将分离的多株纯种菌株经活化扩大培养后,取30 mL菌液于离心管中4 000 r/min离心2 min,去上清,加入30 mL藻液,轻轻混匀后,30℃培养,每天观察微囊藻的生理状态,记录。根据微囊藻的黄化程度筛选出溶藻效果明显的菌株5。
1.2.2 溶藻菌5溶藻效果的测定 溶藻菌5经活化扩大培养至OD600约为1.5时,取30 mL于离心管中4 000 r/min离心2 min后,去上清,加入30 mL OD750=0.807的藻液轻轻混匀后30℃培养。每隔24 h测定叶绿素a(Chl a)含量。测定方法为:取2 mL菌藻混合液12 000 r/min离心2 min,弃上清;加2 mL甲醇重悬藻细胞,用锡纸包裹后4℃黑暗条件下放置过夜;然后12 000 r/min离心5 min;取上清以甲醇为对照测664 nm下的吸光值,然后根据下式计算叶绿素a含量:叶绿素a含量(μg/mL)=13.34×OD664。
1.2.3 溶藻所需最少菌量的确定 培养溶藻菌5至OD600为1.6,微囊藻OD750为1.27时进行试验。分别以菌藻体积比为1∶6(5 mL菌∶30 mL藻)、1∶3(10 mL菌∶30 mL藻)、2∶3(20 mL菌∶30 mL藻)和1∶1(30 mL菌∶30 mL藻)进行试验,每组设置3个平行。每天观察记录藻的生长状况。
1.2.4 菌种的鉴定 以溶藻菌5的基因组DNA为模板扩增其16S rDNA。引物:27F:5'-GAGAGTTTGATCCTGGCTCAG-3',1495R:5'-CTACGGCTACCTTGTTACGA-3'。PCR反应条件:94℃预变性5 min 20 s;94℃变性40 s,58℃退火40 s,72℃延伸90 s,扩增30个循环;70℃延伸10 min。扩增产物由上海生工进行测序。
1.2.5 溶藻机理的研究 将溶藻菌5作用后的黄化藻液用0.22 μm的纤维素膜过滤[25],得到菌体和无细胞滤液,分别用滤液和菌体感染藻液,每组3个平行,30℃培养,观察记录藻的生长状况。
1.2.6 溶藻菌5溶藻特异性的研究 研究溶藻菌5对FACHB-930、红球藻、衣藻、斜生栅藻是否具有溶藻效果。以30 mL菌液于离心管中4 000 r/min离心2 min,去上清,分别加入30 mL藻液,轻轻混匀后,30℃/25℃培养,观察记录藻的生长状况。
1.2.7 显微观察溶藻菌5感染PCC 7806 溶藻菌5感染PCC 7806后,培养数天至藻细胞即将破裂时,取培养液10 μL于载玻片上,盖上盖玻片自然干燥后用正置显微摄影系统观察藻细胞的裂解情况。
2 结果
2.1 溶藻菌的分离鉴定及系统发育分析
白龟山水库采集的水样经过滤除杂后以20%的体积接入对数生长期的毒性铜绿微囊藻PCC 7806,培养数天后将黄化藻液稀释涂平板,37℃培养24 h后挑选单菌落,经多次分离划线纯化单菌落,最终分离得到一株溶藻效果明显的溶藻菌5。
为了鉴定溶藻菌5的种属,PCR扩增其16S rDNA,电泳检测显示目的产物大小约为1.5 kb(图1)。根据测序结果构建进化树(图2)。利用ClustalX软件对溶藻菌5及其同源序列进行初步的比对分析并进行人工校正,利用MEGA6软件绘制进化树。整个进化树可以分为5大簇。溶藻菌5的基因序列与醋酸钙不动杆菌(Acinetobacter calcoaceticus)的亲缘关系最近。
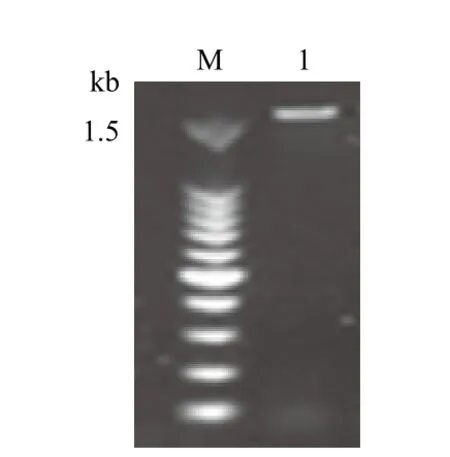
图1 PCR扩增溶藻菌5的16S rDNA
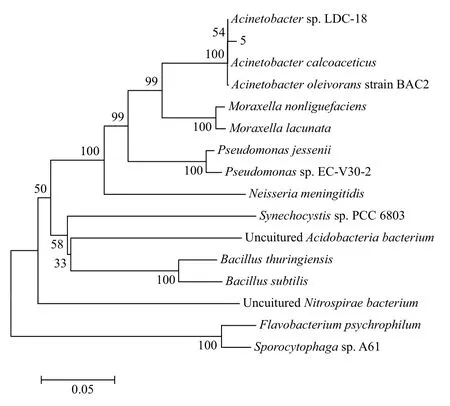
图2 溶藻菌5与其它同源序列的进化关系树
2.2 醋酸钙不动杆菌的生长和溶藻特性
醋酸钙不动杆菌的生长曲线(图3)显示,接入LB培养基后经过2 h的适应期,细菌进入对数生长期,生长迅速,12 h后生长速率有所减慢。培养8 h时OD600=1.5,处于快速生长的对数期,此后试验均以此为标准。
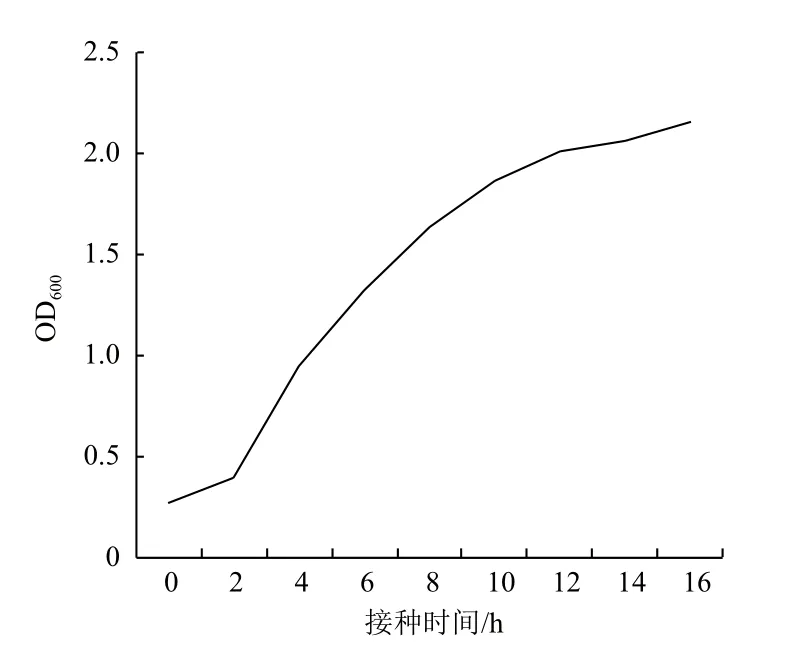
图3 醋酸钙不动杆菌的生长曲线
醋酸钙不动杆菌培养8 h后,低速离心,去上清后与等体积的PCC 7806混合,培养11 d后藻液颜色由原来的墨绿色黄化变白(图4-A,3-5号瓶),而对照组PCC 7806(图4-A,1-2号瓶)则持续生长。叶绿素a测定(图4-B)显示,菌藻混合后第2天PCC 7806叶绿素a含量逐渐降低,说明PCC 7806开始被醋酸钙不动杆菌溶解,随着时间的延长,藻细胞几乎被完全裂解。而对照组则持续生长,叶绿素a含量不断增加。
为了研究醋酸钙不动杆菌对其它藻类是否也有溶解效果,将其分别与本实验室培养的微囊藻FACHB-930、红球藻(Haematococcus sp.)、衣藻(Chlamydomonas sp.)和斜生栅藻(Scenedesmus obliquus)混合培养,结果(表1)显示,加入醋酸钙不动杆菌后,FACHB-930、斜生栅藻的叶绿素a含量与其对照组相比略微下降,溶藻效果不明显。相反,红球藻、衣藻的生长速率有所提高,其叶绿素a的含量分别高于其对照组,说明醋酸钙不动杆菌促进了红球藻和衣藻的生长。
为了确定溶藻所需最少菌量,将不同体积的醋酸钙不动杆菌(OD600=1.6)与30 mL微囊藻PCC 7806(OD750=1.27,Chl a=4.76)混合,比较溶藻效果的差异。图5显示,随着菌浓度升高,溶藻菌对藻的抑制作用就越大,菌藻比为1∶1时,叶绿素a含量明显很低,溶藻效果最为明显。初步判断菌液浓度与溶藻效果成正相关关系。

图4 醋酸钙不动杆菌感染PCC 7806后藻液颜色(A)和叶绿素a含量的变化(B)

表1 醋酸钙不动杆菌对FACHB-930、红球藻、衣藻和斜生栅藻的溶藻特征分析
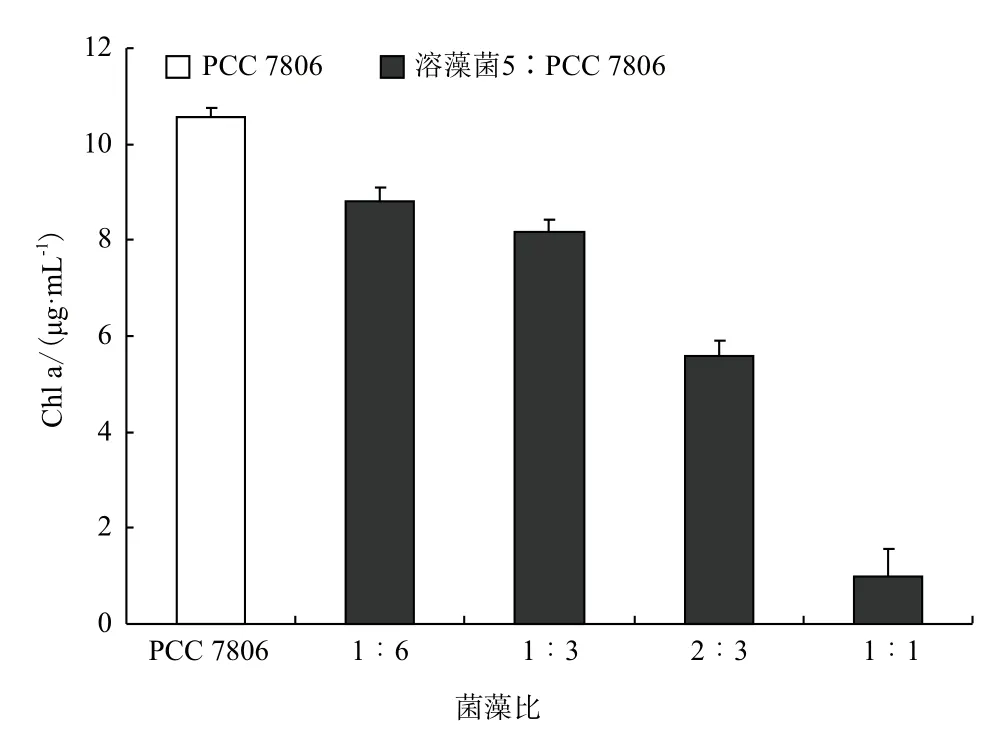
图5 不同菌量的溶藻效果
2.3 醋酸钙不动杆菌溶藻机理
利用0.22 μm的纤维素滤膜过滤醋酸钙不动杆菌的培养物,分别得到滤液和菌体,将滤液和菌体分别感染PCC 7806(图6),滤液和菌体对微囊藻PCC 7806均具有一定的溶藻效果。因此推测溶藻醋酸钙不动杆菌既可以释放胞外溶藻物质溶解,也能够通过自身来溶解藻细胞。进一步显微观察溶藻后的黄化液(图7)显示,藻细胞被裂解为片状,周围无附着细菌,也未形成菌胶膜。
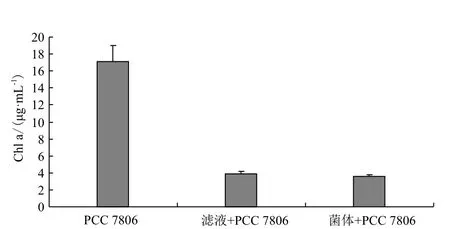
图6 醋酸钙不动杆菌培养物的滤液和菌体溶藻效果比较
3 讨论
铜绿微囊藻是我国淡水水华藻类中最为常见的一种,其毒素具有肝癌毒性。因此,寻找有效的控藻方法具有重要意义。从水体中筛选溶藻菌不会造成二次污染,已经成为生物控藻领域的热点之一。本研究从平顶山白龟山水库分离一株溶藻菌,经16S rDNA鉴定为醋酸钙不动杆菌。16S rDNA普遍存在于细菌中,相对分子量大小适中,约1.5 kb,其分子中既含有高度保守的序列区域,又有中度保守和高度变化的序列区域。可变区序列因细菌不同而异,恒定区序列高度保守,因此可利用恒定区序列设计引物,将16S rDNA片段扩增出来,利用可变区序列的差异来对不同菌的种属进行分类鉴定。因此16S rDNA是细菌的系统分类研究中最有用和最常用的分子钟。
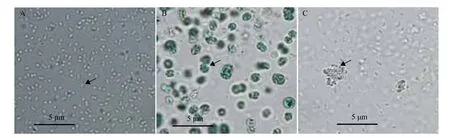
图7 醋酸钙不动杆菌(A)、PCC 7806(B)和裂解的藻细胞(C)的电镜照片
醋酸钙不动杆菌主要存在于土壤中,菌体短小呈球杆状,在LB固体养培基上是光滑、且有黏度的圆形菌落。这是首次鉴定具有溶藻效果的醋酸钙不动杆菌,为溶藻菌的研究提供了新的资源。
细菌感染藻细胞后,测定750 nm处吸光值的方法检测藻的生物量变化具有一定的误差。而叶绿素a含量能够直接反映水体藻类的生物量,因此利用叶绿素a 含量的变化作为指标来测定溶藻效果更为准确。醋酸钙不动杆菌特异性溶解微囊藻PCC 7806,对微囊藻FACHB-930和斜生栅藻没有抑制效果,却促进了红球藻和衣藻的生长。红球藻是一种淡水单细胞绿藻,富含虾青素,是继螺旋藻、小球藻之后,新发现的富含营养价值和药用价值的藻类食品。衣藻隶属于淡水单细胞真核生物,富含蛋白质,可作饲料或食用。醋酸钙不动杆菌在抑制产毒微囊藻PCC 7806生长的同时,促进了有益的红球藻和衣藻的生长,较其它的溶藻菌更具有优越性。
溶藻菌的溶藻效果不仅与自身有关,与菌的浓度也有密切关系,细菌溶藻的发生对细菌有一定浓度的要求,较低初始浓度会导致溶藻效果降低或无溶藻效果[8,26],溶藻所需最少菌量也是判断菌溶藻效果的重要指标,这与本研究结论一致。醋酸钙不动杆菌的溶藻效果与其浓度呈正相关,随着细菌数量的增加,溶藻效果增强。此外,还有研究表明溶藻菌的溶藻效果还与其生长速率密切相关[27]。醋酸钙不动杆菌生长速率快,可以迅速增加浓度,有利于生物控藻。
细菌的溶藻方式很多,可分为直接接触溶藻、释放杀藻物质、细菌与藻竞争营养物、形成菌胶膜和进入藻细胞内杀灭藻细胞。菌进入藻细胞内杀灭藻细胞的方式很罕见,已有的报道是从铜绿微囊藻中分离出的一种类似蛭弧菌的细菌,由于菌的进入,铜绿微囊藻的细胞被溶解[8]。本研究中醋酸钙不动杆菌的菌体和滤液均具有相同的溶藻效果。说明其既通过自身裂解藻细胞,也分泌溶藻物质来裂解藻细胞。显微观察显示,黄化藻液中藻细胞的表面没有粘附菌体,亦没有菌胶膜的形成,说明不是通过直接接触或形成菌胶膜溶藻。醋酸钙不动杆菌感染PCC 7806第2天,其叶绿素a含量即开始下降,而对照组持续生长,说明此时藻类生长所需的N、P、K等营养物质还十分充足,细菌不是通过与藻竞争生长所需的N、P、K等物质抑藻。已有研究表明细菌释放的特异性或非特异性的胞外物质包括蛋白质、多肽类物质以及抗生素、化学物质等[3、6、7],针对醋酸钙不动杆菌释放的溶藻物质的研究可通过蛋白酶敏感试验首先确定其是否为蛋白类。若对蛋白酶敏感,可通过SDS-PAGE电泳分离目标蛋白;若对蛋白酶不敏感,则可以通过有机溶剂萃取或者乙醇沉淀的方法分离溶藻物质进行进一步研究。
4 结论
从白龟山水库分离到一株溶藻菌,命名为溶藻菌5,经16S rDNA测序和进化树构建确定其为醋酸钙不动杆菌。醋酸钙不动杆菌特异性溶解铜绿微囊藻PCC 7806;对微囊藻FACHB-930和斜生栅藻生长无影响;能够促进红球藻和衣藻的生长。醋酸钙不动杆菌的溶藻效果随浓度增加逐渐增强,最佳溶藻体积比为1∶1。醋酸钙不动杆菌的菌体和无细胞培养液具有相同的溶藻效果。PCC 7806藻细胞裂解后未观察到细菌的粘附和菌胶膜的形成。
[1] 廖春丽, 杨闪闪, 许晨, 等. 一株溶藻细菌NP23的初步分离鉴别及其溶藻作用研究[J]. 生物技术通报, 2012(8):163-167.
[2] 孔赟, 朱亮, 徐向阳, 等. 溶藻菌发酵液及其溶藻产物的生物急性毒性试验[J]. 生态环境学报, 2012, 21(5):913-918.
[3] 孔赟. 溶藻菌分离鉴定、溶藻特性及作用机理研究[D]. 杭州:浙江大学, 2013.
[4] 方旭东, 张茜. 饮用水中藻类污染及其控制技术[J]. 天津化工, 2013, 27(3):35-37.
[5] 史顺玉. 溶藻细菌对藻类的生理生态效应及作用机理研究[D].武汉:中国科学院水生生物研究所, 2006.
[6]李晓彩, 裴海燕, 胡文容. 溶藻细菌及溶藻物质研究进展[J].工业水处理, 2007, 27(6):10-12.
[7]邓建明, 陶勇, 李大平, 董娟. 溶藻细菌及其分子生物学研究进展[J]. 应用与环境生物学报, 2009, 15(6):895-900.
[8]彭超, 吴刚, 席宇, 等. 3株溶藻细菌的分离鉴定及其溶藻效应[J]. 环境科学研究, 2002, 16(1):37-40.
[9]赵传鹏, 浦跃朴, 尹立红. 溶藻细菌及其测定评价方法的研究进展[J]. 东南大学学报, 2005, 24(3):202-205.
[10]季方, 朱毅, 郝睿, 等. 一株螺旋藻溶藻菌的分离、鉴定及溶藻特性初步研究[J]. 食品工业科技, 2012, 33(12):221-229.
[11]Kang YH, Jung SW, Joo JH, Han MS. Use of immobilized algicidal bacteria to control natural freshwater diatom blooms[J]. Hydrobiologia, 2012, 683(1):151-162.
[12] Shi S, Tang D, Liu YD. Effects of an algicidal bacterium Pseudomonas mendocina on the growth and antioxidant system of Aphanizomenon flosaquae[J]. Curr Microbiol, 2009, 59(2):107-112.
[13]邱雪婷, 钱雨婷, 周韧, 等. 溶藻菌N25的筛选及溶藻效果观察[J]. 上海交通大学学报, 2011, 31(10):1375-1379.
[14]Lee YK, Ahn CY, Kim HS, et al. Cyanobactericidal effect of Rhodococcus sp. isolated from eutrophic lake on Microcystis sp. [J]. Biotechnol Lett, 2010, 32(11):1673-1678.
[15]Doucette GJ, Mc Govern ER, Babinchak JA, et al. Algicidal bacteria active against Gymnodinium breve(dinophyceae). I. bacrerial isolation and characteriazation of killing activity[J]. J Phycol, 1999, 35(1):1447-1454.
[16]Banin E, Khare SK, Naider F, et al. Proline-rich peptide from the coral pathogen Vibrio shiloi that inhibits photosynthesis of Zooxanthellae[J]. J Appl Environ Microbiol, 2001, 67(4):1536-1541.
[17] Fu L, An X, Li D, et al. Isolation and alga-inhibiting characterization of Vibrio sp. BS02 against Alexandrium tamarense[J]. PLoS One, 2011, 27(12):2949-2956.
[18] Nakamura N, Nakano K, Sugiura N, et al. A novel cyanobacteriolytic bacteria, Bacillus cereus, isolated from a eutrophic lake[J]. J Biosci & Bioeng, 2003, 95(2):179-184.
[19] Zhao L, Chen L, Yin P. Algicidal metabolites produced by Bacillus sp. strain B1 against Phaeocystisglobosa[J]. J Ind Microbiol Biotechnol, 2014, 41(3):593-599.
[20]Furusawa G, Yoshikawa T, Yasuda A, et al. Algicidal activity and gliding motility of Saprospira sp. SS98-5[J]. J Can J Microbiol,2003, 49(2):92-100.
[21]Lee S, Kato J, Takiguchi N, et al. Involvement of an extracellular protease in algicidal activity of the marine bacterium Pseudoalteromonas sp. strain A28[J]. J Appl Environ Microbiol, 2000, 66(1):4334-4339.
[22]汪辉, 刘兆普, 魏微, 等. 一株溶藻菌的分离、鉴定及其溶藻物质的研究[J]. 中国环境科学, 2008, 28(5):461-465.
[23]Oh J, Kim MJ, Lee JY, Han MS. Isolation and characterization of algicidal bacteria from Cochlodinium polykrikoides culture[J]. Biotech Bioprocess Eng, 2011, 16(6):1124-1133.
[24]赵传鹏, 浦跃朴, 尹立红, 等. 溶微囊藻菌的分离与溶藻作用[J]. 东南大学学报, 2005, 35(4):602-606.
[25]刘晶, 潘伟斌, 秦玉洁, 等. 两株溶藻细菌的分离鉴定及其溶藻特性[J]. 环境科学与技术, 2007, 30(2):19-22.
[26] 杨淑霞, 范晓华, 钟晓莉, 刘子骥. 不动杆菌属的研究进展[J]. 中国医学创新, 2010, 7(28):192-194.
[27]裴海燕, 胡文容, 曲音波, 等. 一株溶藻细菌的溶藻特性及其鉴定[J]. 中国环境科学, 2005, 25(3):283-287.
(责任编辑 马鑫)
Isolation,Identification and Algicidal Activity of Acinetobacter calcoaceticus
Wang Yun Zhang Yemeng Li Peipei
(College of Life and Engineering,Henan University of Urban Construction,Pingdingshan 467036)
The microcystis bloom not only result in the death of the aquatic animals due to hypoxia, but also produce mycrocystins which is harmful to the human beings and wild animals. One algicidal bacterium against toxic Microcystis aeruginosa PCC 7806 was isolated from the Baiguishan Reservoir in Pingdingshan of Henan province using liquid infection technology and was named algicidal bacterium 5. The 16S rDNA sequence analysis indicated that this bacterium belongs to Acinetobacter calcoaceticus. It specifically removes PCC 7806 by cell lysis, but has no effect on FACHB-930 and Scenedesmus obliquus. Interestingly, the growth of haematococcus and Chlamydomonas reinhardtii are promoted. The algicidal effect of bacterium against PCC 7806 is better when the volume ratio of 1∶1. The thalli and cell-free filtrate shows the same lytic effect. There are no bacteria adhering to the surface of the PCC 7806. And no bacterial biofilm were observed. These results may suggest that The A. calcoaceticus may secrete substance and compete for nutrients to remove PCC 7806.
algicidal bacterium;Acinetobacter calcoaceticus;16S rDNA;Microcystis aeruginosa;algicidal characteristics
10.13560/j.cnki.biotech.bull 1985.2015.04.020
2014-08-14
河南城建学院校基金项目
王赟,女,博士,讲师,研究方向:分子生物学;E-mail:y-wang401@163.com

