抗心律失常肽10对柯萨奇B3病毒感染小鼠原代心肌细胞缝隙连接蛋白43的影响*
伍琼,杨波
抗心律失常肽10对柯萨奇B3病毒感染小鼠原代心肌细胞缝隙连接蛋白43的影响*
伍琼,杨波
目的: 建立原代心肌细胞柯萨奇B3病毒(CVB3)感染性病毒性心肌炎的模型,使用抗心律失常肽10(AAP10)对该疾病模型进行干预,观察其对小鼠原代心肌细胞及缝隙连接蛋白43(Cx43)的影响。
方法: 选取出生1~3天的BALB/C小鼠10只进行原代心肌细胞培养,分别用不同剂量的抗心律失常肽10的培养液进行干预100倍组织细胞培养半数感染量(TCID50)CVB3感染的心肌细胞,将原代小鼠心肌细胞分为细胞对照组、病毒对照组、低剂量干预组、高剂量干预组4组,每组8孔,通过蛋白免疫印迹法测定细胞缝隙连接蛋白43的表达水平。
结果:缝隙连接蛋白43相对表达水平低剂量干预组 [(71.46±2.69)%]和高剂量干预组[(83.56±3.74)%]明显高于病毒对照组[(44.92±4.49)%],随着干预剂量增加,其缝隙连接蛋白43相对表达水平进一步显著增加,差异均有统计学意义(P均<0.001)。
结论:抗心律失常肽10可保护心肌细胞,增加缝隙连接蛋白43的表达,减少病毒性心肌炎的心肌损害。
抗心律失常肽;病毒性心肌炎;缝隙连接蛋白;原代心肌细胞
Methods: A total of 10 BALB/C mice at the age of 1-3 days were used for primary myocardial cell culture, the cells were infected by 100 times of TCID50 CVB3 and then, cultured with different doses of AAP10. The cells were divided into 4 groups: Cell control group, Virus control group, Low dose APP10 group and High dose APP 10 group. The protein expression of Cx43 was examined by Western blot analysis.
Results: The protein expression of Cx43 in Low dose APP10 group (71.46 ± 2.69) % and High dose APP 10 group (83.56 ± 3.74) % were obviously higher than that in Virus control group (44.92 ± 4.49) %, and with the higher APP 10 intervention, the protein expression of Cx43 increased accordingly, all P<0.01.
Conclusion: The anti-arrhythmic peptide 10 may protect myocardial cells, increase Cx43 expression and reduce myocardial injury from viral myocarditis in experimental mice.
(Chinese Circulation Journal, 2015,30:379.)
病毒性心肌炎是心血管临床上的常见病、多发病,有25%~30%的心肌炎患者发展为扩张型心肌病,部分患者常伴有严重的室性心律失常,直接危及生命。基础研究发现心律失常与心肌细胞间电化学耦联密切相关,缝隙连接蛋白43(Connexin 43,Cx43)是存在于相邻细胞间传导通讯的特殊膜通道结构,对维持心脏细胞间的正常电化学信号耦联具有重要意义[1]。近年来发现抗心律失常肽(antiarrhythmic peptide 10,AAP10)可增加心肌细胞电耦联和代谢耦联[2],可能成为通过调控缝隙连接蛋白43来治疗病毒性心肌炎患者心律失常的新药。本文通过制作小鼠原代心肌细胞柯萨奇B3病毒(coxsackievirus B3,CVB3)感染性病毒心肌炎的体外模型,观察抗心律失常肽10对缝隙连接蛋白43的影响。
1 材料与方法
1.1 材料
实验时间:2012-10至2013-12。主要仪器:二氧化碳细胞培养箱(MODEL2300 SHELAB美国)、倒置显微镜(NikonT300,日本)、台式高速低温离心机(TGL-16C,上海安亭科学仪器厂)、酶联免疫检测仪(北京元业伯乐科技发展有限公司)、生物安全柜(Costar公司,美国)、电子天平(上海精密科学仪器公司天平仪器厂)、恒温磁力搅拌器(上海越众仪器设备有限公司)、Bio-Rad ChemiDocXRS化学发光成像系统(上海伯乐生命医学产品有限公司)等。主要药物与试剂:抗心律失常肽10(杭州中肽生化有限公司),胰蛋白酶(HyClone 公司,美国)、II型胶原酶(上海世泽生物科技有限公司),DMEM培养液(HyClone公司,美国)、胎牛血清(HyClone公司,美国),台盼蓝(Sigma公司,美国),磷酸盐缓冲溶液(PBS)(Sigma公司,美国),5-溴脱氧尿嘧啶核苷(5-Brdu)(Sigma公司,美国),D-Hank′s平衡液(HyClone公司,美国),小鼠抗总缝隙连接蛋白43单克隆抗体(百奇,货号AN1083), 羊抗兔IgG-HRP (博仕德,货号:BA1054),活细胞计数试剂盒(CCK8,东仁化学科技有限公司),心肌肌钙蛋白I、肌酸磷酸激酶以及乳酸脱氢酶酶联免疫吸附试剂盒(上海博蕴生物科技有限公司)。实验动物及细胞:出生第2天的巴比塞(BALB/C)小鼠,雌雄不拘(武汉大学动物中心)、人宫颈癌细胞(Hela细胞,CTCC)。实验病毒 :CVB3(武汉大学病毒研究所)。
1.2 方法
小鼠原代心肌细胞培养[3-5]:取出生第2天的BALB/C小鼠10只,无菌条件下开胸取心尖部,用预冷的D-Hank′s 平衡液洗涤3遍,将心脏剪成约1 mm × 1 mm × 1 mm大小;用0.125%的胰蛋白酶及0.1%的II型胶原酶,在37℃消化心肌组织消化7~8次,每次5~8 min不等,弃去第一次消化的上清液,收集第2次及以后的上清液,加10%胎牛血清终止消化,离心1 000 r/min,8 min,弃上清液,加入含10%胎牛血清pH调至7.3~7.4的DMEM培养液恒温磁力搅拌器中轻轻吹打,制成细胞悬液,再接种到培养瓶中,置5% CO237℃培养箱培养60 min后,采用差速贴壁分离技术,吸收培养瓶中的悬液,将细胞浓度调至为5.0×105细胞/ml,以单层细胞分别接种于48孔及96孔培养板中继续培养,前面两天加入0.1 mmol/L的5-溴脱氧尿嘧啶核苷,以后48 h换液一次。
原代心肌细胞CVB3病毒的扩增、组织细胞培养半数感染量(TCID50)的测定及心肌细胞的感染[6]:将DMEM培养液加入传代的Hela细胞中,置于5% CO237℃细胞培养箱中常规培养,待出现明显的细胞病变后于-80℃/37℃反复冻融3次,收集病毒液。将正常传代培养的Hela细胞经0.125%的胰蛋白酶消化后,加入含5%胎牛血清的DMEM培养液,将细胞吹散混匀,分别接种至96孔的聚苯乙烯培养板中(0.1 ml/孔),再将先前收获的CVB3病毒液用无血清DMEM培养液做10倍连续稀释后接种Hela细胞,测定TCID50,用Reed-Muench法计算数值。距离比例=(高于50%病变率的百分数-50%)/(高于50%病变率的百分数-低于50%病变率的百分数)。lg TCID50=距离比例×稀释度对数之间的差+高于50%病变率的稀释度的对数。感染CVB3后的心肌细胞病变以细胞受累程度为标准:心肌细胞病变表示法:(±)<25% ,( + ) 25%~50%,(++)51%~75%, (+++)>75%,(++++)近100%,正式实验选用100 TCID50作为接种浓度。
抗心律失常肽10对心肌细胞的毒性测定[7]:分析天平称量抗心律失常肽10质量,溶解于一定量培养液中,配成3~30 μg/ml 的浓度梯度,0.22 μm 滤膜过滤备用,在96孔板中每孔加入5×104的原代小鼠心肌细胞,培养24 h,细胞长成单层后,加入0.1 ml终浓度分别为0 μg/ml、5 μg/ml、8 μg/ml、10 μg/ml、15 μg/ml、20 μg/ml、25 μg/ml、30 μg/ml的抗
心律失常肽10培养液,每种浓度重复8孔,置5% CO237℃培养箱继续培养12 h、24 h、48 h、72 h,在倒置显微镜下观察细胞形态,生长状态,用活细胞计数试剂盒说明书方法测各孔在450 nm波长下的吸光度(A)值[8],计算心肌细胞活性,绘制细胞活性时间曲线图[9],取出现细胞活性达到最高时的药物浓度作为高剂量干预组的终浓度,终浓度的一半作为低剂量干预组终浓度。
抗心律失常肽10干预:将原代小鼠心肌细胞分为4组,每组8孔,分别为:细胞对照组、病毒对照组、低剂量干预组、高剂量干预组。48孔板中每孔加入1×105的原代小鼠心肌细胞,培养48 h。细胞长成单层后,除细胞对照组外,其余3组给予0.1 ml/孔的含100 TCID50的CVB3的维持液,低剂量干预组及高剂量干预组分别再给予0.1 ml/孔含规定终浓度抗心律失常肽10的维持液;置5% CO237℃培养箱继续培养24 h。
心肌细胞形态,搏动率及存活率的观察[2]:在40倍倒置显微镜下观察4组心肌细胞的生长状态、形态变化。取相同量的0.4%台盼蓝液与细胞悬液混匀后再取适量混合液滴于细胞计数板上,在20倍视野下计数4个大格中的细胞总数及未染成蓝色的杆状活细胞数,观察细胞搏动数,计数10次,取平均值计算细胞存活率及搏动率。细胞存活率(%)=活细胞数/细胞总数×100%;细胞搏动率(%)=搏动细胞数/细胞总数×100%。
缝隙连接蛋白43的蛋白免疫印迹法测定[10]:将培养瓶中的培养基弃去,加入3 ml预冷的磷酸盐缓冲溶液洗涤细胞,每瓶细胞加入1 ml裂解液,于冰上放置10 min裂解细胞,4℃,以12 000 r/min离心10 min,吸取上清液分装至0.2 ml PCR管,于-20℃保存待用。制作12%的分离胶及5%的积层胶,取20μl蛋白样品恒压电泳,十二烷基硫酸钠(SDS)聚丙烯酰胺电泳完毕后,去掉积层胶,硝酸纤维素膜转膜1 h,用蒸馏水漂洗,加丽春红染色液染色数分钟,观察转膜效果,再将硝酸纤维素膜转入封阻液(50 mM Tris·Cl,150 mM NaCl,pH 7.4,5%脱脂奶粉)中室温封阻1 h,加入抗总缝隙连接蛋白43一抗及IgG-HRP二抗 室温反应1 h,洗涤液洗涤5次,每次5 min,每张膜加入1 ml左右 SuperSignal West Pico 化学荧光底物反应5 min。使用Bio-Rad ChemiDocXRS化学发光成像系统观察膜上的化学信号,拍照。
心肌酶学测定[11]:待细胞培养24 h后,取各组细胞上清液用酶联免疫吸附法测定心肌肌钙蛋白I(cTnI)、肌酸激酶(CK)、乳酸脱氢酶(LDH)。
统计学处理:采用SPSS17.0统计软件分析,正态分布计量资料采用均数±标准差(x±s)表示,各组均数比较采用方差分析及两两比较,两组均数比较采用独立样本t检验,P<0.05为差异有统计学意义。
2 结果
2.1 抗心律失常肽10对心肌细胞的活性测定
显微镜镜下观测到各抗心律失常肽10浓度心肌细胞保持贴壁生长,细胞形态完整,其收缩力度随作用时间的增加略有增强,从药物时间曲线可以看出,20 μg/ml 抗心律失常肽10的心肌细胞活性持续高于其他浓度的抗心律失常肽10,随观察时间的延长(72 h),与30 μg /ml 抗心律失常肽10相比,其心肌细胞活性差异有统计学意义(P<0.01),见表1、图1。根据检测结果选择20 μg /ml作为高剂量药物干预组的终浓度,选择10 μg/ml作为低剂量干预组的终浓度(因20 μg/ml以下浓度的抗心律失常肽10对心肌细胞影响无显著性差异,本组采用10 μg/ ml作为低剂量干预组的终浓度)。
表1 抗心律失常肽10对心肌细胞的活性测定

表1 抗心律失常肽10对心肌细胞的活性测定
注:与30μ g/ml 抗心律失常肽10相比*P<0.01
?
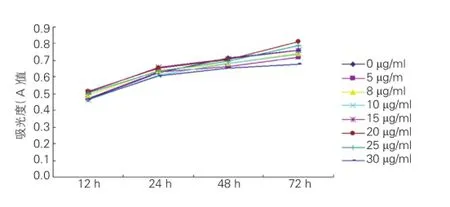
图1 抗心律失常肽10作用后心肌细胞活性时间变化曲线
2.2 抗心律失常肽10干预感染心肌细胞后心肌细胞存活率、心肌细胞搏动率及缝隙连接蛋白43表达水平的测定
各组孔内细胞培养24 h后显微镜镜下观测到细胞对照组心肌细胞形态完整、搏动正常,病毒对照组心肌细胞大部分圆缩、脱落,其中部分心肌细胞明显变形,搏动减弱甚至停止,悬浮在培养液中,高剂量干预组心肌细胞形态基本完整并贴壁生长,低剂量干预组心肌细胞少数发生变形,其坏死程度低于病毒对照组。图2

图2 各组心肌细胞在培养板孔内进行细胞培养24 h后的心肌细胞形态
低剂量干预组和高剂量干预组心肌细胞存活率及搏动率均明显高于病毒对照组(P<0.001),随着干预剂量增加,两个干预组的心肌细胞存活率及搏动率均进一步显著增加(P<0.001),差异均有统计学意义。表2
表2 各组心肌细胞总数、搏动细胞数、细胞搏动率、活细胞数以及细胞存活率的测定

表2 各组心肌细胞总数、搏动细胞数、细胞搏动率、活细胞数以及细胞存活率的测定
注:与病毒对照组相比*P<0.001;与低剂量干预组相对△P<0.001
?
低剂量干预组和高剂量干预组缝隙连接蛋白43相对表达水平明显高于病毒对照组(P<0.001),随着干预剂量增加,两个干预组缝隙连接蛋白43相对表达水平进一步显著增加(P<0.001),差异均有统计学意义。表3、图3
表3 各组心肌细胞缝隙连接蛋白43表达水平的测定

表3 各组心肌细胞缝隙连接蛋白43表达水平的测定
注:与病毒对照组相比*P<0.001;与低剂量干预组相比△P<0.001
?

图3 心肌细胞缝隙连接蛋白43表达量的蛋白免疫印迹法测定
2.3 心肌酶学测定
干预24 h后,高剂量干预组与低剂量干预组肌钙蛋白I、肌酸激酶、乳酸脱氢酶浓度均低于病毒对照组,高剂量干预组亦低于低剂量干预组,差异均有统计学意义(P <0.05~0.001)。表4
表4 各组心肌酶学测定

表4 各组心肌酶学测定
注:与病毒对照组相比*P<0.05**P<0.01***P<0.001;与低剂量干预组相比△P<0.05△△△P<0.001
?
3 讨论
抗心律失常肽10是人工合成的具有生物学活性的多肽,在正常人体中也存在天然的抗心律失常肽,主要分布在心房组织中,它作为一种激素在体内发挥效应,研究表明血液中抗心律失常肽的减少可促使心力衰竭的发生,诱发心律失常,而肺心病患者可能因为心肺功能下降,内环境缺氧而导致组织器官对抗心律失常肽的分泌减少,破坏增加,从而大大降低其在体内的含量[12]。实际上风湿性心脏病,冠心病患者也发现体内抗心律失常肽的水平有明显减少,这类有严重心脏疾病的患者均可因体内天然的抗心律失常肽浓度下降而出现更为严重的心律失常,甚至猝死的发生。因此,目前有相当一部分研究观察通过外源性人工合成抗心律失常肽10的补充,能否有效抵抗心律失常及猝死的发生。近几年,在动物水平的实验中,已经证实抗心律失常肽10能有效对抗急性缺血坏死、缺血再灌注以及陈旧性心肌梗死等相关的
器质性缺血性心脏病所引发的室性心律失常,而对于电解质紊乱所诱发的室性心律失常具有可逆转效应,对于心房颤动的控制具有比较肯定的治疗作用[13]。
缝隙连接蛋白是存在于心肌细胞间具有传导功能的膜通道蛋白质,参与心肌细胞离子流介导的动作电位,保持心脏兴奋冲动的快速传播,维持电活动与机械收缩,舒张功能的同步性,还可介导第二信使[14,15],影响心肌组织的分化、生长和凋亡,因此其结构和功能的改变均可影响心脏的电活动。研究发现缝隙连接蛋白分为缝隙连接蛋白40、缝隙连接蛋白45和缝隙连接蛋白43,心室肌的膜通道蛋白主要由缝隙连接蛋白43构成,在发生急性心肌缺血时,缺血局部心肌传导速度不均一,传导受阻部分的缝隙连接蛋白43有严重降解,而在瓣膜性心脏病或高血压心脏病引发的心力衰竭时,心脏能量供应障碍,心肌纤维化引发重构,早期缝隙连接蛋白43增加,晚期减少伴随分布异常,同样在心房颤动动物的实验中,心房肌中缝隙连接蛋白43表达明显增加,射频消融7天后缝隙连接蛋白43显著下降,而纤维化区域的缝隙链接蛋白43数量再次增多并伴有分布异常[16]。由于缝隙连接蛋白与抗心律失常肽10两者在体内的分布及功能都存在相似性,因此有人通过给予外源性抗心律失常肽10后观察心肌细胞的传导以及与缝隙连接蛋白43的关系来探讨彼此间的关联和作用机制。
国内的数项研究发现,在给合并有心律失常的陈旧性心肌梗死兔腹腔注射外源性的抗心律失常肽10后,心律失常的发生明显减少,同时检测到心肌组织中缝隙连接蛋白43表达增加,在合并使用了胺碘酮后作用增强[17]。同样在乳鼠进行原代心肌培养并急性缺氧诱导的实验中,划痕标记染料示踪技术发现给予了抗心律失常肽10培养基的心肌细胞传导范围有所增加,而缝隙连接蛋白43表达增多[10]。国外有研究也报道抗心律失常肽10可增加缝隙链接蛋白43的表达来调控心律失常的发生[18]。
本文通过建立小鼠原代心肌细胞病毒心肌炎的体外模型,观察到采用CVB3感染心肌细胞后,通过引起心肌细胞凋亡及细胞内钙调节失衡,导致细胞损伤坏死明显[19],而加入了抗心律失常肽10后其损伤程度减轻,其存活率、搏动率增高,肌钙蛋白I降低,同时测得缝隙连接蛋白43表达量增加,与病毒对照组比有明显差异,抗心律失常肽10本身对于正常心肌细胞无毒性作用,且有增加心肌细胞活性的功能,可能与促进缝隙连接蛋白43表达增加及代谢增强有关,而过量的抗心律失常肽10可能引起心肌细胞生长受限。抗心律失常肽10作为一种新的保护心肌及抗心律失常药物,能有效降低目前临床上其他抗心律失常药物的致心律失常副作用[20],同时为病毒性心肌炎临床治疗开拓新的思路。
[1] 黄强辉, 胡建新. 心肌缝隙链接蛋白43与心血管疾病的关系. 岭南心血管病杂志, 2012, 18: 81-84.
[2] 王凤梅, 王帆, 张烁. 缝隙链接蛋白重构与心律失常. 心血管康复医学杂志, 2013, 22: 626-629.
[3] 杜广胜, 文渊, 马业新. BALB/c小鼠乳鼠心肌细胞的原代培养.农垦医学, 2011, 33: 31-33.
[4] 马芳芳, 沈晓丽, 林立芳, 等. 新生大鼠心肌细胞的原代培养. 心血管康复医学杂志, 2009, 18: 125-128.
[5] 张晓京, 张建栋, 来丽娜, 等. SD乳鼠原代心肌细胞培养方法的改进. 长治医学院学报, 2012, 26: 171-173.
[6] 朱理安, 关瑞锦, 胡锡衷, 等. 病毒性心肌炎细胞感染模型的建立.福建医科大学学报, 2000, 34: 224-227.
[7] 张立博, 汪培华. 抗心律失常肽与心肌细胞间耦联. 中国心血管杂志, 2000, 5: 59-62.
[8] 张娴, 王兴冈, 解玉泉, 等. 髓系触发受体在柯萨奇病毒B3导致的炎症反应及心肌细胞损伤中作用的实验研究. 中华心血管病杂志, 2012, 40: 411-415.
[9] 石朔, 王利华, 锅睿, 等. 氧化钴诱导心肌细胞化学性缺氧HIF-12表达的研究. 诊断学理论与实践, 2013, 12: 532-536.
[10] 王荣, 张存泰, 刘念, 等. 抗心律失常肽对乳鼠心肌细胞急性缺氧时细胞间传导的影响. 华中科技大学学报(医学版), 2007, 36: 574-577.
[11] 樊理华, 韩星, 卢向红, 等. 阿霉素对大鼠原代心肌细胞凋亡的影响. 中华全科医学, 2013, 11: 1167-1168.
[12] Hagen A, Dietze A, Dhein S, et al. Human cardiac gap-junction coupling: effects of antiarrhythmic peptide AAP10. Cardiovasc Res, 2009, 83: 405-415.
[13] Jozwiak J, Dhein S. Local effects and mechanisms of antiarrhythmic peptide AAP10 in acute regional myocardial ischemia: electrophysiological and molecular findings. Naunyn Schmiedebergs Arch Pharmacol, 2008, 378: 459-470.
[14] Fong JT, Kells RM, Falk MM, et al. Two tyrosine-based sorting signals in the Cx43 C-terminus cooperate to mediate gap junction endocytosis. Mol Biol Cell, 2013, 24: 2834-2848.
[15] Waza AA, Andrabi K, Hussain MU. Protein kinase C (PKC) mediated interaction between conexin43 (Cx43) and K(+)(ATP) channel subunit(Kir6. 1) in cardiomyocyte mitochondria: Implications in cytoprotection against hypoxia induced cell apoptosis. Cell Signal, 2014, 26: 1909-1917.
[16] Wang N, De Vuyst E, Ponsaerts R, et al. Selective inhibition of Cx43 hemichannels by Gap19 and its impact on myocardial ischemia/ reperfusion injury. Basic Res Cardiol, 2013, 108: 309.
[17] 李连东, 张存泰, 阮磊, 等. 胺碘酮与抗心律失常肽合用对陈旧性心肌梗死兔心缝隙链接蛋白43和室性心律失常诱发率的影响. 中华心血管病杂志, 2010, 38: 1102-1105.
[18] Easton JA, Petersen JS, Martin PE, et al. The anti-arrhythmic peptide AAP10 remodels Cx43 and Cx40 expression and function. Naunyn Schmiedebergs Arch Pharmacol, 2009, 380: 11-24.
[19] 胡秀芬, 王宏伟, 鲁维伟, 等. 柯萨奇病毒B3引起心肌细胞钙超载及细胞凋亡的研究. 中国循环杂志, 2001, 16: 299-302.
[20] 张海澄. 心血管急症救治(10)抗心律失常药物的合理应用. 中国循环杂志, 2014, 29: 567-569.
Effect of Anti-arrhythmic Peptide 10 on Connexin Expression in Mice Primary Cardiac Myocyte Infected by Coxsackie Virus B3
WU Qiong, YANG Bo.
Department of Cardiology, The Fifth Hospital of Wuhan City, Mercy Hospital of Wuhan University, Wuhan (430000), Hubei, China
Objective: To observe the effect of anti-arrhythmic peptide 10 (AAP10) on connexin 43 (Cx43) expression in mice primary myocardial cell infected with coxsackie virus B3 (CVB3) by establishing mice viral myocarditis model.
Anti-arrhythmic peptide; Viral myocarditis; Connexin; Primary cardiac myocyte
2014-08-02)
(编辑:漆利萍)
武汉市汉阳区软科技计划项目
430000 湖北省,武汉市第五医院 武汉大学广慈医院 心血管内科(伍琼); 武汉大学第一临床学院 武汉大学人民医院(杨波)
伍琼 博士研究生 主要从事心电生理及心脏结构病学相关研究 Email:309325285@qq.com 通讯作者:杨波 Email:yybb1234@qq.com
R542.2
A
1000-3614(2015)04-0379-05
10.3969/j.issn.1000-3614.2015.04.019

