柔嫩艾美耳球虫乳酸脱氢酶单克隆抗体的制备及其在蛋白定位中的应用
李 莎,梁思婷,2,赵其平,韩红玉,朱顺海,翟 颀,杨斯涵,3,黄 兵,4,董 辉
(1.中国农业科学院上海兽医研究所 农业部动物寄生虫学重点开放实验室,上海200241;2.上海师范大学生命与环境科学学院,上海200234;3.云南农业大学动物科学技术学院,昆明 650201;4.江苏高校动物重要疫病与人兽共患病防控协同创新中心,扬州225009)
·研究论文·
柔嫩艾美耳球虫乳酸脱氢酶单克隆抗体的制备及其在蛋白定位中的应用
李 莎1,梁思婷1,2,赵其平1,韩红玉1,朱顺海1,翟 颀1,杨斯涵1,3,黄 兵1,4,董 辉1
(1.中国农业科学院上海兽医研究所 农业部动物寄生虫学重点开放实验室,上海200241;2.上海师范大学生命与环境科学学院,上海200234;3.云南农业大学动物科学技术学院,昆明 650201;4.江苏高校动物重要疫病与人兽共患病防控协同创新中心,扬州225009)
为了制备柔嫩艾美耳球虫乳酸脱氢酶(Eimeria tenella lactate dehydrogenase, EtLDH)单克隆抗体,用大肠杆菌表达的重组EtLDH可溶性蛋白免疫BALB/c小鼠,经5次免疫后取脾脏制备免疫脾细胞,与小鼠骨髓瘤细胞SP2/0融合,用间接ELISA法筛选阳性杂交瘤细胞,经3次亚克隆后获得2株能稳定分泌EtLDH单克隆抗体的杂交瘤细胞株2F7和2H4,抗体亚类鉴定均为IgG1,腹水效价分别为1:8000和1:64 000。Western blot结果显示2F7抗体能识别柔嫩艾美耳球虫第二代裂殖子中大小约为35 kDa的天然蛋白。利用该单抗对EtLDH在柔嫩艾美耳球虫第二代裂殖子中的分布进行了定位,结果显示该蛋白主要分布于裂殖子的细胞质,表明成功地制备了EtLDH 单克隆抗体,为深入研究EtLDH的功能和特性奠定了基础。
柔嫩艾美耳球虫;乳酸脱氢酶;单克隆抗体;免疫荧光定位
柔嫩艾美耳球虫(Eimeria tenella, Et)是隶属于顶复器门(Apicomplexa)艾美耳属的一种胞内寄生性原虫,虫体寄生在鸡盲肠内,可引起急性盲肠球虫病,主要临诊表现为精神萎顿,排血便,食欲下降,痉挛等症状,严重者可致死亡[1]。目前球虫病的控制主要依赖抗球虫药物预防,但球虫几乎对所有使用过的抗球虫药物都已产生耐药性[2],迫切需要寻求新的药物靶标来合成新型抗球虫药。通过寻找具有特异化学结构和理化性质并在球虫生活史中有重要作用的酶类[3, 4],应用其特异性设计特异的抑制剂作用于寄生虫蛋白,从而可达到控制鸡球虫病的目的[5]。乳酸脱氢酶(lactate dehydrogenase,LDH)是糖酵解途径的末端酶,能够催化丙酮酸与乳酸之间可逆的氧化还原反应,大多数体内寄生虫依靠此途径获取能量维持生存[6]。各种寄生虫LDH在理化性质和分子结构方面均有独特的特性,是良好的诊断分子和潜在的药物作用靶标。在顶复器门原虫中,LDH 研究主要集中在疟原虫[7-9]和弓形虫[10-12]中。本实验室在前期研究中对EtLDH基因特性进行了初步研究[13],本研究以原核表达的重组EtLDH (rEtLDH)蛋白免疫小鼠,制备了2株EtLDH的特异性McAb,并对EtLDH在虫体上的分布进行了初步研究。
1 材料与方法
1.1 虫株和菌株柔嫩艾美耳球虫上海株、含表达质粒pET28a(+)-EtLDH的大肠杆菌BL21均为本实验室保存。
1.2 实验动物与细胞系6周龄雌性BALB/c小鼠购自中国科学院上海实验动物中心;小鼠骨髓瘤细胞SP2/0为本实验室保存。
1.3 主要试剂及试剂盒胎牛血清、DMEM培养基购自Gibco公司;HRP-羊抗鼠IgG、Protein G Agarose购自碧云天公司;弗氏完全佐剂和弗氏不完全佐剂、HAT、HT、DMSO、PEG-2000、降植烷、Texas RedR-羊抗鼠IgG等购自Sigma公司;鼠源McAb亚类鉴定试剂盒购自洛阳赛尔维生物器材有限公司;Donkey-anti-Mouse IRDyeR660RD购自ODDYSSEY公司。
1.4 抗原制备与动物免疫将保存于-70℃的pET28a(+)-EtLDH重组质粒转化菌接种于LB培养基,37℃摇床培养至OD600值达0.6,加IPTG诱导表达6 h后,离心收集菌体沉淀,冰浴条件下超声破碎细胞,离心收集上清,经Ni-NTA纯化可溶性蛋白,用SDS-PAGE检测纯化效果后,剩余的蛋白用BCA法测定蛋白浓度[13]。
将rEtLDH与弗氏完全佐剂等体积混合,充分乳化后,按100 μg/只皮下多点注射免疫BALB/c小鼠。此后每隔2周将rEtLDH与弗氏不完全佐剂乳化,100 μg/只皮下多点注射以加强免疫,共免疫3次。融合前3 d用不加佐剂的rEtLDH(100 μg/只)腹腔注射1次进行冲击免疫。
1.5 细胞融合与筛选依据王建科[14]所述方法略作修改。无菌摘取免疫小鼠脾脏按5∶1比例与SP2/0骨髓瘤细胞进行融合,37℃、5%CO2浓度条件下培养,5 d后用HAT培养基半量换液,7~10 d后换HT培养基。同时,以rEtLDH(含His融合蛋白标签)、柔嫩艾美耳球虫第二代裂殖子蛋白和His蛋白分别包被96孔板。当杂交瘤细胞生长至1/3~1/2孔底面积时,取上清液用间接ELISA方法检测,并以免疫小鼠血清作为阳性对照,健康小鼠血清作为阴性对照。以能与rEtLDH和柔嫩艾美耳球虫第二代裂殖子蛋白反应(OD450>0.5)而不与His蛋白反应(OD450<0.1),且P/N>2.1(P为阳性对照OD值,N为阴性对照OD值)时的克隆判为阳性。对经2次检测均呈阳性的孔进行扩大培养并冻存,同时用有限稀释法亚克隆,直到阳性克隆率达100%时,方可确定建株。
1.6 腹水制备与McAb纯化取6周龄BALB/c小鼠,腹腔注射灭菌降植烷0.5 mL/只,7 d后每只腹腔注射DMEM培养基悬浮的杂交瘤细胞悬液0.5 mL(约含5×106个细胞),10 d后无菌采集腹水,10 800×g离心10 min,取上清,根据试剂盒说明书用Protein G免疫亲和层析柱进行纯化,SDS-PAGE检测纯化效果,过滤除菌后分装,置于-70℃冰箱保存。
1.7 单克隆抗体相关特性的测定
1.7.1 亚类鉴定 按照McAb亚类鉴定试剂盒说明书对得到的单克隆杂交瘤细胞上清进行亚类鉴定。
1.7.2 效价测定 参照张花景[15]的方法。将rEtLDH和McAb分别稀释成一系列的浓度梯度,同时设置阴性对照和空白对照,用方阵滴定法确立抗原抗体最佳工作浓度,从实验结果的对角线位置选取OD450值接近1.0左右的孔,其对应的rEtLDH包被浓度和McAb最大稀释度分别作为抗原最佳包被浓度和McAb效价。
1.7.3 Western blot鉴定 分别取柔嫩艾美耳球虫第二代裂殖子蛋白和His蛋白进行SDS-PAGE后转PVDF膜,用含5%脱脂奶粉的PBS悬液于4℃封闭过夜后,1∶1 000稀释的McAb作为一抗,37℃孵育2 h,PBS漂洗3次;Donkey anti-Mouse IRDyeR660RD作为二抗,以1∶10 000稀释,37℃避光孵育1 h,PBS漂洗5次,用双色红外荧光成像系统观察结果。
1.8 EtLDH在第二代裂殖子的分布
1.8.1 柔嫩艾美耳球虫第二代裂殖子的制备 参照刘立恒等[16]的方法。将柔嫩艾美耳球虫孢子化卵囊接种2周龄无球虫鸡,感染后120 h剖杀取盲肠,灭菌PBS清洗盲肠后剪碎,经酶消化液充分消化后过滤离心,用红细胞裂解液充分裂解,然后用Percoll密度梯度离心法纯化第二代裂殖子。
1.8.2 EtLDH的免疫荧光定位 将裂殖子悬液滴于盖玻片上,自然风干,加2%多聚甲醛室温固定15 min,PBS洗3次;加1% Triton-X-100室温放置15 min,PBS洗3次;用含2% BSA的PBS封闭20 min,PBS洗3次;加McAb(200倍稀释),37℃孵育l h,PBS洗3次,同时设置阴性鼠血清对照组;加TexasRRed-羊抗鼠IgG(1000倍稀释),37℃避光孵育l h,PBS洗5次,并在PBS中避光浸泡30 min;加DAPI室温放置30 min,PBS洗3次;加抗荧光淬灭剂,置荧光显微镜下观察并拍照。
2 结果
2.1 杂交瘤细胞株的建立融合后d7杂交克隆的融合率为90%,经2次ELISA筛选共得到18孔分泌抗体的阳性克隆,再通过3次亚克隆筛选出2株稳定分泌EtLDH McAb的强阳性杂交瘤细胞,分别命名为2F7 和2H4,经多次传代扩大培养后杂交瘤细胞分泌抗体仍然稳定,液氮冻存,经复苏后测定细胞仍保持分泌抗体的能力。
2.2 McAb亚类鉴定与效价测定McAb亚类鉴定结果显示,2株McAb均为IgG1。2F7和2H4分泌McAb的最佳抗原包被浓度分别为12 μg/mL与8 μg/mL,效价分别为1∶8000与1∶64 000。
2.3 McAb的SDS-PAGE分析和Western blot鉴定纯化后的2株McAb经SDS-PAGE均显示出大、小2条主带,分子量分别约为50 kDa(重链)和25 kDa(轻链)(图1)。Western blot结果显示,2F7能识别柔嫩艾美耳球虫第二代裂殖子约35 kDa大小的天然目的蛋白(图2),而2H4却不能识别虫体蛋白(图片略)。
2.4 EtLDH在第二代裂殖子中的定位间接荧光定位结果显示,2株McAb均能使裂殖子产生特异性荧光,荧光主要分布于细胞质中(图3)。
3 讨论
McAb是由单一克隆的杂交瘤细胞产生,相比多克隆抗体,McAb具有无限量生产、高度的特异性和均一性等优点。球虫McAb的研究始于20世纪末,至今已制备了抗球虫特异性阶段虫体单抗(如子孢子[17]、裂殖子[18])、细胞器单抗(如顶复合器[19]、折光体[20])、蛋白单抗(如天冬氨酰蛋白酶[21]、棒状体蛋白A08[22])。McAb技术已被广泛应用于球虫新基因和新抗原筛选、发育过程与致病机理探索、疾病诊断和预防治疗等方面的研究,是球虫研究领域一种十分重要的工具[23]。
制备McAb的关键是有足量纯净的抗原[23]。常用的免疫原是以大肠杆菌表达的重组蛋白,其优点是抗原的获得简单、方便,但在重组蛋白中含有标签序列,大的标签序列必须予以切割,否则可能会干扰目的杂交瘤细胞的筛选[24]。本研究首次利用重组表达的EtLDH蛋白免疫小鼠制备了单抗,所用的表达载体为pET28a(+),该质粒含有的His标签只有6个组氨酸大小,在pH8.0时不带电荷,分子量很小,几乎没有什么免疫原性,对蛋白的分泌、折叠、结构甚至功能几乎没影响,所以无需切除[24]。单抗的制备需要进行多层次的筛选,本研究中分别以虫体抗原、重组蛋白和His标签作为包被抗原进行检测,以减少假阳性、标签干扰等问题。
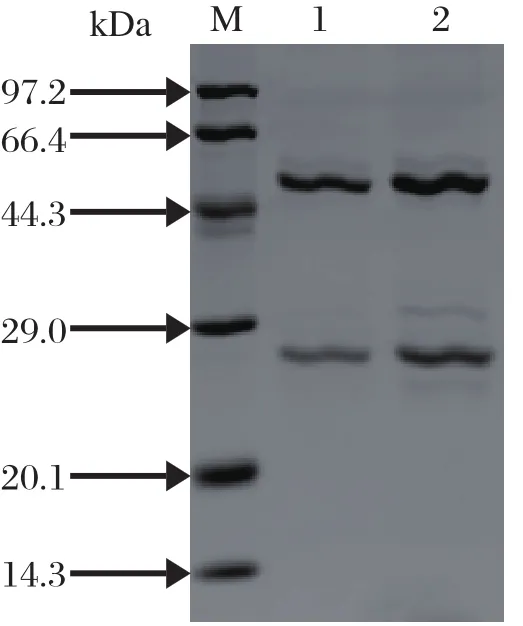
图l 纯化后单克隆抗体2F7和2H4的SDS-PAGE分析Fig.1 SDS-PAGE analysis of purifi ed McAb 2F7 and 2H4

图2 单克隆抗体2F7的Western blot鉴定Fig.2 Identifi cation of McAb 2F7 by Western blot

图3 间接免疫荧光法检测EtLDH在第二代裂殖子的分布Fig.3 The distribution of EtLDH in second-generation merozoites by IFA
本研究所获得的2F7和2H4,亚型均为IgG1,腹水效价分别为1∶8000和1∶64 000。而同为顶复器门的恶性疟原虫 LDH McAb腹水效价为1∶6400~1∶51 200,亚类为IgG1/IgG2[25, 26]。间日疟原虫LDH的McAb腹水效价为1∶12 800~1∶25 600,亚类为IgG1[27]。2F7能识别虫体的天然蛋白,而2H4不能,推测前者识别的是EtLDH的线性表位,而后者识别的是构象表位。在Western blot中,抗原因变性而构象表位遭到破坏,因此不适于检测识别构象表位的McAb。王建科[14]制备的8株水貂肠炎细小病毒的McAb均能用于间接免疫荧光检测,但仅有5株能用于Western blot检测。孙莉等[27]制备的5株间日疟原虫LDH的McAb均能识别重组蛋白,但只有2株能识别虫体天然蛋白。有关EtLDH McAb识别抗原表位的鉴定尚需进一步研究。
免疫荧光实验对抗体的纯度、抗原特异性和效价都有要求,纯度不高、特异性不好的抗体会产生非特异性荧光,效价低则成像不清晰[28]。Dong等[29]用EtLDH多抗作为一抗,荧光定位结果显示EtLDH分布于第二代裂殖子整个虫体的细胞质,且EtLDH蛋白表达水平在第二代裂殖子阶段最高。本研究用制备的2F7和2H4两株McAb对柔嫩艾美耳球虫第二代裂殖子进行免疫荧光分析,发现与前者相比,McAb的特异性和亲和性更好,无非特异性荧光,更适于EtLDH的定位和虫体检测。
本研究成功制备了EtLDH的McAb,为后续用免疫共沉淀技术筛选相互作用蛋白,以及从球虫cDNA文库或噬菌体展示文库中分离鉴定功能基因等奠定了基础。
[1] 索勋, 李国清.鸡球虫病学[M].北京∶ 中国农业大学出版社, 1998∶ 152.
[2] 张祝明, 曾明华.鸡球虫耐药性研究进展[J].中国兽医寄生虫病, 2005, 13(2)∶ 29-36.
[3] Vander J D, Hunsaker L A, Heidrich J E.Partial purification and characterization of lactate dehydrogenase from Plasmodium falciparum[J].Mol Biochem Parasitol, 1981, 4(5)∶ 255- 264.
[4] Royer R E, Deck L M, Campos N M, et al.Biologically active derivatives of gossypol∶ synthesis and antimalarial activities of peri-acylated gossylic nitriles[J].J Med Chem, 1986, 29(9)∶ 1799-1801.
[5] Sessions R B, Dewar V, Clarke A R, et al.A model of Plasmodium falciparum lactate dehydrogenase and its implications for the design of improved antimalarials and the enhanced detection of parasitaemia[J].Protein Eng, 1997, 10(4)∶ 301-306.
[6] Kavanagh K L, Elling R A, Wilson D K.Structure of Toxoplasma gondii LDH1∶ active-site differences from human lactate dehydrogenases and the structural basis for efficient APAD+use[J].Biochemistry, 2004, 43(4)∶ 879-889.
[7] Winter V J, Cameron A, Tranter R, et al.Crystal structure of Plasmodium berghei lactate dehydrogenase indicates the unique structural differences of these enzymes are shared across the Plasmodium genus[J].Mol Biochem Parasitol, 2003, 131(1)∶ 1-10.
[8] Brown W M, Yowell C A, Hoard A, et al.Comparative structural analysis and kinetic properties of lactate dehydrogenases from the four species of human malarial parasites[J].Biochemistry, 2004, 43(20)∶ 6219-6229.
[9] Chaikuad A, Fairweather V, Conners R, et al.Structure of lactate dehydrogenase from Plasmodium vivax∶ complexes with NADH and APADH[J].Biochemistry, 2005, 44(49)∶16221-16228.
[10] Dando C, Schroeder E R, Hunsaker L A, et al.The kinetic properties and sensitivities to inhibitors of lactate dehydrogenases(LDH1 and LDH2) from Toxoplasma gondii∶ comparisons with pLDH from Plasmodium falciparum[J].Mol Biochem Parasitol, 2001, 118(1)∶ 23-32.
[11] Yang S, Parmley S F.Toxoplasma gondii expresses two distinct lactate dehydrogenase homologous genes during its life cycle in intermediate hosts[J].Gene, 1997, 184(1)∶1-12.
[12] Al-Anouti F, Tomavo S, Parmley S, et al.The expression of lactate dehydrogenase is important for the cell cycle of Toxoplasma gondii[J].J Biol Chem, 2004, 279(50)∶52300- 52311.
[13] 王艳歌.柔嫩艾美耳球虫乳酸脱氢酶特性研究[D].北京∶中国农业科学院, 2014.
[14] 王建科.抗水貂肠炎细小病毒单克隆抗体的制备及双抗体夹心ELISA方法的建立[D].北京∶ 中国农业科学院, 2009.
[15] 张花景.弓形虫ENO2基因的克隆表达、单克隆抗体制备及功能分析[D].北京∶ 中国农业科学院, 2014.
[16] 刘立恒, 李俊, 徐立新, 等.柔嫩艾美耳球虫第二代裂殖子的分离纯化[J].畜牧与兽医, 2006, 38(12)∶ 38-40.
[17] Uchida T, Kikuchi K, Takano H, et al.Monoclonal antibodies inhibiting invasion of cultured cells by Eimeria tenella sporozoites[J].J Vet Med Sci, 1997, 59(8)∶ 721-723.
[18] Ko C, Smith C N, McDonell M.Identification and characterization of a target antigen of a monoclonalantibody directed against Eimeria tenella merozoites[J].Mol Biochem Parasitol, 1990, 41(1)∶ 53-63.
[19] Constantinoiu C C, Lillehoj H S, Matsubayashi M, et al.Analysis of cross-reactivity of five new chicken monoclonal antibodies which recognize the apical complex of Eimeria using confocal laser immunofluorescence assay[J].Vet Parasitol, 2003, 118(1)∶ 29-35.
[20] Augustine P C.Invasion of different cell types by sporozoites of Eimeria species and effects of monoclonal antibody 1209-C2 on invasion of cells by sporozoites of several apicomplexan parasites[J].J Eukaryot Microbiol, 2001, 48(2)∶ 177-181.
[21] Jean L, Grosclaude J, Labbé M, et al.Differential localisation of an Eimeria tenella aspartyl proteinase during the infection process[J].Int J Parasitol, 2000, 30(10)∶ 1099-1107.
[22] 平宪卿, 韩红玉, 姜连连, 等.一种柔嫩艾美耳球虫棒状体蛋白单抗的制备及初步应用[J].中国动物传染病学报, 2010, 18(2)∶ 47-51.
[23] 平宪卿, 姜连连, 黄兵, 等.单克隆抗体在球虫研究中的应用[J].中国动物传染病学报, 2009, 17(3)∶ 81-86.
[24] 侯巍.H-FABP表达、单克隆抗体制备、测定方法建立及临床应用研究[D].长春∶ 吉林大学, 2006.
[25] 吴英松, 董文其, 李明, 等.恶性疟原虫乳酸脱氢酶单克隆抗体的制备及其鉴定[J].中国寄生虫学与寄生虫病杂志, 2000, 18(6)∶ 15-17.
[26] 汪俊云, 包意芳, 杨玥涛, 等.恶性疟原虫乳酸脱氢酶特异性单克隆抗体的制备[J].中国寄生虫学与寄生虫病杂志, 2005, 23(4)∶ 213-216.
[27] 孙莉, 李明, 吴英松, 等.间日疟原虫乳酸脱氢酶单克隆抗体的制备及其鉴定[J].广东医学, 2010, 31(8)∶ 942-944.
[28] 刘钊, 禹海杰, 卓洵辉, 等.抗弓形虫MIC3单抗的制备及其在速殖子免疫荧光观察中的应用[J].中国兽医科学, 2011, 41(10)∶ 1030-1033.
[29] Dong H, Wang Y, Zhao Q, et al.Molecular cloning and characterization of lactate dehydrogenase gene from Eimeria tenella[J].Parasitol Res, 2014, 113(8)∶ 2915-2923.
GENERATION OF MONOCLONAL ANTIBODIES AGAINST LACTATE DEHYDROGENASE OF EIMERIA TENELLA AND ITS APPLICATION IN PROTEIN LOCALIZATION
LI Sha1, LIANG Si-ting1, 2, ZHAO Qi-ping1, HAN Hong-yu1, ZHU Shun-hai1, ZHAI Qi1, YANG Si-han1, 3, HUANG Bing1, 4, DONG Hui1
(1.Key Laboratory of Animal Parasitology, Ministry of Agriculture, Shanghai Veterinary Research Institute, CAAS, Shanghai 200241, China; 2.College of Life and Environment Sciences, Shanghai Normal University, Shanghai 200234, China; 3.College of Animal Science and Technology, Yunnan Agricultural University, Kunming 650201, China; 4.Jiangsu Co-innovation Center for Prevention and Control of Important Animal Infectious Diseases and Zoonoses, Yangzhou 225009, China)
Eimeria tenella; lactate dehydrogenase; monoclonal antibody; immunofl uorescent localization
: In order to prepare specifi c monoclonal antibodies (McAbs) against lactate dehydrogenase of Eimeria tenella (EtLDH), BALB/ c mice were immunized fi ve times with the recombinant fusion protein expressed in E.coli.Murine myeloma cells were fused with the splenocytes of the immunized mice.An indirect ELISA was used to screen antibody-producing hybridomas.After subcloned three times, two hybridoma clones 2F7 and 2H4 that secreted specifi c McAbs against EtLDH were obtained.Both belonged to IgG1 isotype.The ELISA titer of murine ascites from 2F7 and 2H4 was l:8000 and l:64 000, respectively.Western blot analysis indicated that a 35 kDanative protein of the second-generation merozoites of E.tenella was recognized by 2F7 McAb.The distribution of EtLDH in the secondgeneration merozoites of E.tenella was investigated through immunofl uorescent technique using both McAbs.The results indicated that LDH was distributed in the cytoplasm of the second-generation merozoites.The generation of these two McAbs will be useful to further study the function and characteristics of EtLDH.
2014-12-08
国家自然科学基金(31272557)
李莎,女,硕士研究生,预防兽医学专业
董辉,E-mail∶ donghui@shvri.ac.cn
S852.723
A
1674-6422(2015)02-0047-06

