环形泰勒虫表面抗原重组蛋白Tasp-Tams1-Spag1生物信息学分析与原核表达
任 方,易 忠,米晓云,魏 婕,马文戈,郭会玲,苗书魁,汪立群,王 延,薛 英,魏玉荣,黄 炯
(1.新疆农业大学动物医学学院,乌鲁木齐 830052;2.新疆维吾尔自治区畜牧科学院兽医研究所,乌鲁木齐830000;3.新疆维吾尔自治区动物卫生监督所,乌鲁木齐830063)
·研究论文·
环形泰勒虫表面抗原重组蛋白Tasp-Tams1-Spag1生物信息学分析与原核表达
任 方1,2,易 忠2,米晓云2,魏 婕2,马文戈2,郭会玲2,苗书魁2,汪立群3,王 延2,薛 英2,魏玉荣2,黄 炯1,2
(1.新疆农业大学动物医学学院,乌鲁木齐 830052;2.新疆维吾尔自治区畜牧科学院兽医研究所,乌鲁木齐830000;3.新疆维吾尔自治区动物卫生监督所,乌鲁木齐830063)
运用生物信息学软件对环形泰勒虫表面抗原串联基因Tasp-Tams1-Spag1进行分析,预测其编码蛋白的主要特性与抗原表位等,并对此串联基因进行克隆与原核表达。结果表明:串联重组蛋白Tasp-Tams1-Spag1属于不稳定非分泌型亲水性蛋白;编码346个氨基酸;有4个低复杂性的结构域,且含有Sorb与Btz、NL、NOT的同源区域;可能存在11个B细胞表位优势区段与17个T细胞表位优势区段,含有T、B细胞联合表位,表明Tasp-Tams1-Spag1重组蛋白可能具有良好的免疫原性。IPTG诱导重组蛋白原核表达,结果显示,该重组蛋白以包涵体形式存在;经Western blot检测,表明此串联蛋白反应原性良好,为后续深入研究免疫抗原奠定基础。
环形泰勒虫;重组蛋白;原核表达;生物信息学
环形泰勒虫病是由环形泰勒虫(Theileria annulata)寄生于动物红细胞、淋巴细胞及巨噬细胞内引发的一种蜱传急性、热性血液原虫病。此病呈地方流行性,表现为急性经过,不仅发病率与死亡率较高,当病畜耐过此病或治愈后,体内仍存在低水平的虫体,导致抵抗力下降,其他疾病爆发时可再次诱发此病[1,2]。环形泰勒虫病对畜牧业危害很大,OIE将其列为B类疾病,我国列为二类疫病[3]。
裂殖子表面抗原(the merozoite surface antigen,Tams1)、裂殖体表面抗原(Theileria annulata surface protein, Tasp)及子孢子表面抗原(the sporozoite antigen, SPAG1)已被确认具有较好的免疫原性,可作为诊断与预防环形泰勒虫病的理想候选疫苗[4]。但由于环形泰勒虫存在表面抗原多态性,使得单一的表面抗原不能完全免疫预防此病。
本研究应用生物信息学方法分析此串联表面蛋白的主要特性,推测其蛋白可能存在的抗原表位优势区段,发现Tasp-Tams1-Spag1重组蛋白具有良好的免疫原性。在此基础上构建含环形泰勒虫表面抗原串联基因Tasp-Tams1-Spag1的原核表达载体,进行串联蛋白的原核表达,为后续免疫抗原的研制奠定基础。
1.材料与方法
1.1 材料
1.1.1 菌株、质粒及细胞 质粒pMD-Tasp-Tams1-Spag1、pET-28a原核表达质粒与BL21(DE3)表达宿主菌由新疆维吾尔自治区畜牧科学院兽医研究所传染病研究室保存;pEASY-T1载体与Trans1-T1感受态细胞为北京全式金公司产品。
1.1.2 主要试剂 DNA聚合酶、2.5 mmol/L的dNTP mixture、10×Buffer(Mg2+plus)为大连TaKaRa产品;限制性内切酶BamH I和XhoI为Promega公司产品;T4 DNA连接酶为BioLabs公司产品;小量质粒提取试剂盒、琼脂糖凝胶回收试剂盒为Promega公司产品;4×SDS双色加样缓冲液为武汉博士德生物公司产品;牛环形泰勒虫阳性血清由新疆畜牧科学院兽医研究所提供;HRP标记的兔抗牛IgG为SIGMA公司产品。
1.2 方法
1.2.1 串联重组蛋白Tasp-Tams1-Spag1生物信息学分析 运用在线软件Expasy将核苷酸序列翻译成蛋白质序列后分析蛋白的分子质量、等电点、平均亲水系数等理化性质,并推测出蛋白的跨膜区、信号肽与蛋白的二级结构等;运用生物学软件DNAStar分析蛋白的柔韧性、表面可及性与亲水性;使用在线软件SMART分析蛋白的结构功能域;运用 COMPLUTENSE、ABCpred与DNAMAN、SYFPEITHI、NetMHC等软件综合分析预测蛋白潜在的B细胞表位与T细胞表位。
1.2.2 引物的设计与合成 根据质粒p M DTasp-Tams1-Spag1序列,Oligo 6软件设计引物,由上海生工生物工程有限公司合成。TSF:5'-AATGGATCCATGGAAGA TCAACAGCCTTTG-3';TSR:5'-AACCTCGAG TTAGAGTTTGTTTTTGATCTTTTG-3',其中下划线碱基为BamH I和Xho I酶切位点。
1.2.3 基因片段PCR扩增 以质粒pMD-Tasp-Tams1-Spag1为模板,扩增Tasp-Tams1-Spag1基因片段,PCR反应体系(25 μL):2.5 μL 10×Buffer(Mg2+plus)、4 μL 2.5 mmol/L dNTPs、20 μmol/mL上下游引物各1 μL、0.3 μL模板DNA、0.25 μL 5U/μL TaqHS,15.95 μL ddH2O。扩增反应程序:94 ℃ 预变性5 min;94 ℃变性 45 s,53.4 ℃ 退火30 s,72 ℃延伸1 min,30个循环;72 ℃延伸10 min;4 ℃终止反应。经1%琼脂糖凝胶电泳检测正确的目的条带,利用凝胶回收试剂盒回收纯化。
1.2.4 PEASY-T1-Tasp-Tams1-Spag1载体的构建回收纯化的PCR产物与PEASY-T1载体连接,按试剂盒说明操作后转化至Trans1-T1感受态细胞中。挑取阳性菌落质粒提取,命名为pEASY-T1-Tasp-Tams1-Spag1。
1.2.5 BL21(DE3)感受态细胞的制备 以CaCl2法制备 BL21(DE3)感受态细胞,-70℃保存备用。
1.2.6 重组表达载体的构建与鉴定 将pEASY-T1-Tasp-Tams1-Spag1重组质粒与原核表达载体pET-28a,同时用BamH I和Xho I进行双酶切,回收目的片段后在T4 DNA连接酶作用下连接,将连接产物转化至感受态细胞DH5α中。获得的重组质粒pET-28a-Tasp-Tams1-Spag1经双酶切后测序鉴定。
1.2.7 重组质粒的诱导表达 挑取鉴定正确的阳性转化菌落接种于3 mL LB液体培养基(kana+)中,37℃、220 r/min震荡培养过夜。次日以1∶100的体积比将菌液接种于LB液体培养基(kana+),37℃继续震荡培养至OD600为0.4~0.8时,加入IPTG至终浓度1 mmol/L,诱导表达4 h。2300×g离心5 min,收集菌体,加入灭菌PBS缓冲液(pH=7.4)充分悬浮,经处理后进行12% SDS-PAGE电泳检测分析,确认目的蛋白是否表达。
1.2.8 重组表达蛋白的可溶性检测 按常规方法在OD600为0.4~0.8时加入IPTG至终浓度为1 mmol/ L,室温条件下过夜诱导后,进行超声破碎,13 500×g 4 ℃离心15 min,分别收集上清液和沉淀,进行12% SDS-PAGE电泳检测分析。
1.2.9 重组表达蛋白Western blot的检测 将表达的蛋白转至NC膜后,用含5%脱脂牛奶的PBST于4℃封闭过夜,以牛环形泰勒虫阳性血清(1∶100)为一抗,孵育2 h,PBST缓冲液洗膜后,以HPR标记的兔抗牛IgG为二抗,孵育1h,用PBST缓冲液洗涤后进行DAB显色后拍照保存。
2 结果
2.1 重组蛋白Tasp-Tams1-Spag1的生物信息学分析结果
2.1.1 Tasp-Tams1-Spag1重组蛋白的基本特性Expasy分析得出Tasp-Tams1-Spag1重组蛋白基因编码氨基酸346 个,分子量37.36 kDa,等电点理论值为4.46,波长280 nm时的吸光度(A)值为0.494,半衰期为30 h,平均亲水系数为-0.862,不稳定系数为51.02,归类为亲水性不稳定蛋白。
DNAStar软件分析显示此重组蛋白骨架区含有较多的柔韧性区域,可以形成丰富的二级结构(图1),绝大部分区段位于蛋白质表面即蛋白亲水区域(图2),表明位于蛋白质表面的可及性区域都有作为 B 细胞表位优势区域的潜能。
Expasy预测出Tasp-Tams1-Spag1蛋白存在3个疏水区域,具体位置为aa150~160,aa217~248及aa277~284,从整体来看整个多肽链分值大部分都小于0,说明此蛋白属亲水性(图3)。

图1 重组蛋白Tasp-Tams1-Spag1柔韧性区域分析Fig.1 Analysis of the fl exible region of the recombinant protein Tasp-Tams1-Spag1
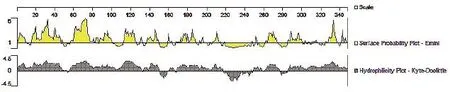
图2 重组蛋白Tasp-Tams1-Spag1表面可及性、亲水性分析Fig.2 Analysis of the surface accessibility and hydrophilicity of the recombinant protein Tasp-Tams1-Spag1

图3 重组蛋白Tasp-Tams1-Spag1疏水性分析Fig.3 Analysis of the hydrophobicity of the recombinant protein Tasp-Tams1-Spag1
TMPRED分析Tasp-Tams1-Spag1蛋白存在2个可能的跨膜区,一个跨膜螺旋从内部穿出细胞,长度从第 222个氨基酸至第 241 个氨基酸,一个跨膜螺旋从外部穿入内部,长度从第 220 个氨基酸至第 237 个氨基酸,但该段蛋白序列中并不存在信号肽,属于非分泌型蛋白。
2.1.2 Tasp-Tams1-Spag1重组蛋白二级结构的预测 DNAstar软件预测该重组蛋白的二级结构,并运用SOPMA在线软件做进一步分析,发现重组蛋白Tasp-Tams1-Spag1可能存在83个螺旋(总长的23.99%),228个无规则卷曲(占65.90%),35个延伸链(占10.12%)(图4)。
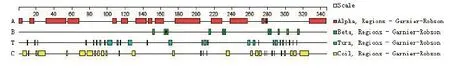
图4 重组蛋白Tasp-Tams1-Spag1二级结构预测Fig.4 Secondary structure prediction of the recombinant protein Tasp-Tams1-Spag1
2.1.3 Tasp-Tams1-Spag1重组蛋白结构功能域分析 SMART 分析重组蛋白结构功能域,得知Tasp-Tams1-Spag1蛋白的aa28~83、aa110~130、aa238~252位及aa305~338为低复杂性的结构域,且aa81~120之间含有Sorb同源区域,aa95~201之间含有Btz同源区域,aa96~121之间含有NL同源区域,aa134~245之间含有NOT的结构域。
2.1.4 Tasp-Tams1-Spag1重组蛋白抗原表位的预测抗原表位又称抗原决定簇(antigenic determinant,AD),其数目、性质与空间构型决定抗原的特异性。应用Jameson-Wolf抗原指数,综合蛋白二级结构、链柔韧性、疏水区域等预测B细胞表位,结合ABCpred、Bepipred及COMPLUTENSE等软件预测重组蛋白可能具有11个B细胞抗原表位优势区域(图5和表1)。
SYFPEITHI预测重组蛋白的T细胞表位,预测分值大于16的肽段被认为能与MHC I类分子结合。综合软件NetMHC预测的共同区域,推测出此重组蛋白可能存在17个T细胞表位优势区域(表2)。
综合重组蛋白Tasp-Tams1-Spag1的T、B细胞表位优势区域,预测T、B细胞联合表位可能的区域为aa211~220(KPVVDKFSPL)、aa291~300(VTPTQPSNLP)。

图5 重组蛋白Tasp-Tams1-Spag1抗原表位分析Fig.5 Analysis of the antigenic epitopes of the recombinant protein Tasp-Tams1-Spag1
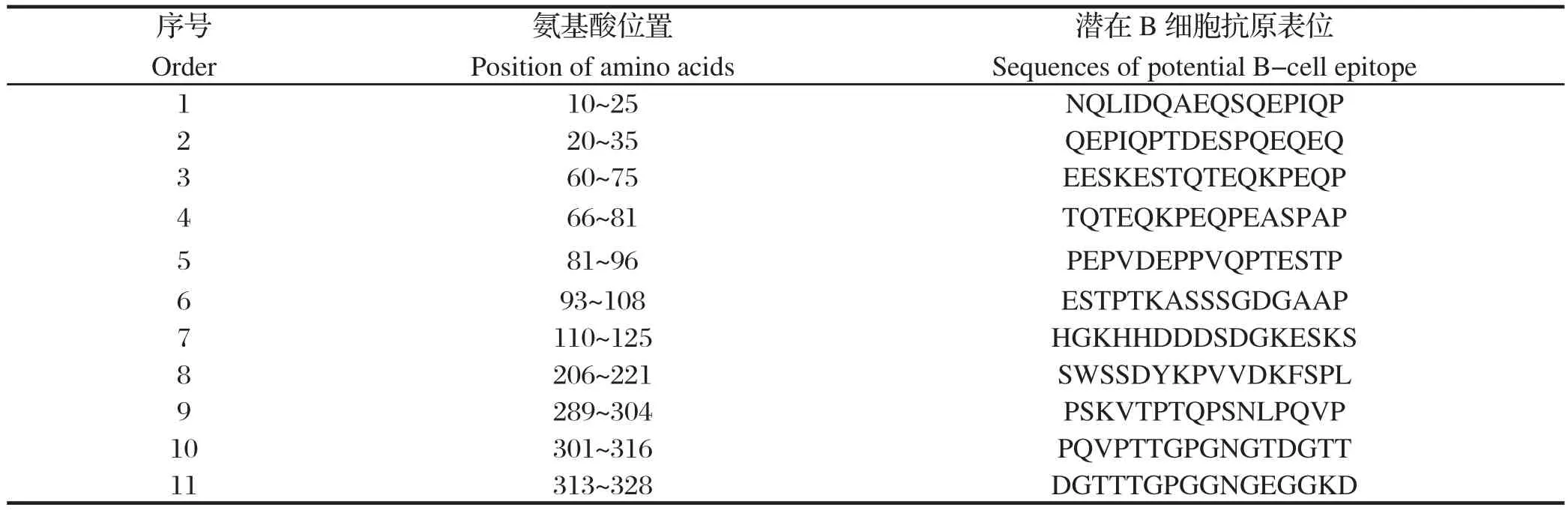
表1 重组蛋白Tasp-Tams1-Spag1的B细胞抗原表位Table1 The B-cell epitopes of the recombinant protein Tasp-Tams1-Spag1
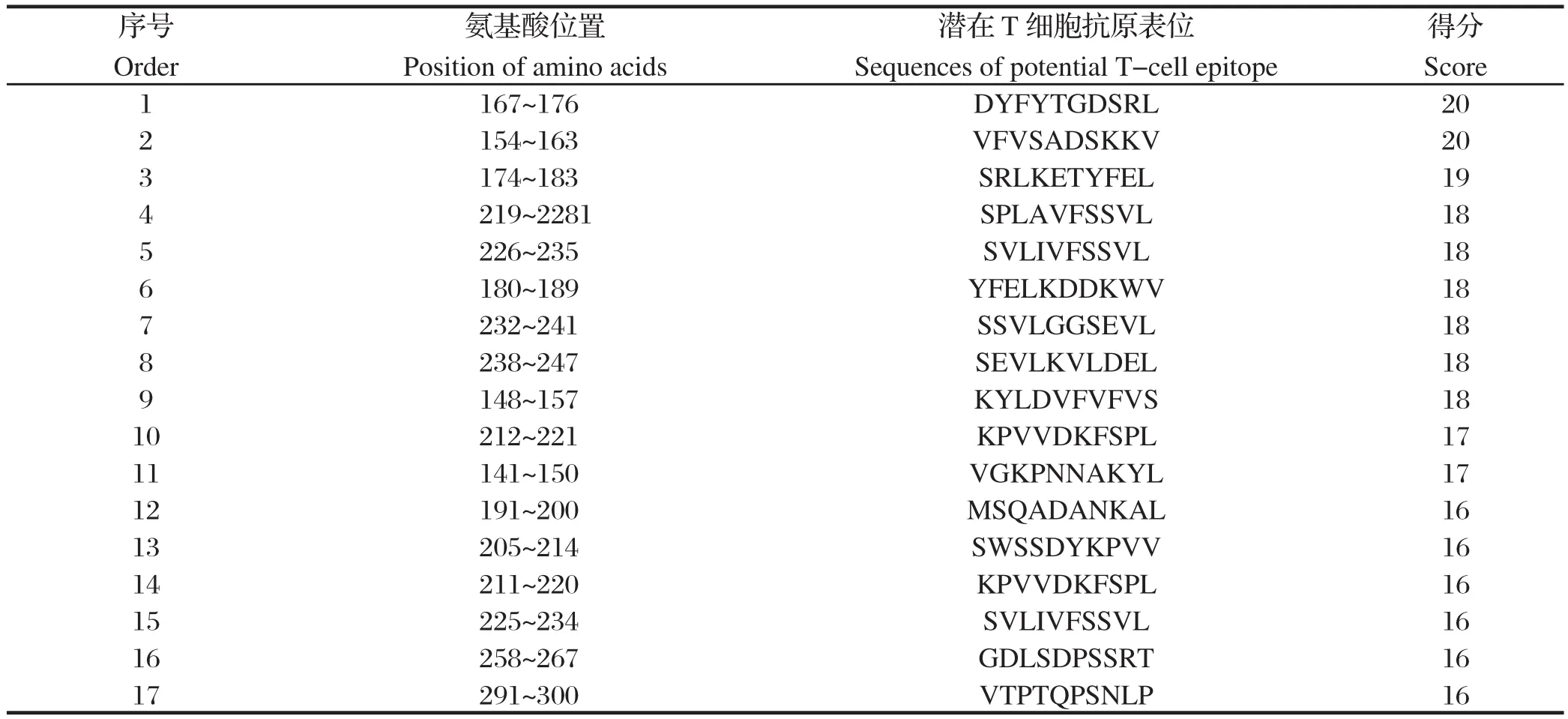
表2 重组蛋白Tasp-Tams1-Spag1的T细胞抗原表位Table2 The T-cell epitopes of the recombinant protein Tasp-Tams1-Spag1
2.2 Tasp-Tams1-Spag1基因的PCR扩增及其原核表达质粒的构建与鉴定以质粒pMD-Tasp-Tams1-Spag1为模板进行PCR扩增,获得与预期相符的长约1041 bp的目的条带(图6A)。将构建好的重组质粒pET-28a-Tasp-Tams1-Spag1经BamH I和Xho I双酶切,得到长约1041 bp的基因片段与5369 bp的pET-28a载体片段(图6B),大小与理论值相符。

图6 Tasp-Tams1-Spag1基因的PCR扩增结果(A)及原核表达质粒的酶切鉴定(B)Fig.6 PCR results of Tasp-Tams1-Spag1 gene(A) and identifi cation of recombinant plasmid by enzyme digestion(B)
2.3 原核重组质粒的诱导表达对重组质粒诱导表达进行SDS-PAGE电泳检测分析,与对照组相比,在35~40 kDa处存在一条特异性的蛋白条带,与预期大小一致,而对照组未出现此表达条带(图7)。

图7 重组质粒的诱导表达Fig.7 IPTG-induced expression of the recombinant plasmid
2.4 重组表达蛋白的可溶性检测对样品进行SDSPAGE电泳检测分析,结果显示,重组表达蛋白主要以包涵体形存在(图8)。

图8 重组蛋白的可溶性检测Fig.8 Solubility test of the recombinant protein
2.5 重组表达蛋白Western blot的检测用牛环形泰勒虫阳性血清抗体进行Western blot,在35~40 kDa处出现特异性杂交条带,而对照的表达产物则无此条带(图9),可以初步确定重组蛋白大量表达且反应原性良好。

图9 重组蛋白的Western blot检测Fig.9 Western blot analysis of the recombinant protein
3 讨论
在动物体的免疫应答中,抗原表位被相应的特异性抗原受体识别,从而激发机体特异性免疫。特异性免疫包括由B细胞介导的体液免疫和由T细胞介导的细胞免疫[5]。根据其T细胞与B细胞抗原表位,研究表位疫苗与高效的诊断试剂是当前的热点。运用生物信息学方法预测抗原表位,并通过对这些抗原表位进行分析,推测抗原表位肽段的免疫原性从而有效的指导实验的进行,是目前研究诊断试剂与表位疫苗的有效方法。
裂殖子表面抗原(Tams1)是环形泰勒虫感染红细胞时表面分泌的一种膜内蛋白,免疫原性很好。2008年,黄家雨等[6]以新疆牛环形泰勒虫Tams1基因为基础成功建立了巢式PCR诊断方法。近年来在国外,以Tam1基因为引物建立的PCR技术已运用于环形泰勒虫病的诊断中[7]。子孢子表面抗原(SPAG1)是虫体发育至子孢子阶段时分泌的一种膜内蛋白,具有较好的免疫原性。在国外,学者们已经陆续以 SPAG1 重组抗原建立了环形泰勒虫的ELISA 的检测方法。当虫体感染宿主时,产生的抗裂殖体表面抗原(TaSP)的抗体同样具有良好的免疫原性,可以作为诊断环形泰勒虫病的理想抗原[8-10]。Mohamed等[11]对Tasp作为ELISA抗原检测环形泰勒虫病进行了评估,证实了此方法的可靠性。虽然上述三种表面抗原的免疫原性均已被验证并在实际诊断中应用,但以单一抗原为基础的诊断方法还存在着一些问题,例如抗原多态性的存在,各分离株间变异性的出现,不完全保护的产生等[12]。而对环形泰勒焦虫不同发育阶段的串联表面优势抗原蛋白的研究则解决了这些问题,为筛选理想的候选抗原提供了一条新的思路。
本研究对串联重组蛋白Tasp-Tams1-Spag1的基本特性、二级结构、亲水性、表面可及性、柔韧性等参数进行预测,同时综合推测其B细胞可能存在的表位。串联重组蛋白Tasp拥有346个氨基酸,属于不稳定非分泌型亲水性蛋白。在蛋白的aa28~83、aa110-130、aa238-252、aa305-338为低复杂性的结构域,且蛋白在aa81~120含有Sorb同源区域,在aa95~201含有Btz同源区域,在aa96~121含有NL同源区域,在aa134~245含有NOT的结构域。串联重组蛋白Tasp可能含有11个B细胞表位优势区段与17个T细胞表位优势区段,推测含有两段交叉反应性表位肽,分别可能存在的区域为aa211~220(KPVVDKFSPL)、aa291~300(VTPTQPSNLP)。在理论方面证实Tasp-Tams1-Spag1串联重组蛋白具有很好的免疫原性,适合作为理想的诊断试剂与表位疫苗。本研究依此为基础克隆了Tasp-Tams1-Spag1串联基因,并成功表达出串联重组蛋白,经Western blot的检测表明其可被环形泰勒虫阳性血清识别。在理论与实践方面均表明该串联重组蛋白具有很好的反应原性,为后续免疫抗原的研制提供了基础,并为进一步研究环形泰勒虫抗原串联蛋白提供借鉴。
[1] 蒋金书.动物原虫病[M].北京∶ 中国农业大学出版社, 2000∶ 120-125.
[2] 汪明.兽医寄生虫学[M].3版.北京∶ 中国农业大学出版社, 2008∶ 332.
[3] 农业部畜牧兽医局.一、二、三类动物疫病释义[M].北京∶ 中国农业出版社, 2004∶ 97-101.
[4] 蔺红玲, 张继瑜, 魏小娟, 等.环形泰勒虫主要膜蛋白的研究进展[J].黑龙江畜牧兽医, 2011, (5)∶ 22-24.
[5] 张艳贞, 宣劲松.蛋白质科学-理论、技术与应用[M].北京∶ 北京大学出版社, 2012, 11-152.
[6] 黄家雨.新疆牛环形泰勒虫Tams1基因的克隆、表达与巢式PCR诊断方法的建立[D].新疆∶ 新疆农业大学, 2008.
[7] Ghoneim A M, EI-Fayomy A O.Targeting tams-1 gene results in underestimation of Theileria annulata infection in diseased cattle in Egypt[J].Acta Parasitol, 2014, 59(1)∶85-90.
[8] Darghouth M A, Boulter N R, Gharbi M, et al.Vaccination of calves with an attenuated cell line of Theileria annulata and the sporozoite antigen SPAG-1 produces a synergistic effect[J].Vet Parasitol, 2006, 142(1-2)∶ 54-62.
[9] Salih D E A, Ahmed J S, Bakheit M A, et al.Validation of the indirect TaSP enzyme-linked immunosorbent assay for diagnosis of Theileria annulata infection in cattle [J].Parasitol Res, 2005, 97(4)∶ 302-308.
[10] Bakheit M A, Schnittger L, Salih D A, et al.Application of the recombinant Theileria annulata surface protein in an indirect ELISA for the diagnosis of tropical theileriosis [J].Parasitol Res, 2004, 92(4)∶ 299-302.
[11] Mohamed A M, Abdel-Rady A, Ahmed L S, et al.Evaluation of indirect TaSP enzyme-linked immunosorbent assay for diagnosis of tropical theileriosis in cattle (Bos indicus) and water buffaloes (Bubalus bubalis) in Egypt[J].Vet Parasitol, 2012, 186(3-4)∶ 486-489.
[12] 曹雯丽, 陈亮, 刘启生, 等.新疆牛环形泰勒虫病的流行现状和防治[J].草食家畜, 2011, (3)∶ 76-78.
BIOINFORMATICS ANALYSIS PROKARYOTIC EXPRESSION OF RECOMBINANT SURFACE ANTIGEN TASP-TAMS1-SPAG1 OF THEILERIA ANNULATA
REN Fang1,2, YI Zhong2, MI Xiao-yun2, WEI Jie2, MA Wen-ge2, GUO Hui-ling2, MIAO Shu-kui2, WANG Li-qun3, WANG Yan2, XUE Ying2, WEI Yu-rong2, HUANG Jiong2
(1.College of Veterinary Medicine, Xinjiang Agricultural University, Urumqi 830052, China; 2.Institute of Veterinary Medicine, Animal Science Academy of Xinjiang Uygur Autonomous Region, Urumqi 830000, China; 3.Institute of Animal Health Inspection of Xinjiang Uygur Autonomous Region, Urumqi 830063, China;)
Theileria annulata; recombinant protein; prokaryotic expression; bioinformatics
: The main characters and antigenic epitopes of the recombinant protein Tasp-tams1-spag of Theileria annulata were analyzed and predicted in the present study by using the biological software and online software in order to clone the surface antigen Tasp-tams1-spag gene and to construct prokaryotic expression vectors.The recombinant Tasp-tams1-spag contained 346 amino acids and belonged to unstable hydrophilic non-secreted protein.It contained 4 low complexity domains as well as Sorb, Btz, NL and NOT homologous regions.There might be 11 B-cell major epitope domains, 17 T-cell major epitope domains and two cross-reactive epitopes.The recombinant protein was predicted to have good immunogenicity in theory.Subsequently, the recombinant Tasp-tams1-spag was expressed byinduction with IPTG and expression condition was optimized.The expressed protein was mainly obtained in the form of inclusion bodies.Western blot assay also revealed that the recombinant protein had good antigenicity.
2014-12-02
国家自然科学基金项目(31160505);公益性行业(农业)科研专项(201103008)
任方,女,硕士研究生,预防兽医学专业
魏玉荣,E-mail:jh124@163.com;黄炯,E-mail:weiyu1113@sina.com
S852.723
A
1674-6422(2015)02-0060-08

