系统性红斑狼疮患者树突状细胞CD200R下调之意义
陈 洋,李 扬,张 烜
(中国医学科学院 北京协和医学院 北京协和医院风湿免疫科 风湿免疫疾病教育部重点实验室,北京 100730)
系统性红斑狼疮(systemic lupus erythematosus,SLE)是一种多系统受累的自身免疫性疾病,发病机制涉及遗传和环境等多方面因素。树突状细胞(dendritic cell,DC)包括髓样树突状细胞(myeloid dendritic cell,mDC)和浆样树突状细胞(plasmacytoid dendritic cell,pDC),在外周血单个核细胞(peripheral blood mononuclear cells,PBMC)中数量较少,但作为主要的抗原提呈细胞在SLE免疫耐受失衡中起到重要的作用[1-2]。CD200/CD200R是重要的免疫调节通路,受体相对局限分布于髓系来源的细胞如DC,其中最主要的是CD200R1,发挥着免疫负调节作用;但其在人类DC的功能调节及SLE发病机制中的作用尚不清楚。本研究着眼于CD200R分布的主要细胞群,选择在免疫启动和调节方面具有重要作用的DC为研究对象,分析SLE患者DC表面CD200R表达,并通过建立体外PBMC来源树突状细胞(monocytes derived dendritic cells,MoDC)培养模型,研究脂多糖(lipopolysaceharide,LPS)对SLE患者MoDC活化及CD200R表达的影响,初步探讨该通路在疾病发生发展中的意义。
资料与方法
研究对象
收集北京协和医院确诊的SLE患者共22例,平均年龄(26.0±8.5)岁;健康对照(healthy control,HC)共22例,平均年龄(28.2±4.9)岁。所有患者均符合1997年美国风湿病学会SLE诊断标准,研究开始前均获得知情同意。
主要材料
流式荧光抗体CD11c-FITC、CD123-PE-Cy7、CD200R-PE、HLA-DR-PE、CD83-PerCP/CY5.5、CD86-APC购自eBioscience和Biolegend公司,IL- 6及IL-10 酶联免疫吸附法(ELISA)试剂盒均购自eBioscience公司,CD14 Micro Beads购自德国Miltenyi Biotec公司,重组人IL- 4及GM-CSF购自美国PeproTech公司,LPS购自美国Sigma公司,Cell TraceTMCFSE cell proliferation kit购自美国Invitrogen公司。
方法
清晨空腹采集静脉血20 ml,按照Ficoll密度梯度离心法分离PBMC并计数。第一部分:PBMC中加入荧光标记抗体CD11c-FITC、CD123-PE-Cy7、CD200R-PE,并设同型对照,圈出非淋巴细胞门,以CD11c+CD123dim代表mDC,CD11c-CD123bright代表pDC。Accuri C6流式细胞仪检测。第二部分:免疫磁珠分选CD14+单核细胞,于RPMI-1640完全培养基中培养,给予GM-CSF(100 ng/ml)和IL- 4(100 ng/ml)诱导。分为培养基组(M)、LPS(1 μg/ml)组,培养7 d后收获各组MoDC及培养上清液。
各组MoDC中分别标记CD11c-FITC、CD200R-PE、HLA-DR-PE、CD83-PerCP/CY5.5、CD86-APC,进行BD FACS AriaⅡTM流式细胞仪检测;ELISA法检测各组MoDC培养上清中白细胞介素- 6(interleukin- 6,IL- 6)和IL-10的浓度;MoDC与异体健康对照混合淋巴细胞反应(mixed lymphocytes reaction,MLR),通过染色CFSE检测CD4+淋巴细胞增殖情况。
统计学处理
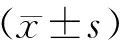
结 果
SLE患者外周血DC表面CD200R的表达
SLE患者mDC及pDC表面CD200R表达均较健康对照显著降低[mDC:(20.51±2.87)%vs.(27.95±2.00)%,P=0.046;pDC:(47.97±5.50)%vs.(65.14±4.72)%,P=0.027]。SLE患者mDC表面CD200R的表达与红细胞沉降率呈负相关(r=-0.552,P=0.041),但与C3、C4、抗dsDNA抗体滴度及SLEDAI评分无相关性(图1、2)。
SLE患者与健康对照组LPS诱导MoDC活化情况比较
流式细胞术分析MoDC表面活化标志HLA-DR、CD83、CD86的改变:经LPS活化后SLE(n=8)及健康对照组(n=6)MoDC表面标志表达均显著上调。SLE与健康对照组间比较差异无显著性意义(图3、4)。
ELISA检测各组MoDC培养上清中IL- 6和IL-10的浓度变化:LPS刺激活化后健康对照(n=7)及SLE(n=7)组IL- 6、IL-10水平均显著升高,两者比较差异无显著意义(图5、6)。
单向MLR检测各组MoDC刺激CD4+淋巴细胞增殖的能力:健康对照组和SLE组LPS活化的MoDC使CD4+淋巴细胞增殖比例显著增加(表1)。
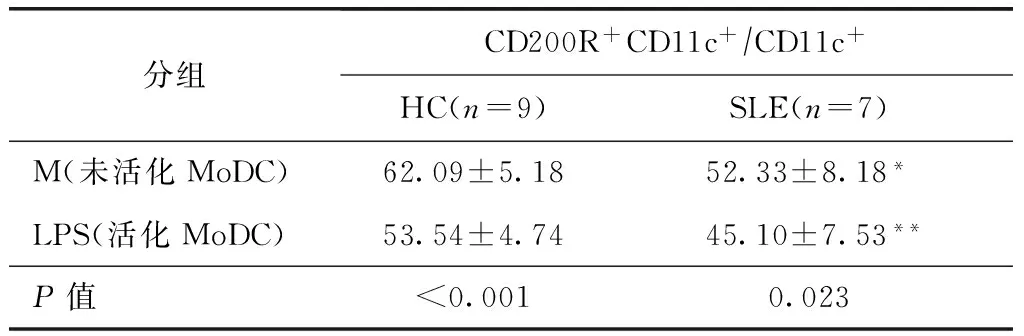
LPS诱导MoDC活化成熟后其表面CD200R表达
SLE及健康对照组,经LPS活化后MoDC表面CD200R均显著下调(HC:P<0.001;SLE:P=0.023)。无论是否经LPS活化SLE组MoDC表面CD200R表达均较对照组下降,但差异无显著意义(表2,图3,4)。
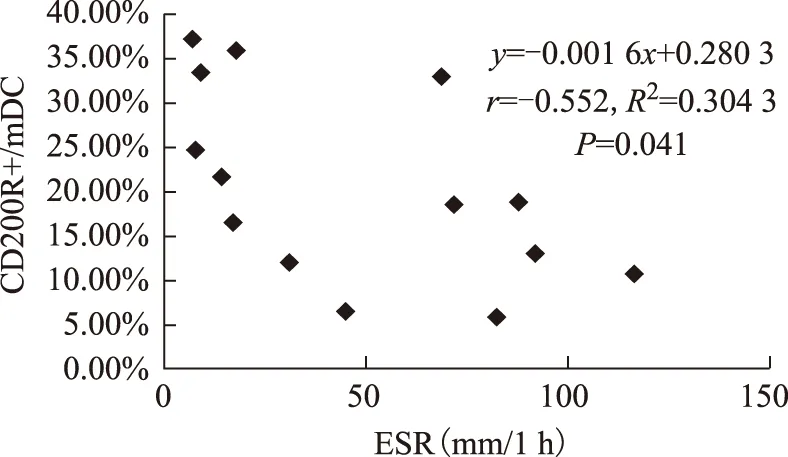
图2SLE患者mDC表面CD200R表达与红细胞沉降率的相关性
Fig2Correlation between CD200R expression on mDC of SLE and ESR
SLE:系统性红斑狼疮;mCD:髓样树突状细胞;ESR:红细胞沉降率
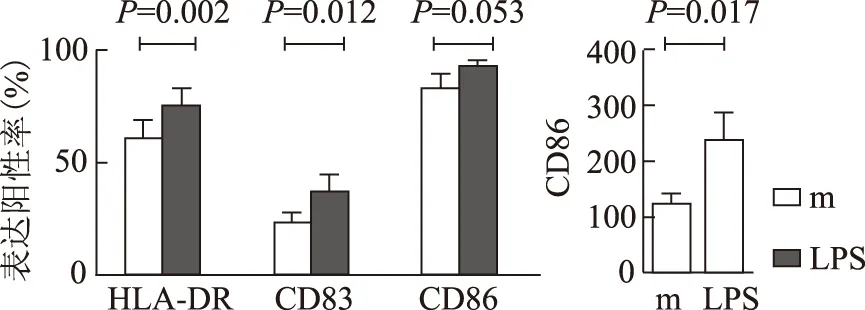
图3健康对照M组、LPS组 MoDC表面活化标志表达
Fig3HLA-DR,CD83 and CD86 expression change on MoDC after LPS activation in healthy control
LPS:脂多糖;MoDCl:单个核细胞来源树突状细胞
图4SLE患者M组、LPS组 MoDC表面活化标志表达的变化
Fig4HLA-DR,CD83 and CD86 expression change on MoDC after LPS activation in SLE
LPS:脂多糖;MoDCl:单个核细胞来源树突状细胞;SLE:系统性红斑狼疮
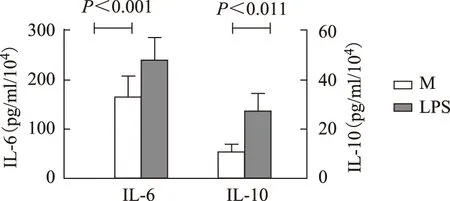
图5健康对照MoDC培养上清中各组IL- 6及IL-10分泌情况
Fig5Secretion of IL- 6 and IL-10 in culture supernatant MoDC of different groups in healthy control
MoDCl:单个核细胞来源树突状细胞;IL-6:白细胞介素6;IL-10:白细胞介素10
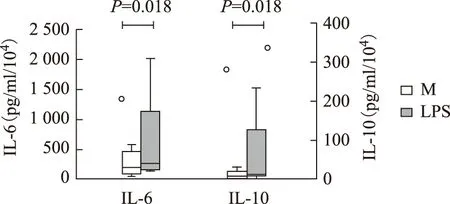
图6SLE患者MoDC培养上清中各组IL- 6及IL-10分泌情况
Fig6Secretion of IL- 6 and IL-10 in culture supernatant MoDC of different groups in SLE
MoDCl:单个核细胞来源树突状细胞;IL-6:白细胞介素6;IL-10:白细胞介素10;SLE:系统性红斑狼疮
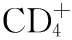

分组HC(n=5)SLE(n=6)M(未活化MoDC)9.7±1.78.4±2.1*LPS(活化MoDC)14.4±2.310.7±1.9**P值0.0110.031
HC:健康对照;SLE:系统性红斑狼疮;LPS:脂多糖;MoDC:单个核细胞来源树突状细胞;*HC与SLE相比,M组MoDC使CD4+细胞增殖比例无显著性差异(P=0.638);**HC与SLE相比,LPS组MoDC使CD4+细胞增殖比例无显著性差异(P=0.239)
分组CD200R+CD11c+∕CD11c+HC(n=9)SLE(n=7)M(未活化MoDC)62.09±5.1852.33±8.18*LPS(活化MoDC)53.54±4.7445.10±7.53**P值<0.0010.023
HC:健康对照;SLE:系统性红斑狼疮;LPS:脂多糖;MoDC:单个核细胞来源树突状细胞;*SLE与HC相比,M组MoDC表面CD200R表达阳性率差异无显著意义(P=0.311);**SLE与HC相比,LPS组MoDC表面CD200R表达阳性率差异无显著意义(P=0.339)
讨 论
CD200是Ⅰ型跨膜糖蛋白,属于免疫球蛋白超家族成员,表达于多种细胞包括B淋巴细胞、T淋巴细胞、DC、神经元及内皮细胞等[3-5],其胞内段短,缺乏信号序列,需要通过受体发挥作用。目前发现的CD200的受体包括CD200R1~5[6-7],其中最主要的是CD200R1,亲和力最高,表达相对局限于髓系来源的细胞,如DC、巨噬细胞、中性粒细胞、肥大细胞等,胞内带有酪氨酸残基被磷酸化后向下游传导负向免疫调节信号[8-10]。SLE患者该通路存在异常[11],本研究分析SLE患者PBMC中DC表面CD200R表达及LPS刺激MoDC活化后其表面CD200R改变。
结果显示,SLE患者mDC及pDC表面CD200R表达均显著低于健康对照。CD200/CD200R调节免疫应答,在过敏、自身免疫性疾病、移植排斥等免疫相关疾病中发挥重要作用。关于小鼠肥大细胞的研究显示,CD200R被募集交联后其胞内的NPXY基序介导迅速发生酪氨酸磷酸化,募集Dok1和Dok2蛋白结合于RasGAP和SHIP,进而抑制下游ERK、JNK和p38MAPK的活化,传导免疫调节信号[12-13],这一通路已知的功能包括抑制肥大细胞和嗜碱细胞脱颗粒[14]、负向调节巨噬细胞功能[9]、诱导T细胞向调节性T细胞转化,并促进抗炎介质IL-10和TGF-β的产生[5]。敲除CD200的小鼠对实验性自身反应性脑脊髓炎和胶原诱导性关节炎易感性增强[9,15],阻断CD200可使小鼠出现早发实验性自身免疫性葡萄膜视网膜炎[16]。该通路还可影响细胞因子平衡,减少Ⅰ型细胞因子而促进Ⅱ型细胞因子合成,参与移植耐受机制[17]。故SLE患者外周血DC表面CD200R表达下降可能导致自身免疫耐受降低,在其致病机制中具有一定的意义。且mDC表面CD200R表达阳性率与ESR呈负相关,提示其与疾病炎症反应水平关系密切。
mDC摄取、加工、提呈抗原,联系固有免疫和获得性免疫,启动并调整免疫应答极性[18-19]。该过程主要涉及3种信号传递:与MHC分子结合的抗原多肽、共刺激分子CD80/CD86和DC分泌的细胞因子[20]。由于该DC在外周血含量较少,直至20世纪90年代出现体外诱导培养DC的方法后,才建立对其进一步深入研究的平台[21-23]。本实验体外诱导培养MoDC,然后利用LPS刺激其活化[24-25],研究该过程中CD200R表达及上述信号分子的改变。结果表明:LPS刺激后健康对照和SLE患者MoDC均显著活化,且表面CD200R均显著下调,两者之间差异无显著性。此前亦有研究表明鼠小胶质细胞在促炎介质(如LPS)作用下,通过C/EBPβ介导,可导致CD200R1 mRNA表达显著下调[26]。本研究培养体系不同于体内的稳态环境。单核细胞、巨噬细胞及DC起源于共同的髓系祖细胞即巨噬-DC祖细胞,炎症状态下可以分化成炎症性DC或巨噬细胞,发挥抗原处理和提呈功能,然而在稳态下虽然可能发生上述转化,但效率较低[19,27-29]。体外诱导培养的MoDC模拟了炎症性DC的情况,加入的刺激活化物是细菌细胞壁的主要成分LPS,这就进一步模拟了机体的炎症感染状态。在这种情况下,免疫系统功能从免疫耐受向免疫应答转化,即促进炎症反应清除感染源。LPS作用后具有免疫负调功能的CD200R显著下调,提示下调免疫耐受、促进免疫炎症反应,与此正好相符。此前也有研究显示CD200R激动剂不能抑制LPS诱导的巨噬细胞活化,提示在感染状态下,免疫平衡将被重新调整[30]。
综上,推测SLE患者多种免疫耐受机制异常,存在针对自身抗原的免疫炎症反应,具有免疫负性调节功能的CD200/CD200R在炎症状态下下调受体,可能导致其自身免疫耐受进一步下降,形成恶性循环,参与SLE发病过程。亦有研究表明多种病原微生物通过利用CD200/CD200R1通路,上调CD200和(或)CD200R1表达,抑制机体免疫防御反应,诱导病原免疫耐受[10]。故需进一步深入探索该通路可能的调节机制及其在自身免疫性疾病中的作用,以便为其临床应用提供理论依据[31]。
(本文图1见插页Ⅰ)
[1]Mackern-Oberti JP,Llanos C,Riedel CA,et al.Contribution of dendritic cells to the autoimmune pathology of systemic lupus erythematosus[J].Immunology,2015,146:497-507.
[2]Son M,Kim SJ,Diamond B.SLE-associated risk factors affect DC function[J].Immunol Rev,2016,269:100-117.
[3]Webb M,Barclay AN.Localisation of the MRC OX-2 glycoprotein on the surfaces of neurones[J].J Neurochem,1984,43:1061-1067.
[4]Barclay AN.Different reticular elements in rat lymphoid tissue identified by localization of Ia,Thy-1 and MRC OX 2 antigens[J].Immunology,1981,44:727-736.
[5]Holmannova D,Kolackova M,Kondelkova K,et al.CD200CD200R paired potent inhibitory molecules regulating immune and inflammatory responses;Part Ⅰ:CD200CD200R structure,activation,and function[J].Acta Medica (Hradec Kralove),2012,55:12-17.
[6]Hatherley D,Cherwinski HM,Moshref M,et al.Recombinant CD200 protein does not bind activating proteins closely related to CD200 receptor[J].J Immunol,2005,175:2469-2474.
[7]Gorczynski R,Khatri I,Lee L,et al.An interaction between CD200 and monoclonal antibody agonists to CD200R2 in development of dendritic cells that preferentially induce populations of CD4+CD25+T regulatory cells[J].J Immunol,2008,180:5946-5955.
[8]Wright GJ,Jones M,Puklavec MJ,et al.The unusual distribution of the neuronallymphoid cell surface CD200 (OX2) glycoprotein is conserved in humans[J].Immunology,2001,102:173-179.
[9]Hoek RM,Ruuls SR,Murphy CA,et al.Down-regulation of the macrophage lineage through interaction with OX2 (CD200)[J].Science,2000,290:1768-1771.
[10] Vaine CA,Soberman RJ.The CD200-CD200R1 inhibitory signaling pathway:immune regulation and host-pathogen interactions[J].Adv Immunol,2014,121:191-211.
[11] Li Y,Zhao LD,Tong LS,et al.Aberrant CD200CD200R1 expression and function in systemic lupus erythematosus contributes to abnormal T-cell responsiveness and dendritic cell activity[J].Arthritis Res Ther,2012,14:R123.
[12] Mihrshahi R,Barclay AN,Brown MH.Essential roles for Dok2 and RasGAP in CD200 receptor-mediated regulation of human myeloid cells[J].J Immunol,2009,183:4879- 4886.
[13] Zhang S,Cherwinski H,Sedgwick JD,et al.Molecular mechanisms of CD200 inhibition of mast cell activation[J].J Immunol,2004,173:6786- 6793.
[14] Cherwinski HM,Murphy CA,Joyce BL,et al.The CD200 receptor is a novel and potent regulator of murine and human mast cell function[J].J Immunol,2005,174:1348-1356.
[15] Gorczynski RM,Chen Z,Yu K,et al.CD200 immunoadhesin suppresses collagen-induced arthritis in mice[J].Clin Immunol,2001,101:328-334.
[16] Banerjee D,Dick AD.Blocking CD200-CD200 receptor axis augments NOS-2 expression and aggravates experimental autoimmune uveoretinitis in Lewis rats[J].Ocul Immunol Inflamm,2004,12:115-125.
[17] Gorczynski RM,Cattral MS,Chen Z,et al.An immunoadhesin incorporating the molecule OX-2 is a potent immunosuppressant that prolongs allo- and xenograft survival[J].J Immunol,1999,163:1654-1660.
[18] Bell D,Young JW,Banchereau J.Dendritic cells[J].Adv Immunol,1999,72:255-324.
[19] Lopez-Bravo M,Ardavin C.Invivoinduction of immune responses to pathogens by conventional dendritic cells[J].Immunity,2008,29:343-351.
[20] Sabatte J,Maggini J,Nahmod K,et al.Interplay of pathogens,cytokines and other stress signals in the regulation of dendritic cell function[J].Cytokine Growth Factor Rev,2007,18:5-17.
[21] Sallusto F,Lanzavecchia A.Efficient presentation of soluble antigen by cultured human dendritic cells is maintained by granulocytemacrophage colony-stimulating factor plus interleukin 4 and downregulated by tumor necrosis factor alpha[J].J Exp Med,1994,179:1109-1118.
[22] Bender A,Sapp M,Schuler G,et al.Improved methods for the generation of dendritic cells from nonproliferating progenitors in human blood[J].J Immunol Methods,1996,196:121-135.
[23] Romani N,Reider D,Heuer M,et al.Generation of mature dendritic cells from human blood.An improved method with special regard to clinical applicability[J].J Immunol Methods,1996,196:137-151.
[24] Han TH,Jin P,Ren J,et al.Evaluation of 3 clinical dendritic cell maturation protocols containing lipopolysaccharide and interferon-gamma[J].J Immunother,2009,32:399- 407.
[25] Langenkamp A,Messi M,Lanzavecchia A,et al.Kinetics of dendritic cell activation:impact on priming of TH1,TH2 and nonpolarized T cells[J].Nat Immunol,2000,1:311-316.
[26] Dentesano G,Straccia M,Ejarque-Ortiz A,et al.Inhibition of CD200R1 expression by CEBP beta in reactive microglial cells[J].J Neuroinflammat,2012,9:165.
[27] Shortman K,Naik SH.Steady-state and inflammatory dendritic-cell development[J].Nat Rev Immunol,2007,7:19-30.
[28] Liu K,Nussenzweig MC.Origin and development of dendritic cells[J].Immunol Rev,2010,234:45-54.
[29] Geissmann F,Manz MG,Jung S,et al.Development of monocytes,macrophages,and dendritic cells[J].Science,2010,327:656- 661.
[30] Jenmalm MC,Cherwinski H,Bowman EP,et al.Regulation of myeloid cell function through the CD200 receptor[J].J Immunol,2006,176:191-199.
[31] Holmannova D,Kolackova M,Kondelkova K,et al.CD200CD200R paired potent inhibitory molecules regulating immune and inflammatory responses;Part Ⅱ:CD200CD200R potential clinical applications[J].Acta Medica (Hradec Kralove),2012,55:59- 65.

