2型糖尿病患者下丘脑功能连接的静息态功能磁共振研究
邓灵灵,刘珺,刘煌辉,刘华生,陈娟,刘文,容鹏飞,王维
2型糖尿病患者下丘脑功能连接的静息态功能磁共振研究
邓灵灵,刘珺,刘煌辉,刘华生,陈娟,刘文,容鹏飞,王维*

目的 利用静息态功能磁共振技术探索2型糖尿病(T2DM)患者下丘脑与其他脑区功能连接的改变,明确T2DM是否损伤下丘脑的相关功能连接。材料与方法 本研究共纳入59名T2DM患者及49名对照组志愿者,通过德国西门子 MR仪采集T1WI、T2W I、T2压水序列、高分辨率3D T1W I结构像和静息态功能数据,计算下丘脑与全脑体素的功能连接值并进行组间比较,然后提取组间存在显著差异脑区的功能连接平均值并对其与临床数据进行相关性分析。结果 T2DM患者左、右侧下丘脑与右侧桥脑、左背外侧前额叶、眶额皮层、左顶下小叶、右侧枕中回间的功能连接强度均低于正常组(P<0.05)。除此之外,左侧下丘脑与左侧梭状回、右侧颞下回、左侧楔前叶间的功能连接强度显著减低,左侧下丘脑与左侧岛叶间的功能连接强度显著增高(P<0.05);右侧下丘脑与左侧舌回、右侧中央前回/右侧中央后回间的功能连接强度显著减低(P<0.05)。相关性分析结果显示左侧下丘脑-左背外侧前额叶间功能连接强度的减低与糖化血红蛋白值存在负相关性(r=–0.24,P=0.04)。结论 T2DM损害了下丘脑与多个脑区的功能连接,其中同侧下丘脑与背外侧前额叶间功能连接减低与糖尿病严重程度相关。静息态功能磁共振能够反映2型糖尿病的严重程度。
2型糖尿病;下丘脑;静息态功能磁共振;功能连接
Received 14 Jan 2016, Accepted 2 Mar 2016
ACKNOW LEDGMENTSThis work was part of project of National Key Clinical Specialty(No. 2013-544); National Natural Science Foundation of China (No. 8
1471715).
糖尿病是一种以能量代谢失衡为主要特征的代谢性疾病,大脑是能量平衡调节的关键部位[1]。研究发现大脑能量调节功能异常是促进糖尿病发生的重要因素[2]。下丘脑作为能量信息传入和调节信息传出的关键点,在糖尿病个体中,下丘脑的功能是受损的。研究发现正常人口服葡萄糖后下丘脑区域的血氧水平依赖(blood oxygenation level dependent, BOLD)会被抑制,2型糖尿病(T2DM)患者这种抑制作用消失[3]。除下丘脑外,研究发现大脑中营养物质感受神经元存在广泛分布[4],下丘脑作为血糖调节的中枢,与多个脑区间存在信息交换和传递[5]。如何相互协同完成感知和调节任务,以及下丘脑与这些脑区的协同作用在T2DM中是否受损均需进一步探讨。
静息态功能磁共振(resting-state functional MRI, rs-fMRI)可以评价大脑神经活动激活的模式和程度[6],具有无创和操作简单的优点。大脑各脑区间是不断进行信息交换的。静息态功能连接度量脑区间神经生理活动的时间依赖[7],反映脑区间信息交换的程度,是分析大脑组织情况及功能异常的重要手段[8-9]。许多研究采用rs-fMRI对T2DM认知损害进行了分析[10-12],但T2DM是否影响下丘脑的功能连接缺乏研究。因此采用rs-fMRI研究病程在5年以内且没有脑血管病变影像学证据的T2DM患者与正常人下丘脑相关功能连接的差异,以明确T2DM患者下丘脑与周围脑区间的功能连接关系,为T 2DM神经损伤机制研究提供依据。
1 材料与方法
1.1 一般资料
本研究拟招募T2DM患者及匹配的正常志愿者,T2DM组纳入标准:(1)符合2009年美国糖尿病协会(American Diabetes Association, ADA)T2DM诊断标准,确诊为T2DM;(2)病程1~5年;(3)年龄30~80岁;(4)右利手。排除标准:(1)患与糖尿病无关的神经精神、脑白质异常信号及脑血管疾病等;(2)患肿瘤、结缔组织病、凝血功能障碍或其他影响脑功能的慢性疾病;(3)有冠心病史及高血压病史;(4)有酗酒史及药物滥用史;(5)磁共振检查禁忌症。
患者一般资料主要有性别、年龄、受教育程度;临床资料包括身高、体重、腰围、体重指数、血压、空腹血糖和2小时餐后血糖、空腹胰岛素、空腹C肽水平、糖化血红蛋白(HbA1C)、甘油三脂、总胆固醇、高低密度脂蛋白、低密度脂蛋白、尿常规。并根据糖尿病稳态模型(homeostasis model assessment, HOMA)计算胰岛素抵抗指数HOMA2-IR用来测量胰岛素抵抗水平。本研究通过中南大学湘雅三医院伦理委员会审查,所有受试者被告知试验流程并签订知情同意书。
1.2 MRI数据采集
所有被试者均采用Avanto 1.5 T MR仪(德国西门子公司)进行扫描,受试者在扫描过程中保持清晰,头部不动。扫描序列如下:(1)MRI常规序列包括T1W I、T2W I以及T2压水序列,排除脑器质性疾病及脑白质变性;(2) rs-fMRI,EPI序列,扫描参数:TR/TE 2000/40 ms,FA=90°,层厚=4.0 mm,层间距=1.0 mm,层数=28,矩阵=64×64,FOV=240 mm×240 mm,NEX=1.0,扫描时间= 8 m in 26 s;(3)高分辨率全脑3D T1W I结构像,扫描参数:TR/TE 1900/2.93 ms,FA=15°,层厚=1.0 mm,层间距=0 mm,层数=176,矩阵=256×256,FOV=240 mm×240 mm,NEX=1.0,扫描时间=7 m in 3 s。
1.3 MR数据处理
静息态数据采用DPARSF (http://restfm ri.net)软件进行预处理,为了使受试者适应扫描,排除前10个全脑EPI数据,对余下的240个全脑EPI数据进行图像层校准、运动校正;采用仿射变换和非线性变形把数据转换到标准MNI(Montreal NeurologicalInstitute)空间,并把体素大小重采样为3 mm×3 mm× 3 mm;为了去除噪声和运动的干扰,对数据采用0.01~0.1 Hz的数据滤波,并根据Friston 24 参数模型[13]剔除头动,脑脊液和白质信号带来的混杂效应。最后采用半径为6 mm高斯滤波器进行空间平滑。
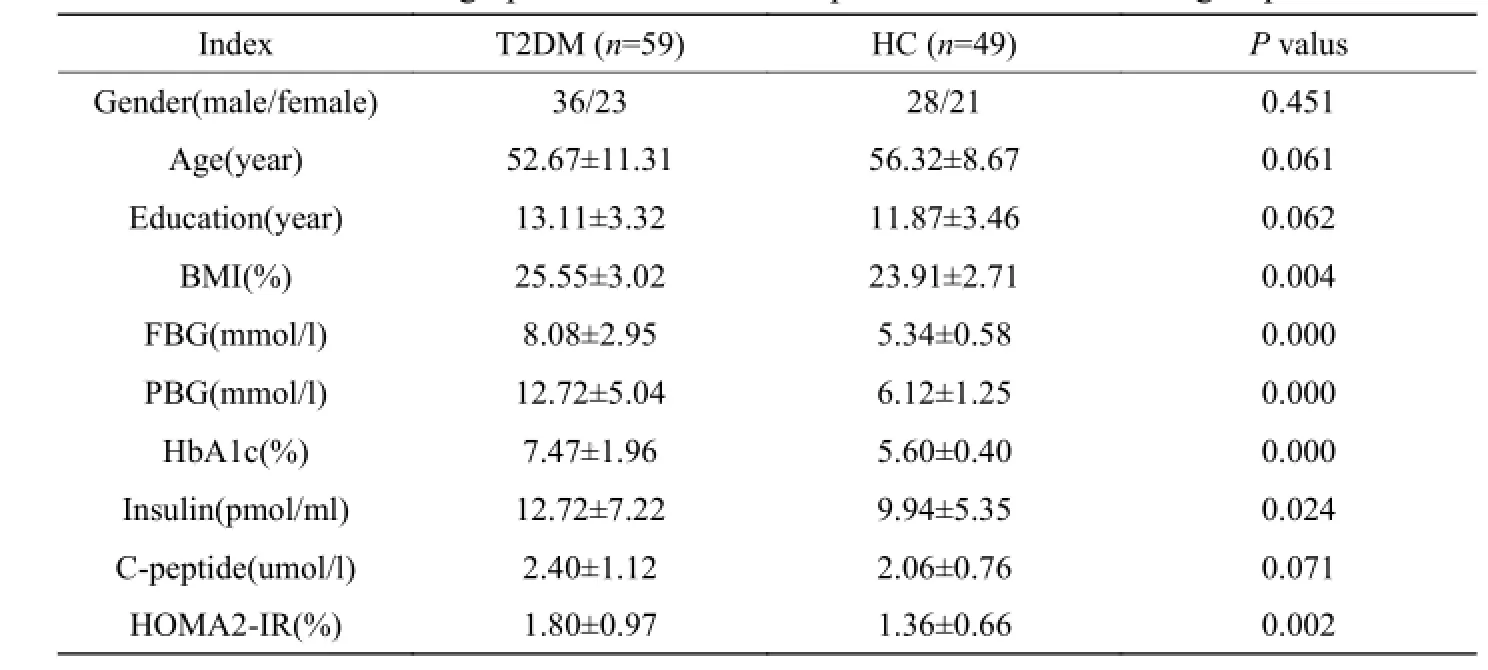
表1 受试者基本信息和部分临床资料Tab. 1 Demographic information and part clinical data of two groups

表2 T2DM患者中与双侧下丘脑存在异常连接的脑区Tab. 2 Brain regions w ith significant altered functional connection w ith bilateral hypothalamus in T2DM group
选取双侧下丘脑为种子点,根据文献[14]定义的M NI坐标(左侧x=–4,y=–1,z=–13;右侧:x=5,y=–1,z=–13)构建2个半径为2 mm的球形种子点,计算种子点与大脑各体素之间的功能连接获得大脑功能连接图。并采用Fisher转换把计算得到的功能连接值转换为Z值。
1.4 统计分析
采用SPSS 19软件对两组受试者的一般资料、临床指标等进行双样本t检验,对性别行χ2检验。采用单向AVONA分析对两组被试者下丘脑与全脑体素间功能连接进行组内比较;为了比较两组受试者下丘脑与全脑体素间功能连接的差异,采用双样本t检验进行组间统计,所有结果经A lphaSim多重比较校正(阈值设置为P<0.005,体素数>30,对应为校正后的阈值P<0.05)。显著性结果用xjview软件(http://www. alivelearn.net/xjview 8/)呈现。最后,在T2DM组提取存在显著组间差异的脑区的功能连接平均值,与患者的糖尿病相关指标(如糖化血红蛋白、胰岛素抵抗指数)作皮尔逊相关性分析,并去除被试者年龄、性别和受教育程度的影响。
2 结果
2.1 一般资料
共有108例对象纳入实验,T2DM组59例(男36,女23),正常对照组49例(男28,女21),两组的年龄、性别、受教育年限基本匹配,体重指数、空腹血糖、餐后血糖、HbA 1c、空腹胰岛素、HOMA2-IR等指标有显著差异(表1)。

图1 与左侧下丘脑功能连接存在显著组间差异的脑区。 A:右侧桥脑;B:左侧梭状回;C:右侧颞下回;D:右侧眶额皮层;E:右侧枕中回;F:左侧顶下小叶;G、I:左背外侧前额叶;H:左侧楔前叶;J:左侧脑岛Fig. 1 Brain regions w ith significantly altered functional connection w ith left hypothalamus. A: Right brainstem; B: Left fusiform; C: Right inferior temporal gyrus; D: Right orbitofrontal cortex; E: Right m iddle occipital gyrus; F: Left inferior parietal lobule; G, I: Left dorsolateral prefrontal cortex; H: Left precuneus; J: Left insula.
2.2 下丘脑功能连接分析
功能连接图组内统计结果显示T2DM患者组及正常对照组中双侧下丘脑与多个脑区间存在显著的功能连接。
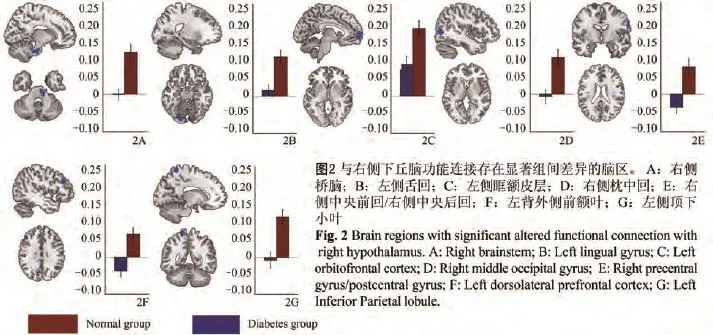
功能连接图的组间比较结果显示T2DM组相较于正常组下丘脑与多个脑区间功能连接存在显著性改变,其中双侧下丘脑与右侧桥脑、左侧额中回、眶额皮层、右侧枕中回、左侧顶下小叶间的功能连接强度低于正常组(P<0.05)(表2,图1、2);左侧下丘脑与左侧梭状回、右侧颞下回、左侧楔前叶间的功能连接强度低于正常组(P<0.05),左侧下丘脑与左侧岛叶间的功能连接强度高于正常组(P<0.05)(表2,图1);右侧下丘脑与左侧舌回、右侧中央前回/右侧中央后回间的功能连接强度低于正常组(P<0.05)(表2,图2)。
2.3 相关性分析
对存在显著组间差异的脑区功能连接平均值与HbA 1c、HOMA 2-IR进行相关性分析,结果显示左侧下丘脑与左背外侧前额叶间功能连接与糖化血红蛋白存在负相关性(r=–0.24,P=0.04,FDR校正),见图3。即糖化血红蛋白值越高,左下丘脑与左背外侧前额叶间功能连接强度越低;与胰岛素抵抗指数之间无明显相关性(P>0.05)。
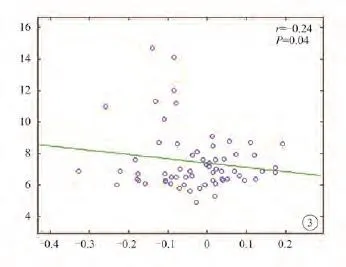
图3 T2DM患者中左侧下丘脑与左背外侧前额叶间的功能连接强度减低与糖化血红蛋白值存在负相关性Fig. 3 HbA 1c w as inversely correlated w ith functional connection values betw een left hypothalamus and left dorsolateral prefrontal cortex in T2DM patients group.
3 讨论
本研究探讨了 T2DM 患者静息状态下下丘脑相关功能连接的变化。结果发现,T2DM 患者下丘脑与多个脑区间功能连接出现异常,这些脑区主要位于前额叶(左背外侧前额叶、左眶额皮层、左侧脑岛)、脑干(右侧桥脑)。除此之外,顶叶(右侧中央前回/中央后回、左顶下小叶、左侧楔前叶)、枕叶(枕中回、舌回)以及颞叶(右侧颞下回)叶也存在部分脑区与下丘脑间的功能连接显著减低。并且左侧下丘脑与左背外侧前额叶间功能连接强度与H1ABc值存在显著负相关。
上述结果说明T2DM 损害了下丘脑与其他多个脑区间的协同作用。下丘脑功能受损在糖尿病或糖尿病相关因素实验中均有体现,在肥胖动物模型、肥胖病人中下丘脑的营养物质感受是受损的[15-16]。T2DM 患者中葡萄糖对下丘脑的抑制作用减弱[3]。下丘脑作为能量感知和调节的关键部位,存在多种类型神经核团,并且各自的功能不同,能感知血糖及其他营养物质的刺激并调节其代谢[17]。而笔者的研究进一步发现了下丘脑与其他多个脑区间的功能连接显著减低,因此T2DM不仅能损害下丘脑神经元对血糖等营养物质的感知和调节代谢的功能,而且能损害下丘脑与其他脑区间的协同作用。
其中,T2DM 患者下丘脑与右侧桥脑间功能连接强度低于正常组。正常人功能连接研究发现下丘脑与脑干存在功能连接[18]。桥脑是脑干的重要组成部分,脑干作为能量物质感知和调节其代
谢的另一关键部位,是内脏感觉传递中间通路的组成部分[19],与下丘脑存在广泛连接[20]。目前已有研究发现T1DM 患者在低血糖状态下下丘脑与脑干间的连接出现增加[21];下丘脑-脑干间的通路是感受营养物质的中间通路[22-23]。因此本试验的结果从功能磁共振的角度证实了上述发现,并进一步反映了下丘脑与脑干间通路在T2DM中是受损的,为体外探测2型糖尿神经损伤机制提供了实验依据。
本研究除了发现T2DM患者下丘脑与多个脑区间的功能连接减低之外,还发现左侧下丘脑与左侧脑岛前部间的功能连接增高。目前已有研究发现肥胖者岛叶的灰质体积较正常人减小[24],并且在1型糖尿病患者其功能是受损的[25]。脑岛综合内脏、躯体及自稳态信息,调节适应性的行为来反馈外界刺激:岛叶后部区域收集包括血糖、胰岛素在内的躯体稳态信号,并传递到岛叶前部[26];在岛叶前部区域,躯体自稳态信号与食物的视觉、嗅觉等饮食相关信号整合形成对进食的适应性调节[27],影响机体的葡萄糖代谢。因此,T2DM可能损伤了脑岛对躯体感觉及自稳态信号的感知功能,但具体机制需要进一步研究。
T2DM患者下丘脑与眶额皮层间的功能连接也有减低。眶额皮层是位于额叶前下方的前额皮层,是奖赏通路中的重要部份。早期的实验证据表明眶额皮层是汇聚食物刺激相关感觉信息的关键部位[28],不仅能感知食物刺激,也能根据信息来调节奖赏行为和摄食行为[29]。最近研究发现T2DM 患者眶额皮层灰质体积较正常人减少[30],肥胖志愿者眶额皮层对食物的响应降低[31]。而本研究发现T2DM患者下丘脑与眶额皮层间功能连接减低,提示T2DM可能损伤了摄食相关的奖赏机制,但其具体机制有待于进一步研究。
另外,T2DM 患者左下丘脑与左背外侧前额叶间的功能连接减低,提示T2DM 可能损害了两者之间的协同作用。已有研究发现T2DM 患者中,背外侧前额叶是出现异常的[32];肥胖者背外侧前额叶的脑灰白质密度低[33],并在进食时背外侧前额叶神经活动明显降低[34];本研究的发现为T2DM的进食失调可能提供了新的神经生理依据。背外侧前额叶是执行控制网络的重要节点,是认知控制和决策的重要区域。最近的研究发现背外侧前额叶在中枢调控进食行为中发挥关键作用,接受视觉、味觉、嗅觉以及躯体感觉信号的传入[35]。因此,笔者认为下丘脑与背外侧前额叶间的功能连接减低可能是T2DM 患者饮食控制受损的神经基础。本试验还发现背外侧前额叶的功能连接减低与糖化血红蛋白值存在负相关性,即糖化血红蛋白值越高,背外侧前额叶的功能连接越低可能是由于饮食控制失调和血糖控制不理想导致的,与T2DM的严重程度有关。
总之,本研究采用功能磁共振研究了静息状态下T2DM患者下丘脑与其它脑区间功能连接的改变情况,证实了T2DM患者下丘脑与多个脑区间功能连接存在异常,其中同侧下丘脑与同侧背外侧前额叶间功能连接减低与糖尿病严重程度相关,可能反映了T2DM患者对血糖等营养物质感知和调节通路的异常及对饮食控制的异常,说明静息态功能磁共振能够反映T2DM的严重程度。
[References]
[1]Luquet S, M agnan C. The central nervous system at the core of the regulation of energy homeostasis. Front Biosci (Schol Ed), 2009, 1(1): 448-465.
[2]Schw artz MW, Seeley RJ, Tschöp MH, et al. Cooperation between brain and islet in glucose homeostasis and diabetes. Nature, 2013, 503(7474): 59-66.
[3]Vidarsdottir S, Smeets PAM, Eichelsheim DL, et al. G lucose ingestion fails to inhibit hypothalam ic neuronal activity in patients w ith type 2 diabetes. Diabetes, 2007, 56(10): 2547-2550.
[4]Kievit P, Howard JK, Badman MK, et al. Enhanced leptin sensitivity and improved glucose homeostasis in mice lacking suppressor of cytokine signaling-3 in POMC-expressing cells. Cell metabolism, 2006, 4(2): 123-132.
[5]Levin BE, Kang L, Sanders NM, et al. Role o f neuronal glucosensing in the regulation of energy homeostasis. Diabetes, 2006, 55(Suppl2): 122-130.
[6]Lam CKL, Chari M, Lam TKT. CNS regulation of glucose homeostasis. Physiology, 2009, 24(3): 159-170.
[7]Xie SH, Niu GM, Gao Y, et al. Com parative study of local consistency w ith the resting state m agnetic resonance im aging under ifrst-episode depression. Chin J Magn Reson Imaging, 2015, 6(1): 10-14.
谢生辉, 牛广明, 高阳, 等. 首发抑郁症脑局部一致性静息态MRI 对比研究. 磁共振成像, 2015, 6(1): 10-14.
[8]Van M P, Hulshoff Pol HE. Exp loring the brain netw ork: a review on resting-state fMRI functional connectivity. European Neuropsychopharmacology, 2010, 20(8): 519-534.
[9]Fang JF, W ang Q, W ang B, et al. Application and prospect of functional magnetic resonance imaging reveals changes in brain structure and function in depression. Chin J Magn Reson Imaging, 2015, 6(1): 52-57.
房俊芳, 王倩, 王滨, 等. 功能 MRI 揭示抑郁症脑结构及功能变化的应用及展望. 磁共振成像, 2015, 6(1): 52-57.
[10]Zhou H, Lu W, Shi Y, et al. Im pairments in cognition and resting-state connectivity of the hippocampus in elderly subjects w ith type 2 diabetes. Neuroscience letters, 2010, 473(1): 5-10.
[11]Cui Y, Jiao Y, Chen YC, et al. Altered spontaneous brain activity in type 2 diabetes: a resting-state functional MRI study. Diabetes, 2014, 63(2): 749-760.
[12]Xia W, Wang S, Sun Z, et al. Altered baseline brain activity in type 2 diabetes: a resting-state fMRI study. Psychoneuroendocrinology, 2013, 38(11): 2493-2501.
[13]Friston KJ, W illiams S, Howard R, et al. Movement-related effects in fM RI time-series. M agnetic resonance in m edicine, 1996, 35(3): 346-355.
[14]Lips MA, W ijngaarden MA, van der Grond J, et al. Restingstate functional connectivity of brain regions involved in cognitive control,motivation,and reward is enhanced in obese fem ales. The Am erican journal of clinical nutrition, 2014, 100(2): 524-531.
[15]Parton LE, Ye CP, Coppari R, et al. Glucose sensing by POMC neurons regulates glucose hom eostasis and is impaired in obesity. Nature, 2007, 449(7159): 228-232.
[16]Thaler JP, Yi CX, Schur EA, et al. Obesity is associated w ith hypothalamic injury in rodents and humans. The Journal of clinical investigation, 2012, 122(1): 153.
[17]Suzuki K, Jayasena CN, B loom SR. Obesity and appetite control. Experimental diabetes research, 2012, 2012(3): 824.
[18]Kullmann S, Heni M, Linder K, et al. Resting-state functional connec tivity o f the hum an hypothalam us. Hum an b rain mapping, 2014, 35(12): 6088-6096.
[19]Broberger C, Hökfelt T. Hypothalam ic and vagal neuropeptide circuitries regulating food intake. Physiology & behavior, 2001,74(4): 669-682.
[20]Geerling JC, Shin JW, Chim enti PC, et al. Paraventricular hypothalam ic nucleus: axonal projections to the brainstem. Journal of Comparative Neurology, 2010, 518(9): 1460-1499.
[21]M usen G, Simonson DC, Bolo NR, et al. Regional brain activation during hypoglycem ia in type 1 diabetes. The Journal of C linical Endocrinology & M etabolism, 2008, 93(4): 1450-1457.
[22]W oods SC. The control of food intake: behavioral versus molecular perspectives. Cell metabolism, 2009, 9(6): 489-498.
[23]Blouet C, Schwartz GJ. Hypothalam ic nutrient sensing in the control of energy homeostasis. Behavioural brain research, 2010, 209(1): 1-12.
[24]Jauch-Chara K, Binkofski F, Loebig M, et al. Blunted brain energy consumption relates to insula atrophy and im paired glucose tolerance in obesity. Diabetes, 2015, 64(6): 2082-2091.
[25]Bolo NR, M usen G, Simonson DC, et al. Functional connectivity of insula,basal ganglia,and prefrontal executive control networks during hypoglycemia in type 1 diabetes. The Journal of Neuroscience, 2015, 35(31): 11012-11023.
[26]Simmons WK, Rapuano KM, Kallman SJ, et al. Categoryspecific integration of homeostatic signals in caudal but not rostral human insula. Nature neuroscience, 2013, 16(11): 1551-1552.
[27]Naqvi NH, Bechara A. The insula and drug addiction: an interoceptive view of pleasure,urges,and decision-making. Brain Structure and Function, 2010, 214(5-6): 435-450.
[28]W ang GJ, Volkow ND, Telang F, et al. Exposure to appetitive food stimuli markedly activates the human brain. Neuroim age, 2004, 21(4): 1790-1797.
[29]St-Onge MP, Sy M, Heym sfield SB, et al. Hum an cortical specialization for food: a functional m agnetic resonance imaging investigation. The Journal of nutrition, 2005, 135(5): 1014-1018.
[30]Kumar A, Haroon E, Darw in C, et al. Gray matter prefrontal changes in type 2 diabetes detected using MRI. Journal of M agnetic Resonance Imaging, 2008, 27(1): 14-19.
[31]Killgore WDS, Yurgelun-Todd DA. Body mass predicts orbitofrontal activity during visual presentations of high-calorie foods. Neuroreport, 2005, 16(8): 859-863.
[32]M arder TJ, Flores VL, Bolo NR, et al. Task-induced brain activity patterns in type 2 diabetes: a potential biomarker for cognitive decline. Diabetes, 2014, 63(9): 3112-3119.
[33]Le DS, Pannacciulli N, Chen K, et al. Less activation of the left dorsolateral prefrontal cortex in response to a meal: a feature of obesity. The American journal of clinical nutrition, 2006, 84(4): 725-731.
[34]Scharmüller W, Übel S, Ebner F, et al. Appetite regulation during food cue exposure: a com parison of normal-weight and obese women. Neuroscience letters, 2012, 518(2): 106-110.
[35]Davids S, Lauffer H, Thoms K, et al. Increased dorsolateral prefrontal cortex activation in obese children during observation of food stimuli. International Journal of Obesity, 2010, 34(1): 94-104.
The functional connectivity of hypothalam us in T2DM patients: a resting-state fMRI study
DENG Ling-ling, LIU Jun, LIU Huang-hui, LIU Hua-sheng, CHEN Juan, LIU Wen, RONG Peng-fei, WANG Wei*
Department of Radiology, the Third Xiangya Hospital of Central South University, Changsha 410013, China
Ob jective: To investigate w hether functional connection betw een hypothalamus and other brain regions is impaired in type 2 diabetes mellitus (T2DM), the resting-state MRI was utilized to analyze the connectivity between hypothalamus and other brain regions. M aterials and M ethods: This study included the T2DM patients who were diagnosed w ithin 1-5years (T2DM, n=59), and age, sex, educationmatched healthy control subjects(HC, n=49). T2W I, FLAIR, 3D-T1W I and restingstate fMRI data were collected by Siemens MR scanner. Functional connection values between bilateral hypothalamus and other voxels in the brain were calculated, the resulted values of both groups were compared using two-sample t-test to locate the regions w ith significant change. Then correlation analysis was conducted between clinical data and functional connection values extracted from significantly different brain regions. Results: Compared to healthy control subjects, T2DM patients showed significantly decreased functional connection values between left hypothalamus, right hypothalamus and right brainstem, left dorsolateral prefrontal cortex, orbitofrontal cortex, left Inferior parietal lobule, right m iddle occipital gyrus. In T2DM patients, functional connection values between left hypothalamus and inferior temporal gyrus,left precuneus, left fusiform also decreased significantly, however, the functional connection values in left insula increased; the functional connection values between right hypothalamus and left lingual gyrus, right precentral gyrus/postcentral gyrus decreased. M oreover, negative correlations were found between HbA1c and functional connection values between left hypothalamus and left dorsol ateral prefrontal cortex (r=–0.24, P=0.04) in T2DM patients group. Conclusion: The functional connection between hypothalamus and other brain regions is impaired in T2DM patients. Moreover, this study indicated that the change of functional connection values between left dorsolateral prefrontal cortex and left hypothalamus was significantly associated with diabetes mellitus severity. Resting-state MRI can reflect the severity of T2DM.
Type 2 diabetes mellitus; Hypothalamus; Resting-state MRI; Functional connectivity
国家临床重点专科基金项目(编号:2013-544);国家自然科学基金项目(编号:81471715)
中南大学湘雅三医院放射科,长沙410013
王维,E-m ail: c jr.w angw ei@v ip. 163.com
2016-01-14
接受日期:2016-03-02
R445.2;R587.1
A
10.12015/issn.1674-8034.2016.04.006
邓灵灵, 刘珺, 刘煌辉, 等. 2型糖尿病患者下丘脑功能连接的静息态功能磁共振研究. 磁共振成像, 2016, 7(4): 270–276.
*Correspondence to: Wang W, E-mail: cjr.wangwei@vip.163.com