氢质子磁共振波对颅内转移瘤与胶质瘤鉴别及生存分析的意义
陈立坚
氢质子磁共振波对颅内转移瘤与胶质瘤鉴别及生存分析的意义
陈立坚*

目的 探讨氢质子磁共振波谱(1H magnetic resonance spectroscopy,1H-MRS)鉴别高级别脑胶质瘤与肺癌脑转移瘤的临床鉴别诊断及其对生存预测的应用价值。材料与方法 回顾性分析经手术病理确诊及经lH-MRS检查的高级别脑胶质瘤患者36例和肺癌脑转移瘤患者43例,并计算1H-MRS检查的N-乙酰天门冬氨酸(N-acetylaspartate, NAA)/胆碱(Choline, Cho)、NAA/肌酸(Creatine, Cr)和Cho/Cr的比值。根据回访记录的生存时间,采用Cox风险模型进行多因素分析筛选出对肺癌脑转移瘤患者生存具有独立预测作用的因素。结果 高级别脑胶质瘤和肺癌脑转移瘤的瘤周组织的Cho/NAA和Cho/Cr比值差异存在显著性(P<0.01),经Cox多因素回归分析肺癌脑转移瘤外周Cho/Cr是生存时间的独立预测因素(P<0.05)。结论 肺癌脑转移瘤和高级别脑胶质瘤瘤周组织间Cho/NAA和Cho/Cr 比值的差异可作为1H-MRS鉴别高级别脑胶质瘤和肺癌脑转移瘤的特征,肺癌脑转移瘤外周Cho/Cr可能对评估患者生存时间有一定意义。
氢质子磁共振波谱;肿瘤转移;脑转移瘤;高级别脑胶质瘤;磁共振成像;N-乙酰天门冬氨;胆碱;肌酸
Received 21 Sep 2015, Accepted 30 Dec 2015
ACKNOW LEDGMENTSThis work was part of Qinzhou Municipal Science and Technology Bureau of self funding research project of Guangxi (No. 20135801).
近年来国内外临床研究就磁共振波谱(magneticresonance spectroscopy, MRS)鉴别孤立脑转移瘤及高级别脑胶质瘤多侧重于肿瘤实质的研究。氢质子磁共振波谱(1H m agnetic resonance spectroscopy,1H-MRS)分析可反映出脑内主要代谢物的水平,并且为无创性研究脑肿瘤物质代谢特征的方法;再者由于胶质瘤与脑转移瘤的组织起源及瘤周病理的不同,本文通过回顾性分析探讨瘤周1H-MRS特征在孤立脑转移瘤与脑胶质瘤的鉴别及预后评估的意义。
1 材料与方法
1.1 一般资料
回顾性收集2012年1月至2015年4月经手术取得病理诊断为肺癌脑转移瘤并术后进行相应处理及随访患者43例,脑胶质瘤患者36例。所有患者MRS检查前均未接受化疗和/或放疗,没有脑外伤和/或脑手术史。MRS检测采用德国西门子Sonata 1.5 T超导型磁共振仪和环形极化头线圈。
1.2 检查方法
使用1.5 T超导磁共振机(西门子MAGNETOM Essenza,德国),以磁共振成像(magnetic resonance im aging, MRI)常规影像为基础,在增强扫描后选择扫描层面进行1H-MRS检查,采用多体素氢质子波谱脑检查(p roton brain exam/m uitiple voxel, PROBE/SI)。波谱采样体素定位尽量避开脑脊液、颅骨及液化坏死区,感兴趣区(region o f interest, ROI)包括病灶区、周边水肿带和对侧(或同侧)正常脑组织,层厚10 mm,扫描野(field of view, FOV)24 cm × 24 cm,激励次数(number of excitation, NEX): l,相位矩阵18 × 18,抑水率>96%,线宽(FMNH)值<8 Hz。
1.3 图像分析和数据测量方法
用波谱仪自带软件包FuneTool对2D1H-MRS检查获得信号进行后处理分析,由我科两位经验丰富的MRI诊断医师采取双盲法分别进行图像分析,选择如下图像定义特征:(1)瘤灶组织:在T1W I增强时强化的区域,代表肿瘤组织的实体部分。(2)瘤周水肿区:平扫T1W I呈低信号,T2W I呈高信号,无强化效应的紧邻瘤灶区域边缘20 mm以内的区域。(3)对照区:对侧相应位置的正常脑实质。以扫描时ROI内的体素作为单位,分别观察和测量计算出瘤灶组织区、瘤周组织区和对侧正常脑组织三处ROI体素内代谢物N-乙酰天门冬氨酸(N-acety laspartate, NAA)、胆碱(Choline, Cho)及肌酸(Creatine, Cr)等物质的波峰下面积积分,并计算出ROI体素内NAA/Cho、NAA/Cr及Cho/Cr的比值。
1.4 统计学处理
采用SPSS 16.0软件进行统计分析。对计数资料采用行×列χ2检验,对1H-MRS所得数据等资料两样本间的比较采用t检验。采用Cox风险模型进行多因素分析,筛选出对脑转移生存具有独立预测作用的因素。本研究所有的检验均采用双侧检验,P<0.05为差异有统计学意义。
2 结果
2.1 患者一般资料比较
高级胶质瘤组和脑转移瘤组的年龄、性别、民族、病理类型及KPS评分比较差异无统计学意义(P>0.05),见表1。
2.2 脑转移瘤和高级脑胶质瘤的瘤灶代谢物比值
高级脑胶质瘤和脑转移瘤的瘤灶组织的Cho/NAA、Cho/Cr和NAA/Cr比值差异无统计学意义(P>0.05),见表2。
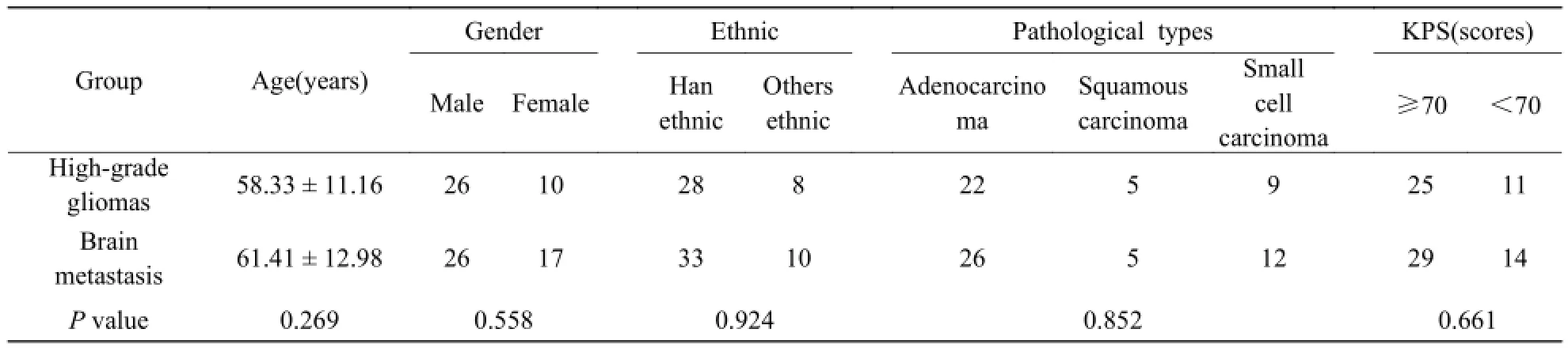
表1 高级胶质瘤组和脑转移瘤组患者一般临床资料比较Tab. 1 General comparison of the clinical data in brain metastasis group and high-grade gliomas group
表2 脑转移瘤组和高级胶质瘤组的瘤灶代谢物比值比较(± s)Tab. 2 The comparison for the ratio of metabolites in brain metastasis group and high-grade gliomas group± s)
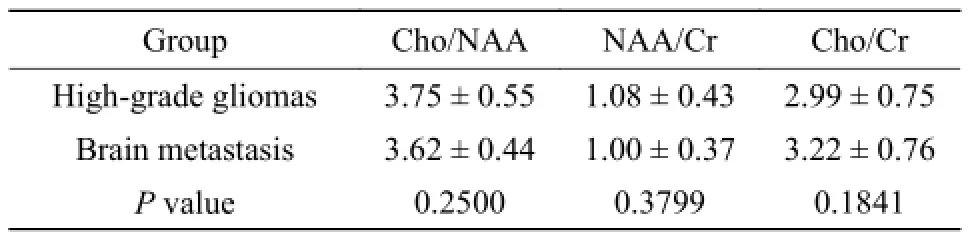
表2 脑转移瘤组和高级胶质瘤组的瘤灶代谢物比值比较(± s)Tab. 2 The comparison for the ratio of metabolites in brain metastasis group and high-grade gliomas group± s)
Group Cho/NAA NAA/Cr Cho/Cr High-grade gliomas 3.75 ± 0.55 1.08 ± 0.43 2.99 ± 0.75 Brain metastasis 3.62 ± 0.44 1.00 ± 0.37 3.22 ± 0.76 P value 0.2500 0.3799 0.1841
表3 高级别脑胶质瘤组与脑转移瘤组的瘤周代谢物的比值比较(± s)Tab. 3 The comparison for the ratio of metabolites in peritumoral area of brain metastasis group and high-grade gliomas group (± s)

表3 高级别脑胶质瘤组与脑转移瘤组的瘤周代谢物的比值比较(± s)Tab. 3 The comparison for the ratio of metabolites in peritumoral area of brain metastasis group and high-grade gliomas group (± s)
Group Cho/NAA NAA/Cr Cho/Cr High-grade gliomas 3.77 ± 0.58 1.19 ± 0.46 3.29 ± 0.80 Brain metastasis 3.26 ± 0.48 1.10 ± 0.35 2.62 ± 0.66 P value 0.0001 0.3303 0.0001
2.3 高级别脑胶质瘤组与脑转移瘤组的瘤周组织各代谢物比值的比较
高级别脑胶质瘤和脑转移瘤的瘤周组织的Cho/NAA和Cho/Cr比值差异存在显著性(P<0.01), NAA/Cr比值差异无统计学意义(P>0.05),见表3及图1~3。
2.4 Cox多因素回归分析
对包括年龄、性别、民族、病理类型、治疗情况、KPS评分、外周Cho/NAA和外周Cho/Cr内的8个变量进行Cox比例风险模型分析(Enter法),结果显示,KPS评分和外周Cho/Cr是肺癌脑转移生存时间的独立预测因素(P<0.05)。而其他因素包括显示年龄、性别、民族、病理类型、治疗情况和外周Cho/NAA均不是肺癌脑转移生存时间(P>0.05),见表4。
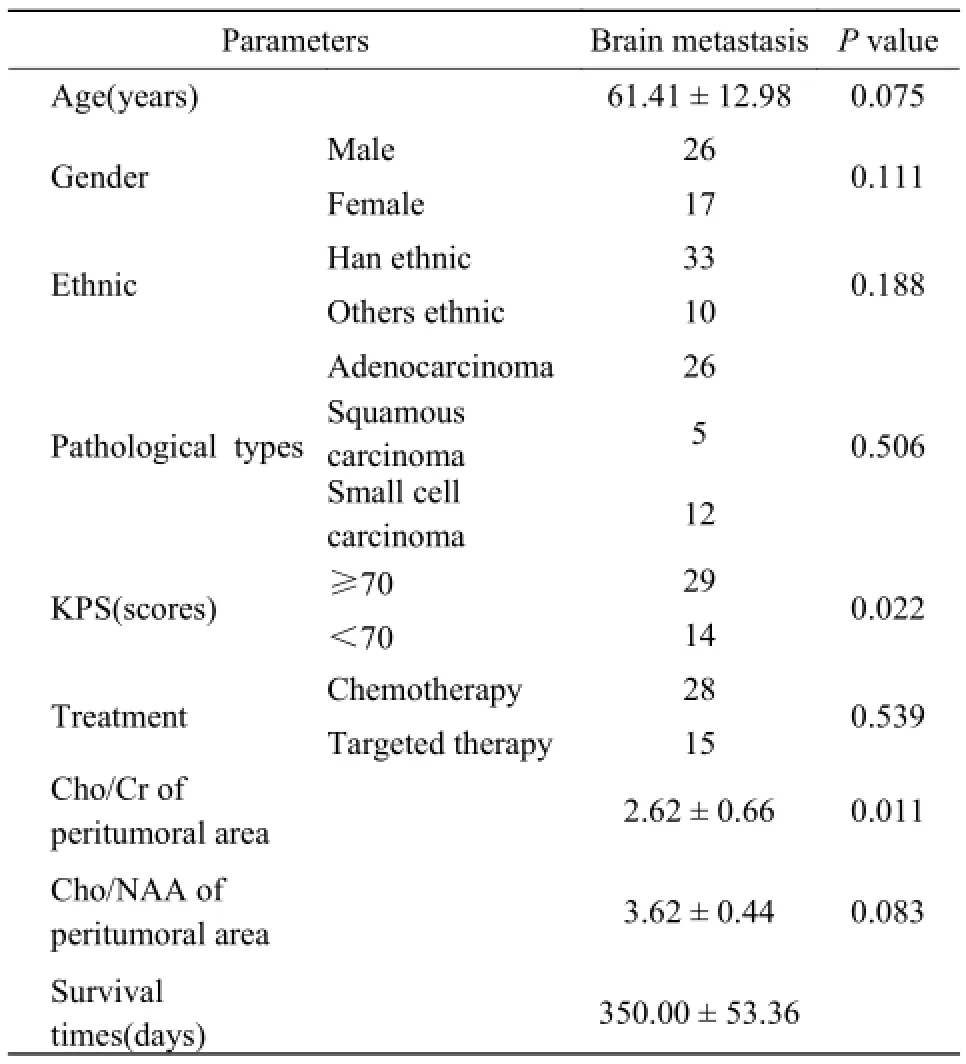
表4 Cox回归分析结果Tab. 4 The results of analysis by Cox regression

图1 肺癌脑转移瘤健侧波谱图 图2 肺癌脑转移瘤瘤灶区波谱图 图3 肺癌脑转移瘤瘤周区波谱图(Cho的波峰无升高,Cho和NAA的波峰比健侧低)Fig. 1 The wave spectrum in normal side of brain metastasis from lung cancer. Fig.2 The wave spectrum in tumor region of brain metastasis from lung cancer. Fig. 3 The wave spectrum in peritumoral area of brain metastasis from lung cancer (The rise of peak for Cho was not found, the peak of Cho and NAA was lower than those in normal side).
3 讨论
近年来病理学研究发现脑转移瘤为膨胀性生长,肿瘤组织血管内皮与其脑外起源组织相似,无血脑屏障,通透性高,导致瘤周水肿明显,瘤周的高T2信号主要是由血管源性水肿引起。临床中也发现当脑转移瘤被切除后,其原瘤周高T2信号可完全消失,证实了脑转移瘤瘤周高T2信号由血管源性水肿引起,而非肿瘤浸润。高级别胶质瘤为浸润性生长或两种方式兼有,肿瘤组织因血脑屏障破坏而强化明显,但瘤周的中枢神经血管的通透性相对较低,瘤周高T2信号至少部分是由于肿瘤浸润引起。高级别胶质瘤肿瘤组织被切除后,原瘤周高T2信号区多不能消失,且常在该区域出现复发病灶,也证实瘤周有肿瘤细胞浸润圆。Cho反映了肿瘤组织内细胞膜转换和细胞增殖,所以高级别胶质瘤瘤周肿瘤细胞浸润及肿瘤细胞增殖,导致出现瘤周Cho升高,而脑转移瘤瘤周主要是血管源性水肿,从而导致Cho增高不明显。本研究显示高级别脑胶质瘤和孤立脑转移瘤的瘤灶组织的Cho/NAA、Cho/Cr和NAA/Cr比值差异无统计学意义,高级别脑胶质瘤和孤立脑转移瘤的瘤周组织的Cho/NAA和Cho/Cr比值差异存在显著性,前者明显高于后者。目前国内外研究也证实高级别脑胶质瘤的瘤周组织的Cho/NAA和Cho/C r比值高于孤立脑转移瘤的瘤周组织的Cho/NAA和Cho/Cr比值[1-5]。由此可见,瘤周1HMRS将提高孤立脑转移瘤和高级别脑胶质瘤术前诊断的准确性。
恶性肿瘤一旦发生脑转移,则预后极差,恶性肿瘤发生脑转移的预后评估对临床治疗有积极意义。实际上,影响脑转移瘤患者的预后的因素较为复杂,不仅受治疗方法的影响,还与病人自身的因素(如:年龄、性别及全身状态)和肿瘤因素(如原发肿瘤的病理类型、脑转移瘤情况、有无颅外转移等)有关。在本研究中发现Cho/Cr比值对肺癌脑转移患者的中位生存时间影响不同,其差别具有统计学意义(P=0.011),Cho/Cr比值低的患者生存期较短。在恶性肿瘤患者的脑转移瘤瘤周血管源性水肿,从而导致Cho增高不明显[1-2],Zakaria等[6]研究发现应用弥散加权成像(diffusion w eighted imaging, DW I)检查脑转移瘤周围组织表面扩散系数与患者的预后有关。故Cho/Cr比值可能是脑转移独立的预后因素。在研究中研究病例数仍较少,Cho/Cr比值是否可以作为脑转移独立的预后评估因素仍有待增加样本量研究。
本研究资料统计发现,在确诊脑转移时身体状况各不相同、治疗方法也有差异的状况下,单因素分析显示KPS评分≥70分的脑转移瘤患者的中位生存时间(10个月)长于KPS评分<70分的患者(7个月),其差异有显著统计学意义(P=0.022)。KPS评分是目前评估恶性肿瘤患者行为状态常用的方法,可以用于反映患者的机体功能状态。在多个学者的研究中[7-8],KPS评分是影响脑转移瘤患者生存期的重要因素,它代表了患者一定的肿瘤负荷情况及对治疗的耐受能力。Rodrigus等人[9]在其研究中将KPS评分分为两组(≥70分和<70分),结果显示不同的KPS评分对肺癌脑转移患者的中位生存时间影响不同,其差别具有统计学意义,KPS评分高的患者生存期较长,故得出KPS评分是脑转移独立的预后因素[10-11]。目前对于众多可能影响脑转移瘤患者预后的因素尚无统一的意见,各研究报道仍存有分歧[12-13]。本组资料显示,60岁以上患者与60岁以下患者的生存期相似,女性与男性患者的生存期相仿,汉族和少数民族脑转移瘤患者的生存期无明显差异,病理类型与脑转移瘤患者的预后无明显差异。本研究对接受手术后行化疗和分子靶向药物治疗进行了比较分析差异无统计学意义。但该结果存在的问题是,合并分子靶向治疗病例数较少,且为回顾性资料,有其内在的局限性,确切的效果有待于大量的随机研究。
通过本研究表明,脑转移瘤的瘤周组织1HMRS的Cho/NAA和Cho/Cr比值对在临床中与高级别脑胶质瘤鉴别有重要意义,另在本研究中发现Cho/Cr比值与患者的预后有关,是否可以作为脑转移独立的预后评估因素仍有待增加样本量研究。
[References]
[1]Yu K, Liu Q, Hao LW, et al. Differential diagnosis of glioblastoma m ultiforme from m etastatic brain tum or using proton and diffusion-weighted image. J Med Imaging, 2014, 24(7): 1085-1088.
于柯, 刘强, 郝利纬, 等.1H-MRS和DW I在胶质母细胞瘤与单发转移瘤中的鉴别诊断价值. 医学影像学杂志, 2014, 24(7): 1085-1088.
[2]B lanchet L, K rooshof PW, Postma GJ, et al. D iscrim ination between metastasis and glioblastoma multiforme based on morphometric analysis of MR images. AJNR Am J Neuroradiol,2011, 32(1): 67-73.
[3]Wang WW, Niu TL, M iao YW, et al. SWI study on astrocytoma grading and differential diagnosis of astrocytoma and solitary metastases. Chin J Magn Reson Imaging, 2015, 6(4): 246-252.
王微微, 牛田力, 苗延巍, 等. SW I对星形细胞瘤分级及与单发转移瘤鉴别诊断的价值. 磁共振成像, 2015, 6(4): 246-252.
[4]Cheng JL, Yang T. Application and development of magnetic resonance im aging in glioma. Chin J M agn Reson Im aging, 2014, 5(S1): 62-67.
程敬亮, 杨涛. 磁共振成像在脑胶质瘤中的应用及进展. 磁共振成像, 2014, 5(S1): 62-67.
[5]He JB, He GW, Geng DY, et al. Diagnostic value of MRS in singular brain metastasis from lung cancer. Journal of Medical Imaging, 2008, 18(1): 8-10.
何江波, 何光武, 耿道颖, 等. MRS在单发肺癌脑转移瘤中的诊断价值. 医学影像学杂志, 2008, 18(1): 8-10.
[6]Zakaria R, Das K, Radon M, et al.Diffusion-weighted MRI characteristics of the cerebral metastasis to brain boundary predicts patient outcomes. BMC Med Imaging, 2014, 3(14): 26.
[7]Caballero JA, Sneed PK, Lamborn KR, et al. Prognostic factors for survival in patients treated w ith stereotactic radiosurgery for recurrent brain metastases after prior whole brain radiotherapy. Int J Radiat Oncol Biol Phys, 2012, 83(1): 303-309.
[8]Jezierska D, Adamska K, Liebert W. Evaluation of results of linac-based radiosurgery for brain metastases from primary lung cancer. Rep Pract Oncol Radiother, 2013, 19(1): 19-29.
[9]Rodrigus P, de Brouwer P, Raaymakers E. Brain metastases and non-small cell lung cancer. Prognostic factors and correlation w ith survival after irradiation. Lung Cancer, 2001, 32(2): 129-136.
[10]K ress MA, Ramakrishna N, Makgoeng SB, et al. Physician selfreported treatment of brain metastases according to patients' clinical and demographic factors and physician practice setting. Radiat Oncol, 2012, 8(7): 188.
[11]Barnholtz-Sloan JS, Yu C, Sloan AE, et al. A nomogram for individualized estimation of survival among patients w ith brain metastasis. Neuro Oncol, 2012, 14(7): 910-918.
[12]Cui SH, Bai H, Dong LL, et al. Analysis of survival predictors in patients w ith lung cancer and brain metastases. Chinese Journal of Lung Cancer, 2015, 18(7): 436-442.
崔少华, 白皓, 董莉莉, 等. 肺癌脑转移生存预测因素分析. 中国肺癌杂志, 2015, 18(7): 436-442.
[13]Tang WH, Alip A, Saad M, et al. Prognostic factors in patients w ith non-small cell lung carcinoma and brain metastases: a Malaysian perspective. Asian Pac J Cancer Prev, 2015, 16(5): 1901-1906.
The discrim ination between brain metastases from lung cancer and high-grade glioma with proton MR spectroscopy and its value for survival predictorsand
CHEN Li-jian*
Department of radiology, tenth A ffiliated Hospital of Guangxi Medical University, Qinzhou 535099, China
Objective: To investigate the clinical discrim ination value of proton MR spectroscopy(1H-MRS) between brain metastasis from lung cancer and high-grade glioma, and access its prognostic value at the same time. M aterials and M ethods: Thirty-six patients of high-grade gliomas and forty-three patients of brain metastasis from lung cancer were studied. Thirty-six patients of high-grade gliomas and fortythree patients of brain metastasis from lung cancer were received1H-MRS. The variety of metabolite peaks including n-acety laspartate (NAA), choline (Cho) and creatine (Cr) were detected in different areas including tumor, peritumoral areas and the normal brain, at the same time the ratio of NAA/Cho, NAA/Cr and Cho/Cr were computed. Cox regression were performed for univariate and multivariate analyses to explore independent predictors influencing the survival of patients w ith lung cancer and brain metastases respectively. Resu lts: Significant differences between peritumoral area of high-grade gliomas and brain metastasis from lung cancer were found in the ratios of Cho/Cr and Cho/NAA (P<0.05). The ratios of NAA/Cr, Cho/Cr and NAA/Cho were independent survival predictors in patients w ith lung cancer and brain metastasis as indicated by Cox proportional hazard model(P<0.05). Conclusion: The ratios of Cho/Cr and Cho/NAA in peritumoral area can be found in brain metastases from lung cancer w ith1H-MRS, which is helpful in discrim ination between lung cancer and highgrade gliomas. The ratios of Cho/Cr may be an independent survival predictors in patients with lung cancer and brain metastasis.
1H magnetic resonance spectroscopy; Neoplasm metastasis; Brain metastases; High-grade glioma; M agnetic resonance imaging; N-acetylaspartate; Choline; Creatine
广西钦州市科技局自筹经费科研课题(编号:20135801)
广西医科大学第十附属医院(钦州市第一人民医院)放射科,钦州 535099
陈立坚,E-mail: clj0066@163.com
2015-09-21接受日期:2015-12-30
R445.2;R739.41
A
10.12015/issn.1674-8034.2016.04.007
陈立坚. 氢质子磁共振波对颅内转移瘤与胶质瘤鉴别及生存分析的意义.磁共振成像, 2016, 7(4): 277–281.
*Correspondence to: Chen LJ, E-mail: clj0066@163.com